ワクチンの種類 遺伝子ワクチン mRNAワクチン DNAワクチン ウイルス・ベクター・ワクチン プロテイン・ベース・ワクチン 組み換えタンパク質ワクチン 不活性化ワクチン 生ワクチン 不活性化ワクチン
ワクチンの種類
遺伝子ワクチン mRNAワクチン DNAワクチン ウイルス・ベクター・ワクチン プロテイン・ベース・ワクチン 組み換えタンパク質ワクチン 不活性化ワクチン 生ワクチン
遺伝子ワクチン mRNAワクチン DNAワクチン ウイルス・ベクター・ワクチン プロテイン・ベース・ワクチン 組み換えタンパク質ワクチン 不活性化ワクチン 生ワクチン

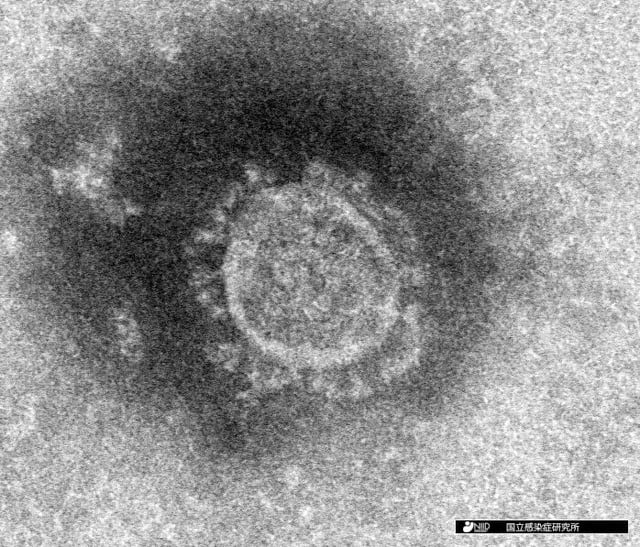
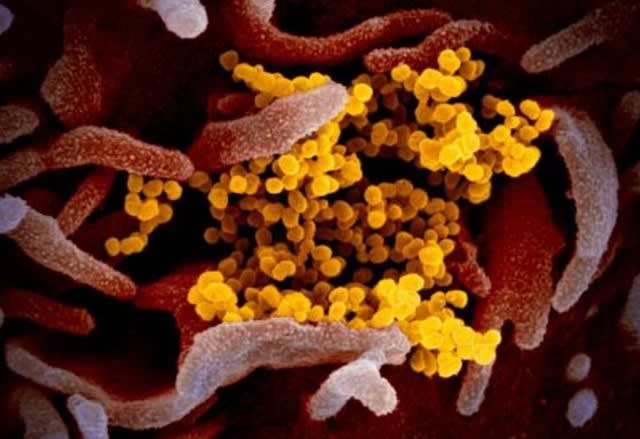
新型コロナウイルスの電子顕微鏡写真 出典 NIAID
ワクチンとは?
ワクチン(vaccine)とは、感染症の予防に用いる医薬品である。病原体を無毒化あるいは弱毒化して作られた抗原を投与することで、ヒトの体内で病原体に対する抗体産生を促し、感染症に対する免疫を獲得する。
「ワクチン」の語源はラテン語のVariolae vaccinae(牛痘)である。1798年にエドワード・ジェンナーが、牛痘を人間に接種することによって天然痘を予防できると実証し、その後にルイ・パスツールがこれを弱毒化して天然痘ワクチンの開発に成功したことに由来している。
ワクチンは液体で、注射や経口、経鼻から投与される。
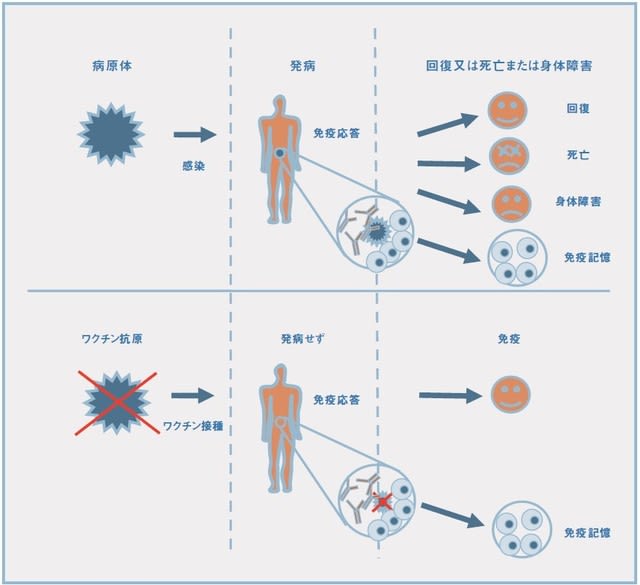
ワクチンの仕組み 出典 米国研究製薬工業協会
生ワクチン
生ワクチンは、生きたウイルスや細菌の病原性(毒性)を、症状が出ないように極力抑えて、免疫が作れるぎりぎりまで弱めた製剤にしたもの。弱毒性ワクチン。
自然感染と同じ流れで免疫ができるので、1回の接種でも充分な免疫を作ることができる。ただ、自然感染より免疫力が弱いので、5~10年後に追加接種したほうがよいものもある。ワクチンの種類によっては、2~3回の接種が必要なものもありある。副作用としては、もともとの病気のごく軽い症状がでることがある。
近年は、遺伝子組換え技術を用いて、生きている病原体を弱毒化して生産するワクチンも数多く登場している。
結核(BCG 牛型結核菌[M. Bovis] を弱毒化)、麻しん(はしか)、風しん、おたふくかぜ、水痘(みずぼうそう)、黄熱病、、ロタウイルス感染症など
不活化ワクチン
不活化ワクチンは、ウイルスや細菌を増殖不能にするなど病原性(毒性)を完全になくして、免疫を作るのに必要な成分だけを製剤にしたもの。接種しても、その病気になることはないが、1回の接種 では免疫が充分にはできない。ワクチンによって決められた回数の接種が必要。
不活性化ワクチンには、ホルマリンなどの薬品や熱を加えて不活性化した病原体から生産するワクチンやサブユニット・ワクチン、トキソイド・ワクチン、多糖体・タンパク結合型ワクチンなどの種類がある。
実用化している不活性化ワクチンとして、インフルエンザ、A型肝炎、百日咳、日本脳炎、ポリオ、狂犬病などで、これまでに多くのワクチンの開発で実績がある。
■ サブユニット・ワクチン(組み換えワクチン)
不活化ワクチンには様々な抗原が含まれている。これらの抗原のうちヒトが免疫獲得に必要な抗原(感染防御抗原)だけを抽出して製剤する。
感染防御抗原を精製してもサブユニット・ワクチンは作れるが,技術開発が進み、感染防御抗原の遺伝子を特定して、遺伝子組換え技術を用いて、大腸菌や酵母に遺伝子を転写して、抗原タンパク質を大量につくらせることでワクチンを製造することも可能になった。
この技術の登場で、大量生産が容易で安価なワクチンが実用化されるようになった。
サブユニット・ワクチンには、免疫原性(免疫応答を誘発させる能力)を確保するために、アジュバント(補助剤)を加えて製剤する場合が多い。
サブユニット(subunit)とは、多量体タンパク質などを形成する単一のタンパク質分子のこと。
実用化しているサブユニットワクチンとして、B型肝炎、帯状疱疹。
■ トキソイド・ワクチン
トキソイド・ワクチンは、細菌の産生する毒素(トキシン)を取り出し、免疫を作る能力は持っているが毒性は無いようにしたもの。
実用化しているトキソイド・ワクチンは、破傷風、ジフテリアなど。
■ 多糖体・タンパク結合型ワクチン
多糖体をタンパクに結合(接合)させたものから生産するワクチン。これにより多糖
体ワクチンの幼児における有効性が高まる。
実用化している多糖体・タンパク結合型ワクチンとして、肺炎球菌、髄膜炎菌、インフルエンザB型などがある。

出典 米国研究製薬工業協会
従来のワクチンの製造法
ワクチンの製造方法としては、鶏卵でウイルスを増やして作る方法(例:新型インフルエンザワクチン)やネズミにウイルスを接種し増やして作る方法、細胞にウイルスを感染させて増やして作る方法(例:水疱瘡ワクチン)、そして遺伝子組換えによって作る方法(例:B型肝炎ワクチン)の4つがある。
これまでの新型インフルエンザ・ワクチンに関しては鶏卵を使う方法が採用されていた。
しかし、この方法は大量の鶏卵を準備しなければならないことや製造に6ヶ月~12ヶ月の期間を要することから、より短時間で大量のワクチンを製造できる方法の開発が課題だった。
新たに登場した遺伝子組換え技術によって作る方法では、時間がかかる鶏卵でウイルスを増やすプロセスや不活性化のプロセスが必要なく、人工的にウイルスの遺伝情報を含むDNAやRNAの遺伝子を合成するので、短期間に大量のワクチンが製造できるという利点がある。

作成 IMSSR

新型コロナウイルスワクチン
世界の主なワクチンの開発状況

出典 ニューヨークタイムズ 6月8日
New York Times(6月8日)によると、現在、開発中の新型コロナウイルスのワクチンは、試験管試験や動物実験中のワクチン候補が77で、ヒトを対象にした臨床試験を開始したワクチン候補は93に上り、第3相の最終段階の臨床試験まで到達したのは30、認可(限定使用を含む)されたものが115となっている。
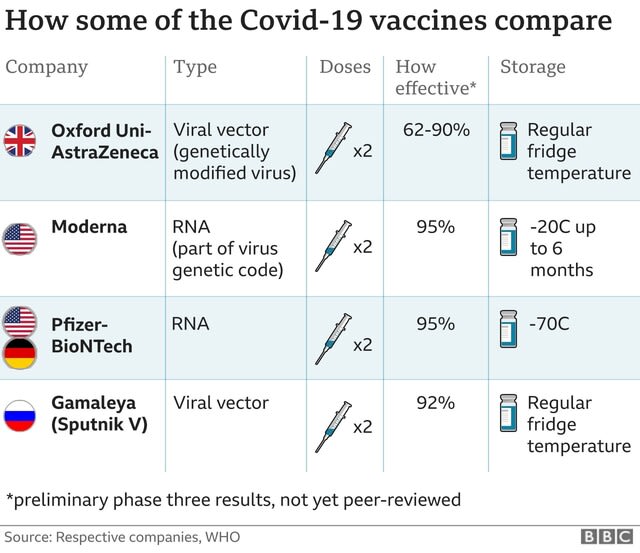
認可(緊急使用を含む)されたワクチンは、Phizer/BioNTech(米独)、Moderna(米)、Oxford/Astrazeneca(英)、Johson&Johson(米)、Cansino(中国)、Sinofarm(北京、武漢)、Sinovac(中国)、Gamaleya(ロシア)、Vector Institute(ロシア)、Bharat Biotech(インド)である。
世界初の認可となったワクチンはCansino BiologicsのAd5-nCoVで、2020年6月、中国人民軍限定の利用認可を得た。さらにSinovac、Sinofarm、武漢生物制品研究所の3ワクチン候補が緊急使用で認可された。ロシアはGamaleya Research Instituteが開発しているSputnik-Ⅴを、2020年8月に第2/3相臨床試験の結果を待たず認可し、さらにシベリアの国立ウイルス学・生物工学研究センターが開発したワクチン候補も認可した。
一方、University of Queensland&CSL(オーストラリア)、Merck & Co(米)(2種類)、Imperial Collage London(英)のワクチン候補は開発中止となった。

最近の遺伝子組み換え技術の急速な進歩で、従来のワクチン開発の手法が一変し、遺伝子ワクチンが登場した。
DANワクチンやmRNAワクチン、ウイルス・ベクター・ワクチン、組み換えたんぱく質ワクチンなどである。遺伝子ワクチンは、培養や不活性化処理などの時間がかかる従来の製造手法とは違い、人工的にワクチンを製造できるため、短期間で大量のワクチンを製造可能というメリットがある。
一方で、まだ実用化の実績がほとんどなく、有効性や安全性(副反応)、持続性などに懸念が残されている。


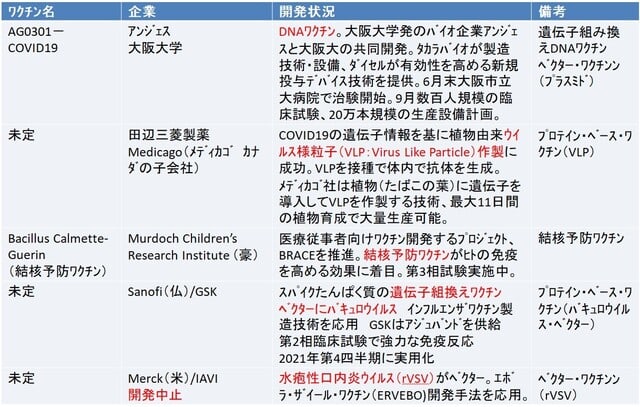

作成 IMSSR
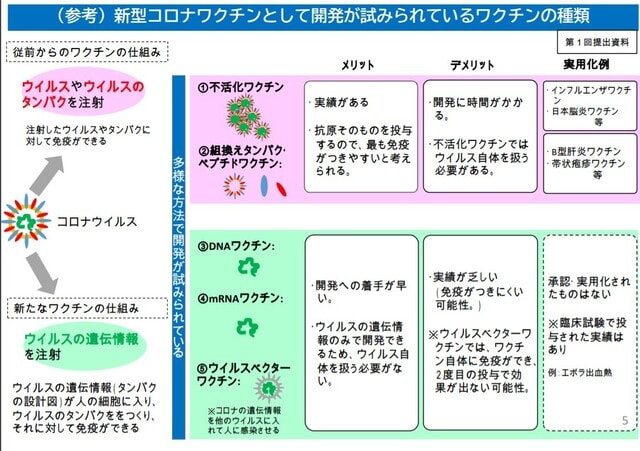
出典 厚労省新型コロナウイルス感染症対策推進本部
新型コロナウイルス ワクチン開発
■ mRNAワクチン
■ mRNAワクチン
抗原たんぱく質の塩基配列を作る情報を持ったmRNAを利用したワクチン。
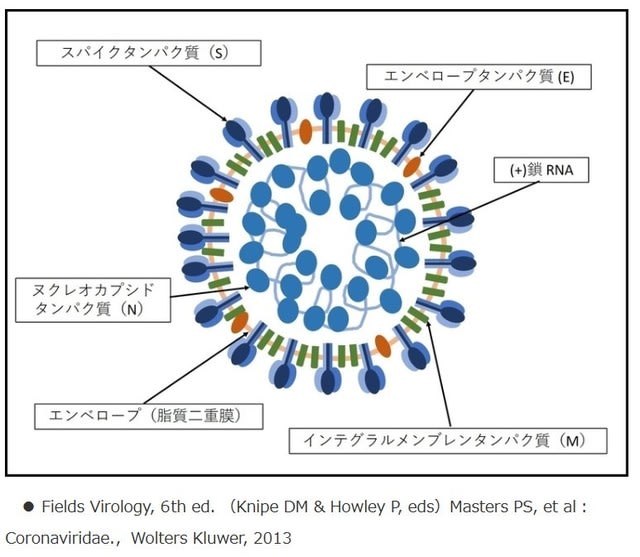
新型コロナウイルスの遺伝子情報を基に人工的に作った設計図(DNA)、「メッセンジャーRNA(mRNA)」を使用して、ヒトの細胞内でウイルスが持つ抗原タンパク質を作りヒトの免疫を誘導する。DNAワクチンに比較して、ゲノム(DNAのすべての遺伝情報)への挿入変異リスクが少ないが、ヒトの体内に入ると分解されるなど不安定で壊れやすいために、脂質ナノ粒子(LNP:Lipid nanoparticle)などに封入して投与する。血液に含まれるマクロファージや好中球などによりウイルスを排除する「自然免疫」が過剰に誘導されるのを抑える効果も期待できる。
投与後、細胞質内でmRNAが抗原たんぱく質に翻訳されて免疫が誘導されるため、液性免疫だけでなく、細胞性免疫も引き起こすと考えられている。これまで世界で承認されたmRNAワクチンはないが、ここ数年で研究開発が活発化している。
Moderna(米国) 「mRNA-1273」脂質ナノ粒子組み込み
米国のバイオベンチャー、モデルナ社は、米国立アレルギー・感染症研究所(NIAID)と協力して、新型コロナウイルスのワクチン、mRNA-1273を開発している。mRNA-1273はメッセンジャーRNA(mRNA)を使用して、体内にタンパク質を作り、新型コロナウイルスの免疫を生成するワクチンである。 メッセンジャーRNA(mRNA)の開発には最新の遺伝子工学が導入されている。
MedernaRNA-1273 最先端の遺伝子技術を駆使 mRNAワクチン
3月16日、米国立衛生研究所(NIH)は、NIHの一部門である国立アレルギー・感染症研究所(NIAID)とのモデルナ(Moderna)が協力して開発したmRNAワクチン「mRNA-1273」の第1相前期臨床試験を始めたと発表した。臨床試験は18~55歳の健康な男女45人を対象に実施、ワクチンを4週間隔で2回投与して安全性と免疫原性を評価する。

Moderna社 Norwoodの拠点(米 マサチューセッツ州ケンブリッジ) 面積18万4000平方メートル 従業員約200人 117億円をかけて建設
出典 Pharmaceutical Technology
前期相臨床試験で中和抗体生成を確認、これを受けて米生物医学先端研究開発局(BARDA)は4億8600万ドル(約520億円)の資金提供を行うことを決めた。
Moderna社は米政府が進めているワープスピード作戦の一環として、米国立衛生研究所(NIH)が主導する全米10万人規模の治験者を対象にした大規模後期臨床試験の候補にOxford/ Astra Zeneca 、Johnson & Johnson 、Phizer社と共に選ばれ、7月27日、臨床試験が開始された
7月26日、臨床試験開始の前日に米生物医学先端研究開発局(BARDA)はModerna社に対して4億7200万ドル(約500億円)の追加資金を拠出した。
Moderna社は2021年には最大で10億回分、2022年には30億回分の製造を目指す。
米モデルナ 緊急使用認可(EUA)
2020年11月30日、モデルナ社は、新たな分析で重大な安全性の問題は浮上せず、コロナに対する高い予防効果が示されたとして、緊急使用許可申請(EUA:Emergency Use Authorization)を申請した。
申請に伴って公表された一次解析では、約3万人を対象に「mRNA-1273」かプラセボ(偽薬:placebo 生理的食塩水)を接種した後期臨床試験の結果を分析した。約3万人の内196人が新型コロナウイルスに感染、196人の内、11人が「mRNA-1273」を投与したグループ、185人が偽薬を投与したグループで、有効性を94.1%とした。これは以前に公表した暫定結果(94.5%)とほぼ同水準である。重症化が確認された30人はいずれもプラセボを接種した治験者で、重症化の予防には100%の有効性が示されたとした。
モデルナ社のワクチンは、メッセンジャーRNA(mRNA)ワクチンで、遺伝子を人工的に合成して製造するため、短期間で大量のワクチンを製造できる利点がある。
同社のホーグ社長は「『ワープ・スピード作戦』を通じて数時間以内に出荷する用意があり、すぐに供給を開始できる」と自信を示した。
12月18日、米食品医薬品局(FDA:U.S. Food and Drug Administration)は、モデルナ社が開発した新型コロナウイルスワクチン、mRNA-1273の緊急使用を許可した。米国でコロナワクチンの緊急使用が認められるのは米ファイザー社に次いで2例目となる。
mRNAワクチンは壊れやすいために輸送方法が難問だが、モデルナ製のワクチンは通常の冷蔵庫の庫内の温度である2~8度で30日間の保存が可能、マイナス20度では最大6カ月の保存が可能である。一方、ファイザー社のワクチンはマイナス70度の超低温での保存が必要となる。
「ワープ・スピード作戦」のワクチン担当責任者は、通常の冷蔵保存が可能なことから、遠隔地域などへの配布が容易にできると指摘。「長期試験が完了すればさらなる安定化も期待できる」と述べた。 また米国立アレルギー感染症研究所(NIAID)のファウチ所長は「ワクチンはトンネルの先にある光だ」と歓迎した。
米政府は2020年8月、1本15ドルで1億本のワクチンを購入する契約をモデルナと締結。政府は開発資金として10億ドルをモデルナにすでに提供しており、政府が支払う1本分のワクチン価格は合計で25ドル、総額で25億ドルとなる。その後の追加の交渉で2021年7月までに3億回に増やした。
12月中に米国ではファイザー製とモデルナ製の2種類のワクチンの緊急使用が始まり、年内に最大6000万回分、2021年には10億回分を超えるワクチンが米国内で供給される見通しとなった。
週明け12月16日のニューヨーク株式市場ダウ平均株価は、新型コロナウイルスのワクチン開発への期待から3万ドルの大台に迫る水準まで値上がりし、ことし2月につけた終値としての最高値を9か月ぶりに更新した。17日の日経平均も、29年5カ月ぶりに2万6000円台を回復した。まさに「ワクチン相場」である。
日本はModerna社と5000万人分(1億回分)の供給契約を結び、5月21日に緊急使用承認、「大規模接種」や「職域接種」で接種が開始されている。

出典 Moderna HP
Pfizer(米国)/BioNTech(独) 脂質ナノ粒子組み込み 「BNT162b2」(Cominaty)
2020年3月、ドイツのバイオベンチャー、BioNTECH社(ビオンテック)はmRNAコロナワクチンを開発し、米国の製薬大手、Phizer社(ファイザー)と提携して、5月に第1相臨床試験を開始した。7月27日、第2/3相臨床試験を3万人規模(その後4万4000人規模に拡大)のボランティアを対象に大規模試験を開始した。
2020年7月、米政府は、19億5000万ドルを拠出してBioNTECH/Phizer社のワクチン、1億回分を確保する契約を結んだ。また年内にさらに19億5000万ドルを投じて追加の1億回分の供給を受けることになった。さらに最大で計4億回分の追加オプションの権利も手に入れた。
12月2日、英国が世界の先頭を切って緊急使用認可に踏み切り、12月11日は米FDAも緊急使用認可を行った。12月31日にはWHOも緊急使用認可を行い、各国も相次いで認可した。
一方、2020年12月、EUは1回目の供給契約(2億回分)を結び、接種1回当たり平均15.5ユーロ(18.6ドル)を支払うことで合意して、7億ユーロの前払い金を支払った。さらにこの契約に含まれていたオプションで1億回分の追加供給確保し、2021年1月には2回目の供給契約(3億回分)に調印し、確保したワクチンは6億回分に達した。EUの人口は約4億5000万人、全員に接種が可能な量である。
4月23日、欧州連合(EU)欧州委員会は、今後数年間で新型コロナウイルスワクチンを最大18億回分購入する方向で、最終合意するという見通しを示した。ワクチン契約としては世界最大規模となる。EUのすべての住民が約4回の接種が可能な量である。ワクチン価格は、1回当たり19.5ユーロになるとされている。
日本は、2021年2月14日、緊急使用承認がされ、政府はこれまで確保した1億4400万回(7200万人分)に5000回分(2500万人)上積みして、合計1億9400万回分(9700万人分)を確保した。
全米3万人規模の大規模試験実施
7月27日、BioNTech(ビオッテク)社とPfizer(ファイザー)社は開発中のワクチン候補、BNT162b2について、3万人の治験者を対象とした第2/.3相大規模臨床試験を、米国やアルゼンチン、ブラジル、ドイツなど世界の約120の医療機関で開始した。18〜85歳のボランティアに2回投与し、安全性や感染や発症の予防に有効かどうかを評価する。半数は比較のためプラセボを接種する。10月12日、米国内での第2/.3相大規模臨床試験を4万4000人に拡大すると発表した。
PfizerとBioNTechのワクチン、BNT162 米政府が1億回分を確保
2020年7月、米政府は米Pfizer社と独BioNTech社が開発中の新型コロナウイルスワクチンBNT162b2で、1億回分を購入すること合意した。米政府は19億5000万ドル(約2090億円)を支払う。
Pfizer社の発表文によると、購入契約を結んだのは、米厚生省と国防総省で、年内に1億本分の供給を受けて米国民に無料で投与する。さらに年内に1億回分の追加を19億5000万ドルを投じて供給を受ける契約も結んだ。また最大で4億回分の追加オプションの権利も手にした。。
この契約では、米国政府は、対象者一人当たり、ワクチンを2用量接種する場合には39ドル、1用量の接種では19.50ドルの価格で購入する。新型コロナウイルスのワクチン価格を取り決めた最初の契約となった。
米投資銀行のアナリストは、この契約について「COVIDワクチンの価格設定に重要なベンチマーク(指標)を提供するだろう」と述べた。
これに対して、WHOと国際枠組みを推進している国際組織GAVI(ワクチンと予防接種のための世界同盟)の広報担当者は、現時点で具体的な価格を予測することは不可能だとし、暗に高すぎると批判した。
トランプ政権は、100億ドル(約1兆700億円)を投じて、「史上最大の作戦」とする「ワープスピード作戦」を強力に展開し、全国民が1回接種するのに相当する3億本のワクチンを2021年初めまでに確保して、コロナ禍を克服する重要施策として位置づけている。
ファイザー社は20年末までに1億本、21年末までに13億本の製造を目指すとしている。
米FDA、Pfizerのワクチン緊急使用承認 接種開始
12月11日、米FDAは、米ファイザーと独ビオンテックが共同開発した新型コロナウイルスワクチンの緊急使用許可(EUA)を行った。これを受けて米国の保健当局、地方自治体、病院、物流業者は、ただちに接種に向けて動き出している。
12月13日、ファイザー社のミシガン州の工場からアメリカ各地の145カ所の医療機関に向けて次々に発送が始まった。16日までに約300万回分が636カ所に運ばれる予定だ。
最大都市のニューヨーク市は、14日にワクチン配布などの統括センターを開設する計画を発表。デブラシオ市長は会見で「これは物流だけの問題でなく、いかに公平を期し市民の信頼を確保するかという点で前例がない」と語った。
12月14日、 ニューヨーク州でワクチンの接種が始まった。一番手はロングアイランド・ジューイッシュ・メディカル・センターの集中治療室(ICU)で働く看護師だった。
米国ではこの日、新型コロナ感染症による死者が累計で30万人を超えた。ワクチン接種の開始で、米国のコロナ対策の転換点となる可能性に期待が集まった。
12月18日、米食品医薬品局(FDA)は、米モデルナ社のワクチンの緊急使用を許可した。これで2例目となる。
一方、世界保健機関(WHO)は12月31日、米ファイザー/独ビオンテックのワクチンの緊急使用を承認し、世界各国で承認が相次ぐ。
CureVac(独 キュアバク)
CureVac社は、新型コロナウイルスのスパイクたんぱく質を生成させるmRNAを利用することで、免疫システムを強くかつバランスよく活性化するように設計しているとしている。ベクターとして脂質ナノ粒子を使用し、ドイツのテュービンゲンにある同社の大規模製造施設で製造する。
第1相臨床試験では、ドイツとベルギーの18歳から60歳の健常者168人が参加し、その内24人はプラセボ(偽薬)を投与する。投与量は2~8マイクログラム(マイクロは100万分の1)の範囲で、安全性を評価しつつ最適な用量を決定してヒトにおける免疫応答の特性を解析する。最初の臨床試験の結果は9月か10月に発表される見通しで、来年半ばまでにワクチンの承認が得られる可能性があるとの見解を示した。
このワクチンは、トランプ政権が資金提供の見返りに独占しようとする動きがあったとして、ドイツが政府が反発して問題になった。
ドイツ政府は、CureVac社に3億ユーロ(約400億円)出資して株式23%を取得する計画を発表した。
脂質ナノ粒子(LPN lipid-polymer hybrid nanoparticle)
直径10nmから1000nmの脂質を主成分とする粒子で、DNAやRNA、薬物などを内側に内包させて運搬するベクターとして利用されている。
脂質ナノ粒子の主な原料は、トリグリセリド、ジグリセリド、モノグリセリド、脂肪酸、ステロイドなどの生体適合性がある脂質と界面活性剤である。
ベクターとして使用するためには、(1)非毒性であること、(2) 適切な場所および時間で内包した物質を放出可能なこと、(3) サイズ制御が可能であることがあげられる。
■ DNAワクチン
抗原たんぱく質の塩基配列を作る情報を持ったプラスミド(環状)DNAのワクチン。
大腸菌などのプラスミド(染色体とは独立して複製される小型の環状DNA)の中に、ウイルスの一部を作る設計図(DNA)を組み込んで、ヒトに投与することで、ウイルスの抗原タンパク質を生成させ、免疫を誘発する。核内でmRNAに転写され細胞質内で抗原たんぱく質を作ることで、免疫を引き起こすと考えられている。
mRNAワクチンに比べ、抗原たんぱく質の発現には、転写と翻訳の2段階が必要となる。
DNAが細胞のゲノムに組み込まれてしまう危険性や、抗DNA抗体が産出される危険性は残されている。
これまで各国で数多くのDNAワクチンの臨床試験が行われたが、承認されたものはなく、その背景に免疫原性(免疫応答を誘発させる能力)の低さが指摘されてきた。これを克服するために免疫効果を強化するアジュバンド(増強剤)を添加して免疫効力上げる手法が取り入れられている。
Inovio Pharmaceuticals(米)「INO-4800」
Inovio社はMERS(中東呼吸器症候群)のワクチン開発を第2相臨床試験まで進めていたことから、その技術をCOVID-19に応用。
Beijing Advaccine Biotechnologyと提携し、4月に臨床試験開始。秋には第三相臨床試験を開始して、ワクチン提供を目指す。
アンジェス/大阪大学 「AG0301-COVID19」
2020年6月30日、大阪大学発バイオベンチャーのアンジェスと大阪大学は開発中の新型コロナウイルスのDNAワクチン、「AG0301-COVID19」の第1相臨床試験を、大阪市立大学の医療従事者、30人程度を対象に、安全性と有効性を確かめる第1相臨床試験を開始した。。
アンジェス株式会社は、遺伝子医薬の開発を行う日本のバイオ製薬企業。大阪大学医学部森下竜一教授の研究成果を基に、1999年12月発足。2002年9月に大学発創薬型バイオベンチャーとして初めて東証マザーズに上場した。
このDNAワクチンは、大腸菌のDNA分子であるプラスミドをベクターとして利用するプラスミドDNA・ワクチンである。
アンジェスと大阪大学(臨床遺伝子治療学・健康発達医学)はプラスミドDNAを利用した慢性動脈閉塞症の開発実績があり、この技術を新型コロナウイルスのワクチン開発に応用する。
ワクチンの製造は、プラスミドDNAの製造技術と設備を持つタカラバイオが受け持ち、ワクチンの中間素材はAGC Biologics(米)に委託、ヒトへの新規投与デバイス提供はダイセルが実施する。
■ ウイルス・ベクター・ワクチン(組み換えたんぱく質ワクチン)
無害なウイルスをベクター(運び屋)として利用して、抗原タンパク質の遺伝子情報を忍び込ませてヒトの体内に入れる。ウイルス自体が細胞に侵入し、細胞質で抗原たんぱく質をつくり出すことで、抗体によりウイルスを排除する「液性免疫」と、免疫細胞の1つであるキラーT細胞などにより排除する「細胞性免疫」を引き起こすと考えられている。これまで、世界で承認されたウイルス・ベクター・ワクチンは、欧州で承認された米ジョンソン・エンド・ジョンソン(J&J)のエボラウイルスワクチンと、中国で承認された中国の康希諾生物(カンシノ・バイオロジクス)のエボラウイルスワクチンの二つのワクチンがある。
新型コロナウイルス感染症には、コロナウイルスの「スパイクたんぱく質」の遺伝子を組み込んだウイルス・ベクター・・ワクチンが主に開発されている。英オックスフォード大学と英大手製薬アストラゼネカはチンパンジー由来のアデノウイルス、中国のCansino BIO(康希諾生物)はアデノウイルス(5型)を、米国のJohnson & Johnsonはアデノウイルス(26型)、ロシアのスプートニクV(SputnikⅤ)は、アデノウイルスの5型と26型の混合型をベクターとして使用するワクチンを開発している。
ウイルス・ベクター・ワクチンは、1回接種すると、ヒトの体内にウイルス・ベクターに対する抗体ができるため、2回目の接種では効果が出ない可能性がある。オックスフォード大とアストラゼネカは最終相臨床試験で、同じベクターを利用したワクチン候補を2回投与して治験を実施している。
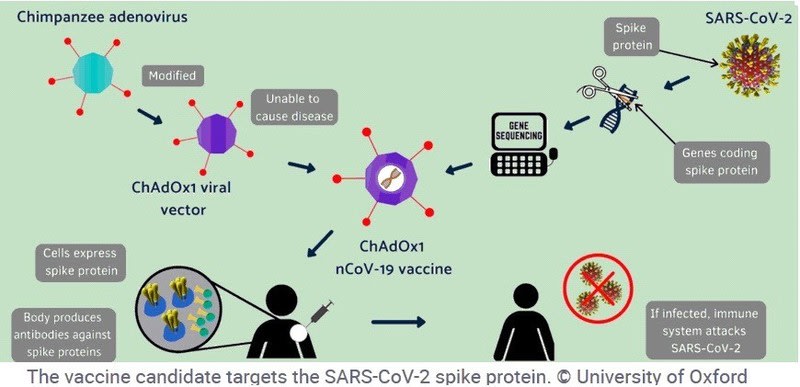
Oxford University(英国)/Astra Zeneca(英国)「ChAdOx1 nCov-19」
ラッサ熱や中東呼吸器症候群(MERS)、インフルエンザのワクチンにも使われるアデノウイルウイルス・ベクター(ChAdOx1)を利用。アデノウイルウイルスはチンパンジーの風邪のウイルス。
CanSino BiologicsやJohnson & Johnsonは、ヒトのアデノウイルウイルスをベクターとして利用するが、ヒトのアデノウイルウイルス・ベクターを使用してワクチン開発を進めているが、ヒトのアデノウイルウイルスの抗体を持っている人に対してはワクチン接種の効果が下がる可能性が指摘されている。こうした欠点を除くために、「ChAdOx1 nCov-19」ではチンパンジー由来のアデノウイルウイルスを無害化してベクターととして使用している。
製造・販売はAstra Zenec社(英国・スエーデン)。MERSワクチンやインフルエンザ・ワクチンの開発で実績。
イギリスでは、1万人の治験者を対象にフェーズII / III試験、ブラジルでは2000人の治験者を対象にフェーズIII試験を開始している。
英政府は6550万ポンド(約86億5000万円)の開発資金を提供し、1億本のワクチンを確保した。その内、9月までに、3000万本のワクチンの供給を受け、緊急使用として医療従事者への接種を開始する計画である。また英政府は、Imperial College London(その後開発中止)が取り組んでいるワクチン開発にも支援して、両大学に対して合計1億3100万ポンド(約173億円)を拠出することを決めている。
一方、米政府機関のBARDAは、Oxford University/Astra Zenecaに対して、最大12億ドル(約1284億円)の開発資金を提供、見返りに3億本のワクチンの供給を受ける。 トランプ政権の推し進めるワープスピード作戦の対象候補ワクチンとしている。
欧州各国に対しては、6月13日、ドイツ、フランス、イタリア、オランダが設立した「欧州包括ワクチン同盟(IVA)」と、「ChAdOx1 nCov-19」を最大4億回分を供給することに合意した。
この合意で、IVAの4国はワクチンの供給を確保し、さらにワクチン同盟に参加を希望する他のEU諸国も負担金を支払えば加入を認め、ワクチン供給が受けられるようにするとしている。EU各国は、「欧州包括ワクチン同盟(IVA)」を通じて、「ChAdOx1 nCov-19」へのアクセスが可能になった。
AstraZenecaの最高経営責任者、パスカルソリオ氏は、「この合意により、開発が成功すれば、数億人のヨーロッパ人がこのワクチンを利用できるようになる。欧州向けの生産を加速してサプライチェーンを整備し、このワクチンが幅広く迅速に入手できるようにしたい。ドイツ、フランス、イタリア、オランダ政府の関与と迅速な対応に感謝する」と述べた。さらにOxford University/Astra Zenecaは、感染症流行対策イノベーション連合(CEPI)やGaviワクチンアライアンスと提携し、3億本を年末までに供給を開始するとしている。Gaviは世界の低・中所得国に供給する。
ワクチン製造はアストラゼネカ社が担当、同社では今年末までには10億本の製造設備を整える計画である。
さらにアストラゼネカ社はインドのワクチン大手Serum Institute of India (SII) とライセンス契約を締結、インドで10億本を製造し、うち4億回分は年内に製造するとしている。10億本のうち一定量(発表なし)はインド向けで、残りはGAVI によって他の発展途上国に配られる。アストラゼネカ社では、パンデミックが進行中の間は、「利益はゼロ」で供給を実施するとしている。自社での生産量と合わせるとワクチンの生産能力は年間20億本に上る。
日本は、1億2000万回(6000万人分)を契約し、5月21日にModerna社と共に緊急使用承認を行った。
ワクチンの決め手は、「チンパンジー・アデノウイルス・オックスフォード1(ChAdOx1、チャドックス1)」
オックスフォード大学には、1796年に世界で初めてワクチンを開発したエドワード・ジェンナーにちなんだジェンナー研究所があり、世界有数の専門家が集まっている。新型コロナウイルスの世界的な感染拡大で、可能な限り短時間で、ワクチン開発を行うためにはどうするかが焦点だった。
ジェンナー研究所の計画の中心には、「プラグ・アンド・プレイ(起動後すぐに作動すること、元はコンピュータ用語)」と呼ばれる、画期的なワクチン開発の仕組みを整えていた。素早く柔軟で、未知の病気に対応するには格好の手法である。
幼少期に受ける予防接種で使われる従来のワクチンは、弱体化や不活化したウイルスの一部をヒトの体内に投与する。しかし、こうしたワクチンの開発に時間がかかる。
オックスフォード大の研究者はこれに代わるものとして、「チンパンジー・アデノウイルス・オックスフォード1(ChAdOx1、チャドックス1)」を作り出した。
チンパンジーが感染する普通の風邪のウイルスを操作し、あらゆる感染症に対応できるワクチンの建材となるようにした。
COVID-19以前には、インフルエンザやジカ熱、前立腺がん、チクングニア熱などの治療に、「チャドックス1」をもとにしたワクチンが開発され、計330人が投与されたという実績がる。
チンパンジーから採取した風邪ウイルスは遺伝子操作が行われているため、人間が感染することはない。この「チャドックス1」に、治療したい病気の遺伝子コードを組み込むことでワクチンを作り上げある。対象の病原体が体内に入れば、免疫系が反応してヒトに感染させようとるウイルスを攻撃する仕組みである。免疫反応を引き起こす物質は「抗原」と呼ばれる
「チャドックス1」は言わば、ミクロの世界の、優秀な郵便配達人のようなものだ。科学者は治療したい病気によって、「チャドックス1」に託す荷物、つまり抗原を変えるだけ済む。
ジェンナー研究所のギルバート教授は、「(抗原を)入れたら、あとはおまかせ」と述べている。
(出典 BBC NEWS 「英オックスフォード大 どうやってこんなに速くできたのか」 2020年11月28日)

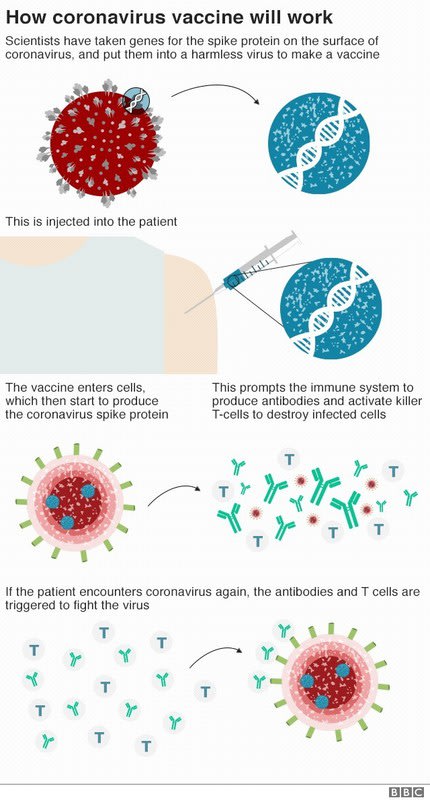
ChAdOx1 nCov-19 オックスフォード大学の開発した新型コロナウイルスワクチン 出典 BBCNEWS 4月21日
ChAdOx1 nCov-19(ワクチン)の働く仕組み 出典 BBCNEWS
・新型コロナウイルスの表面にある「突起」(Spike)のたんぱく質から遺伝子を採取する.
・この遺伝子をチンパンジーから採取した一般的な風邪のウイルス(アデノウイルス)の遺伝子に組み込む。アデノウイルスはヒトの体内では増殖しないように無害化。これがワクチンとなる。
・このワクチンをヒトに注入すると、抗体やT細胞などの免疫抗体が生成される。
・新型コロナウイルスに遭遇すると、抗体やキラーT細胞が招集されウイルスに取り付いて撃退する。
Johnson & Johnson(米国) Ad26.COV2.S(Ad26)
アデノウイルウイルス・ベクター(Ad26)を利用。英オックスフォード大と英アストラゼネカ社が開発しているワクチン候補、ChAdOx1 nCov-19がチンパンジー由来の アデノウイルウイルスをベクターとして利用しているが、米Johnson & Johnsonは、ヒトのアデノウイルウイルスをベクターとして利用する。 H.I.V.ワクチンとエボラ出血熱ワクチンを開発した技術を応用。このワクチン候補は、他のほとんどのワクチンが二回の接種が必要だが、1回の接種で済むのが大きな特徴である。これによりワクチンの輸送や接種の負担を半減させることが可能になる。
またアデノウイルス・ベクター・ワクチンは、冷蔵保存する必要があるが、凍結保存する必要はない。これに対して、開発が先行しているModernaとPfizerのmRNAワクチンは凍結保存が必要となる。アフリカなど高度な医療施設がない場所にmRNAワクチンを配布するには障壁となる。
ワクチン候補は同社の子会社ヤンセンファーマが開発した。
米ワープスピード作戦(Operation Warp Speed :OWS)の対象候補ワクチン。米政府機関のBARDAは、4億5600億円(約490億円)の開発資金を提供、その他の機関からの資金提供を加えると、同社のワクチンが承認された場合は、連邦政府は約10億ドル(約1100億円)を拠出し、Johnson & Johnsonは、1億本のワクチンを提供する。同社は2021年には、10億本のワクチンを製造する設備を整えるとしている。
ワープスピード作戦は、これまでに民間企業のコロナウイルスワクチンに100億ドル以上の巨額の資金を投資している。
9月23日、Johnson & Johnsonは米国内で、第3相臨床試験を開始した。この臨床試験は、米国のほか、アルゼンチン、ブラジル、チリ、コロンビア、メキシコ、ペルー、南アフリカの約215カ所で、最大で大人6万人を対象に実施する。大人で安全が確認されれば、子どもを対象とした試験も実施する意向としている。
CanSino Biologics (Cansino BIO 康希諾生物)(中国) 「Ad5-nCoV」
ヒトのアデノウイルウイルス(Ad5)をベクターとして利用したワクチン。エボラ出血熱のワクチン開発技術を応用。
中国・軍事医学科学院の生物学研究所と共同開発。
CanSino Biologics アフリカで問題になっていたエボラ出血熱に対して、欧米企業に並んで、独自技術を活用したワクチンを開発し、中国政府から緊急時と国家備蓄向けの承認を獲得した実績がある。このワクチンは国連の管理下で、アフリカに派遣された中国の平和維持軍や中国の医療専門家などに投与されている他、アフリカでの臨床試験が計画されていた。
武漢で108人に第1相臨床試験を開始し、第2相臨床試験を実施中。年内に実用化を目指す。

Ad5-nCoV 出典 CanSino Biologics (康希諾生物)
Gamaleya Research Institute(ロシア) 「スプートニクV(SputnikⅤ)」
2020年8月11日、プーチン大統領は、「世界ではじめてけさ、ロシアで新型コロナウイルス・ワクチンとして登録された」と述べ、モスクワの国立ガマレヤ疫学・微生物学研究所(Gamaleya Research Institute)が開発を進めてきたワクチン候補を正式に承認したことを明らかにした。
ガマレヤ(ガマレーヤ)疫学・微生物学研究所(Gamaleya Research Institute of Epidemiology and Microbiology )はガマレーヤ疫学および微生物学研究所は、モスクワに本社を置くロシアの研究ワクチン研究所。現在はロシア連邦保健省の管轄下にある。
プーチン大統領の娘も臨床試験に参加し、「接種後は体温が38度に上がったが、翌日には37度を少し上回るぐらいになっただけだ。その後は順調だ」と述べ、大きな問題は生じなかったと強調した。安全性と効果は確認されているとして、早ければ8月末にも医療関係者や教員らへの集団接種を始めるとした。
同研究所が開発したワクチンは、遺伝子組み換えDNAワクチンで、アデノウイルスをベクターとして使用して体内に新型コロナウイルスの構成要素を送り込む。オックスフォード大学とアストラゼネカが共同開発を進めているワクチンとほぼ同様のアプローチでだが、ベクターをAD5とAd26を使用する二種混合にするのが特徴である。
開発を支援する政府系ファンド「ロシア直接投資基金」(Russian Direct Investment Fund [RDIF])のドミトリエフ総裁は、今回承認されたワクチンは、エボラウイルスのワクチン研究を応用したもので、1957年に旧ソビエトによって世界で最初に打ち上げられた人工衛星の名前にちなんで「スプートニクV」(SputnikⅤ)と名付けたと述べた。
「スプートニクが発信する信号を観測して米国人は驚愕した。このワクチンも同じだ。ロシアが一番乗りするだろう」、ロシア直接投資基金(RDIF:Russian Direct Investment Fund)のキリル・ドミトリエフ総裁は語った。
同基金は、「20カ国から10億回分以上の注文を受けている」として、年産5億回分を超える量産体制を整える考えを示した。
しかし、承認に必要とされる第3相臨床臨床試験は後回しにしており、米CNNは「治験の科学的データが公開されておらず、安全性や効果が検証できない」と批判した。
ロシア保健省(Ministry of Health of the Russian Federation)によると、完了したのは第1/2相試験は約80人を対象にした治験で、同省は今後、接種と並行して1600人以上を対象にした第3段階の治験を行うとしている。同研究所のデニス・ログノフ副所長も、「子供や高齢者への接種は、完全な安全性の確認後だ」と開発途上にあることを認めたという。
ロシアでは現在も1日5千人以上の新規感染者が確認され、累計死者は約1万5千人に上る。プーチン政権は、世界に先駆けたワクチン開発をアピールすることで、政権への批判をそらす狙いもあるとみられる。また、米国や欧州、中国との「コロナワクチン覇権争い」で、遅れをとりたくないと思惑も込められている。
これを受けて、フィリピンのドゥテルテ大統領は、ロシアから新型コロナウイルスのワクチンの供与を受ける意向を示した。フィリピンは中国からもワクチンの提供を受ける方針。
ロシア製のワクチンが認可されたことを受けて、米国立アレルギー感染症研究所(NIAID)のアンソニー・ファウチ所長は、「ワクチンを作り上げることと、それが安全かつ有効であることを証明することは別」と述べ、ロシア製ワクチンに「重大な懸念」を示した。
ワクチンの一刻も早い実用化を目指す競争が過熱する中で、果たして接種しても安全なのかを巡る不安が世界中で高まっている。各国政府や製薬会社は、ワクチン開発が人々の不信感で台無しにならないよう重大な責任を負っているだろう。

Sputnik-Ⅴ 出典 MINZDRAV
■ プロテイン・ベース・ワクチン(組み換えタンパク・ワクチン)
遺伝子組み換え技術を用いて抗原タンパク質を大腸菌や酵母、昆虫や植物、哺乳類の細胞などで増殖して、単離・精製して製造し、ヒトに投与する。投与後、抗原たんぱく質が細胞外から取り込まれ、ペプチド(たんぱく質の断片)に分解されて、主に液性免疫を誘導すると考えられている。多様な抗原タンパク質に対応可能だが、一般的に免疫効果が弱いという弱点があり、免疫効果を強化するアジュバンド(増強剤)を添加して免疫効力を上げなければならない。
米国では2013年、昆虫細胞を使ったたんぱく質発現システムを用いた仏サノフィの季節性インフルエンザワクチン「フルブロック」が承認され販売されており、相当数の投与実績がある。
新型コロナウイルス感染症に対しては、主にスパイクたんぱく質を抗原とする組み換えたんぱく質ワクチンを各社が開発中である。
田辺三菱製薬/Medicago 植物由来ウイルス様粒子(VLP:Virus Like Particle)利用ワクチン
VLPは、ウイルスのタンパク質を利用して、外見上ウイルスに似せて作られた粒子で、ワクチンのベクターにする。ウイルスのDNAなRNAは含まれず、無毒化されている。
3月12日、田辺三菱製薬は、カナダの子会社メディカゴが新型コロナウイルスの遺伝子情報を基に植物由来ウイルス様粒子(VLP)の作製に成功したと発表した。ウイルスと似た構造のVLPを接種すれば体内で抗体が作られ感染を防御できる。
現在、COVID-19向けワクチンの非臨床試験を行っており、2020年8月までにカナダ国内で臨床試験を開始し、21年に試験を終えて認可申請を目指す。各国の規制当局とも相談し、カナダ以外でも実用化の機会を探るとしている。
ワクチン開発を手掛けるメディカゴ社は田辺三菱が2013年に買収したカナダのベンチャー、メディカゴ(ケベック市)社である。メディカゴ社は植物(たばこの葉)に遺伝子を導入してVLPを作製する技術を持ち、開発中のインフルエンザワクチンは商業化目前にある。今回、新型コロナの遺伝子情報を取得してからわずか20日間でVLPの作製に成功した。
VLPは副反応のリスクが低く、感染防御に優れる。VLPはウイルスと同じ構造をしているが、ウイルスのように増殖するための遺伝子情報を持たず増殖しない。ヒトに投与するとVLPをウイルスと認識して抗体が作られ、感染を防げる。VLPは1カ月程度で量産できる利点もある。
メディカゴ社はワクチン以外にも新型コロナウイルスに対する抗体をケベック市内にあるラヴァル大学感染症研究センターと協力して研究中で、治療薬の実用化も目指すという。
Novavax 「NVX-CoV2373」(脂質ナノ粒子組み込み)
COVID-19のスパイクたんぱく質の侵入阻止抗体の生成を促すmRNAを脂質ナノ粒子組み込むプロテイン・ベース・ワクチンを開発している。この技術を利用して開発したインフルエンザワクチンは、2020年3月に第3相試験を終了している。
高レベルの中和抗体産生を促すために、Novavax社が特許を有する免疫増強アジュバント(Adjuvant)であるサポニン・ベースの「Matrix-M」を含有させる。
5月に開始した約130人の患者を対象とした第1/2相臨床試験の第1相試験データは、8月に結果を公表したが、NVX-CoV2373は概して良好な忍容性を示し、ヒト回復期血清にみられる反応よりも優れた抗体反応を示したとした。8月に南アフリカで第2相臨床試験を開始した。 2,900人を対象とした盲検プラセボ対照試験では、ワクチンの安全性や有効性も検証する。
そして9月、Novavaxは英国で最大10,000人のボランティアを登録する第3相臨床試験を開始した。参加者の半数にコロナワクチン「NVX-CoV2373」をその効果を高めるアジュバント「マトリックスーM」と共に2回接種するプラセボ対照試験となる。18-84歳が対象だが、少なくとも被験者の25%は高齢者となり、新型コロナで最大の影響が見られている人種・民族のマイノリティーの登録が優先される。登録完了までに4-6週間かかる見通し。10月には米国でさらに大規模な3万人規模の第3相臨床試験の開始を予定している。
臨床試験の結果は、2021年の初めまでに得られる見通しとしている。
Novavaxは、AGCの事業子会社であるAGC Biologics(本社:米国)に、AGC Biologicsに「Matrix-M™」の製造を委託した。Novavaxは、「Matrix-M™」の大量生産を可能にする製造プロセスを開発段階から支援する。
また英Glaxo Smith Klineと提携、薬効を高めるアジュバンド(Adjuvant:補強剤)の提供を受ける。
「アジュバント」(Adjuvant:増強剤)
アジュバントは、免疫応答を高めるためにワクチンの効果を高める添加する増強剤で、感染症に対し、ワクチン単体よりも、強力かつ長期的に持続する免疫を作り出すことが可能になる。たんぱく質ベースのワクチンは、mRNAワクチンなどに比べて免疫応答が弱く、アジュバントの補強が必要となる。
アジュバントを使用することにより、ワクチンの効果が高まり、1回の接種に必要なワクチン用タンパク質の容量が抑えられて、より多くの人への接種可能になる。
タンパク質ベースの抗原をアジュバントと組み合わせる方法は、現在提供されている多くのワクチンで使用されている確立された方法である。
「ワープスピード作戦」のワクチンに 16億ドル(約1712億円)の資金提供
Novavaxは、トランプ政権がCOVID-19の安全で効果的なワクチンの早期開発を目指して立ち上げた「ワープスピード作戦」(Operation Warp Speed:OWS)へ参加するワクチン候補に選ばれ、7月7日、米BARDAはNovavaxに対して16億ドル(約1712億円)の資金を提供すると発表した。
同社が開発しているCOVID-19ワクチン、NVX-CoV2373の臨床試験(治験)や実用化、製造を支援するもので、2021年の第一四半期までに1億回分(1人当たり2回の接種が必要 計5000万人分)のワクチン供給を目指す。
今回の支援は、3月のJohnson & John(4億5600万ドル)、4月の米Moderna(4億8600万ドル)、5月の英AstraZeneca/Oxford University(最大12億ドル)などに続くもので、コロナワクチン開発に向けた「ワープ・スピード作戦」の下で最大規模となる。
BARDAとは別に、6月には米国防総省から6000万ドルの開発資金提供を受け、アメリカ軍の予防接種ワクチンとして1000万回を提供する契約を行っている。
大規模な製造設備の整備を行いたいとしている。
アザー米厚生長官は声明で、ワープ・スピード作戦にNovavaxのワクチン候補が加わったことにより「早ければ年末にも安全で効果的なワクチンを確保できる可能性が高まった」と述べた。
また9月には、Novavaxは大手ワクチンメーカーのインドの血清研究所(Serum Institute of India)と年間20億本のワクチンを製造することで合意に達した
新型コロナのワクチン開発で米社と提携 年2.5億回分生産―武田薬品
8月7日、武田薬品工業は、新型コロナウイルスのワクチン開発や製造で、米バイオ企業ノババックスと提携したと発表した。武田薬品工業は米ノババックス社が海外治験を実施しているワクチン、NVX-CoV2373の日本国内での開発や製造、流通を担う。
これを受けて、厚生労働省は7日、新型コロナウイルスワクチンの生産体制整備事業の助成先として武田薬品工業を採択し、300億円を助成しすることを決めた。武田薬品工業は光工場(山口県)で2億5000万接種分以上の生産体制を整える。
武田薬品が新型コロナのワクチンで提携するのは初めて。金額は非公表。来年後半には最初の製品を製造できる見通しとしている。
Sanofi(仏)/GlaxoSmithKline(独)
2020年9月、仏製薬大手のSanofiと英GlaxoSmithKlineフランスの製薬大手サノフィは開発したワクチン候補の第1/2相臨床試験を開始、2021年5月に第2相臨床試験(治験)で強力な免疫反応が示されたと発表した。。
このワクチン候補には、すでにSanofiが開発に成功したインフルエンザワクチンと同じタンパク質ベースの遺伝子組換え技術を応用して、COVID-19のスパイク・タンパク質と正確に一致するDNA遺伝子配列を遺伝子組換え技術でタンパク質に組み込む。このタンパク質をバキュロウイルス・ベクターに入れてワクチンを製造する。バキュロウイルス(Baculovirus)は、昆虫を主な宿主とする核多角体病ウイルス(Nucleopolyhedrovirus:NPV)。
ワクチンには、GSKが製造する「アジュバント」(Adjuvant:増強剤)組み合わせる。
今後、3万5000人以上の成人が参加する世界規模の第3相治験を開始する予定で2021年第4・四半期までの承認を目指し、最大10億回分のワクチン製造を計画している
両社に対して、米国生物医学先端研究開発局(BARDA)は21億ドルの資金提供を行い、1億本のワクチンの提供を受ける。またEUに3億本を提供することで協議を進めている。
■ 不活性化ワクチン
ウイルス自体を不活性化(感染性や病原性を喪失させる)して製造したワクチン。ワクチン開発の伝統的な手法で、これまでに数多くの実績がある。しかし、ウイルスの培養や不活性化のプロセスで時間を要し、短時間に大量生産することが困難という弱点がある。
Sinopharm(国営中国医薬集団 シノファーム)
中国 Sinopharm(北京・武漢)とSinovacの不活性化ワクチン 医療従事者に接種開始
2020年7月22日、中国政府は医療従事者らを対象に限定して、国営製薬企業、Sinopharm(国営中国医薬集団 シノファーム)の子会社である北京生物製品研究所(Beijing Institute of Biological Prodeucts)と武漢生物製品研究所(Wuhan Institute of Biological Prodeucts)の2社と、科興控股生物技術(Sinovac Biotech)が開発した新型コロナウイルスワクチンの緊急使用を正式に開始した。国家衛生健康委員会科技発展センターの鄭忠偉主任がCCTVの番組で明らかにした。臨床試験段階にあるワクチンの有効性や安全性を感染リスクの高い現場でも確認し、年内には一般市民へ接種を可能にする方針としている。
緊急使用は「ワクチン管理法」の規定に基づき同委が申請し、薬品監督当局が専門家の検証を経て認可。目的は「医療従事者や出入国検査員らにまず免疫を持たせ、都市運営の安定を確保するため」と説明している。
Sinopharmは、傘下の中国生物技術(CNBG)の北京市と武漢市の研究所でそれぞれ別個にワクチンを開発中である。このうち武漢生物製品研究所は、6月16日、中国国内で行った治験対象者1120人の第1/2相試験(プラセボ盲検試験)の結果を明らかにし、2回の接種で、被験者全員の中和抗体の陽性化率が100%で、深刻な副作用はなかったとした。
北京研究所は4月にワクチンの製造設備を建設して年間生産能力1億2千万個の生産が可能になった。また武漢の研究所も年産能力1億個をめざして工場建設を進めて2021年には発売したいとしている。
6月23日、Sinopharmは第3相臨床試験をアラブ首長国連邦(UAE)で実施すると発表した。北京と武漢のワクチン候補をそれぞれ5000人を対象に治験を行う。UAE側は現地で生産することも視野に入れ、9月14日には医療従事者に対する緊急使用を認可した。さらに月からはペルーとモロッコで第3相臨床試験を開始した。
中国は新規感染者が減っていいて治験対象者を確保するのが難しくなり、感染者が増えている国外で治験を進めている。世界的にワクチン開発競争が激化している中で、中国はいち早い実用化をめざし、ワクチンの覇権争いに優位に立つ戦略だ。
Sinopharm 2020年末にもワクチン発売…2回分を1万5000円以下で
中国紙・光明日報(電子版)などによると、国有製薬大手「中国医薬集団」(Sinopharm)は8月18日、開発中の新型コロナウイルスのワクチンについて、2回分を1000元(約1万5000円)以下で販売する方針を明らかにした。年末にも発売の見込みだという。
Sinopharmは、年間2億回分超を生産できる製造体制を確立している。(読売新聞 8月20日)
一般市民のコロナワクチン接種、11月にも準備完了予定 中国
AFPによると、中国で開発されている新型コロナウイルスワクチンの一般市民への投与は、早ければ2020年11月にも準備が整うことが、関係者の話で分かった。各社がワクチン臨床試験の最終段階に入っており、開発競争は世界で過熱している。
ワクチン開発を進めるSinovac Biotech (科興控股生物技術)とSinopharm(国営中国医薬集団)は、第3相臨床試験の終了後、年末にも自社ワクチンが承認される予定だとしている。
9月14日夜、中国疾病対策予防センター(CCDC)のバイオセーフティー首席専門家は国営中国中央テレビ(CCTV)の取材に対し、「11月か12月ごろ」には一般市民のワクチン接種が可能になる予定だと述べ、「第3相臨床試験の結果を踏まえると、現在の進展状況は非常に順調」だとして、自身も4月にワクチンを接種したがこれまでのところ体調は良好だと話した。
Sinovac Biotech (科興控股生物技術)(中国) 「CoronaVac 克爾来福」
Sinovacは、北京に本拠を置くナスダック上場企業。
2020年4月から5月にかけて、江蘇省と河北省で第1/2相臨床試験を実施、90%の治験者に中和抗体を生成と安全性を確認した。
6月12日、Sinovac Biotech は、ブラジルの製薬メーカー、ブタンタン研究所と提携し、ワクチン候補の第3相臨床試験をブラジルで実施することで、ブラジル・サンパウロ州と合意した。
Sinovac Biotech社は、7月から9000人の治験者を対象に臨床試験を開始した。続いて8月にはインドネシアで第3相臨床試験を開始した。
ブタンタン研究所はSinovacが開発したワクチンのライセンスを受けて2021年6月までワクチン生産を開始し、ブラジル国内に提供する計画である。
ブタンタン研究所は、世界的に有名な毒蛇研究施設。
また、9月22日、トルコでも第3相臨床試験を開始、第一段階では医療従事者、1300人を対象、第二段階では一般の治験者12000人を対象に、2週間の間隔を空けて2回接種する。
第3相試験には数千人の患者の参加が必要だが、感染者が減少している中国国内では大規模な治験実施は不可能なため、中国のワクチン開発企業は外国との協力を模索していた。
新型コロナウイルス 治療薬・ワクチン 開発最前線 ~レムデシベル アビガン モデルナ オックスフォード大学/アストラ・ゼネカ Johnson & Johnson臨床試験 勝者は誰が?~
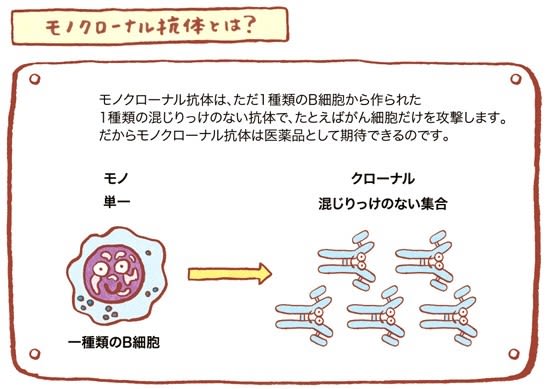
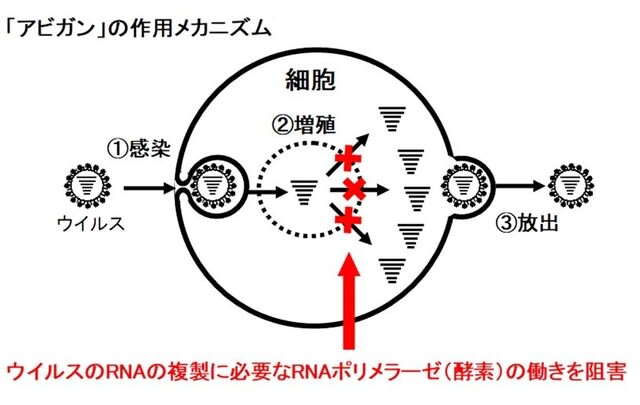
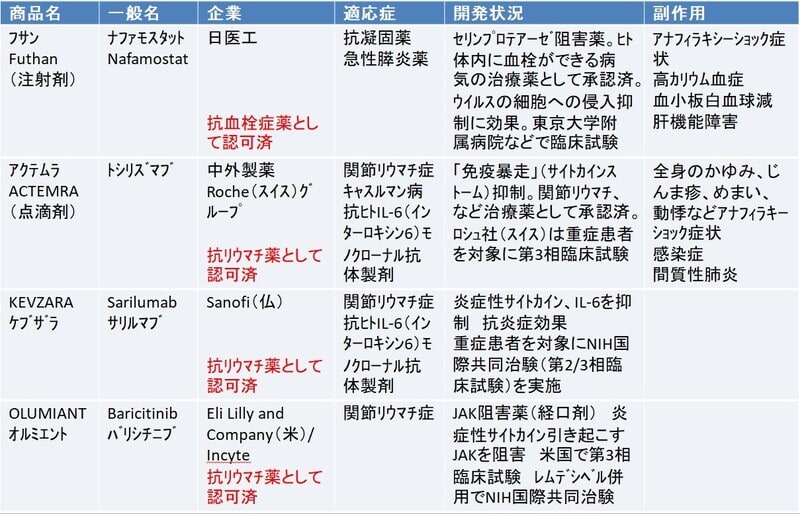
新型コロナウイルス 治療薬の種類 アビガン レムデシベル デキサメタゾン イベルメクチン モノクローナル抗体
2021年6月1日 改訂
Copyright (C) 2020 IMSSR
******************************************************
廣谷 徹
Toru Hiroya
国際メディアサービスシステム研究所
代表
International Media Service System Research Institute(IMSSR)
President
thiroya@r03.itscom.net
imssr@a09.itscom.net
******************************************************