深層情報 Media Close-up Report 「呪われた」2020東京五輪 速報 「緊急事態宣言」下でも五輪開催 コーツIOC副会長
国際メディアサービスシステム研究所 International Media Service System Research Institute(IMSSR)

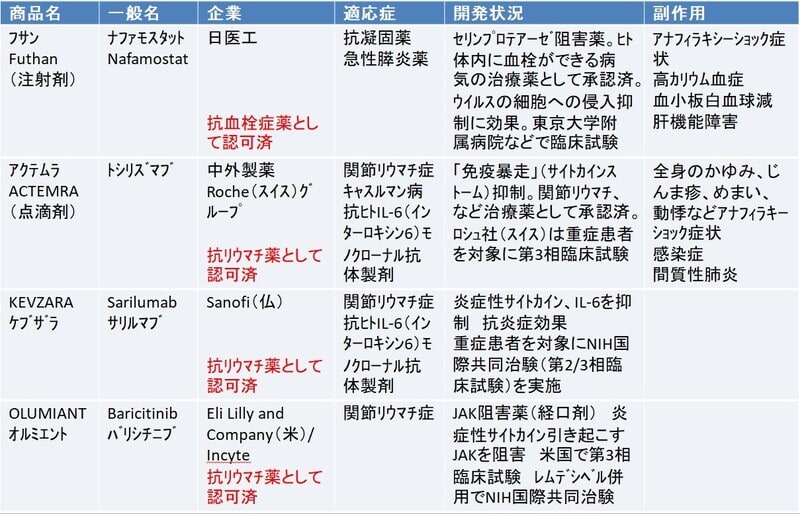
米イーライリリーの抗体治療薬、米FDAが緊急使用許可
2020年11月9日、米食品医薬品局(FDA)は、米イーライリリー社(Eli Lilly)のモノクローナル抗体治療薬(Monoclonal antibodies )、「バムラニビマブ(Bamlanivimab)」について、軽度から中等度の新型コロナウイルス感染症の成人および小児患者向けに緊急使用許可(EUA)を付与したと発表した。
今回の決定で、医師は高リスクの患者について重症化する前に対処する選択肢が得られる。血漿療法やギリアド・サイエンシズ社のレムデシビルなど使用が認可された治療薬は重症患者向けである。抗体治療薬は、コロナウイルスのスパイクたんぱく質を直接攻撃して、細胞内へのウイルスの侵入を防ぐ。
同社は発表文で、「バムラニビマブ」は「コロナ検査で陽性となった場合、できるだけ早く、症状が出始めてから10日以内に」投与すべきだと説明。患者は静脈注射の費用の支払いがある可能性はあるが、薬剤自体の自己負担はないという。(Bloomberg 11月9日)
米政府は、「バムラニビマブ」の州保健当局への配布を週内に開始するとしている。
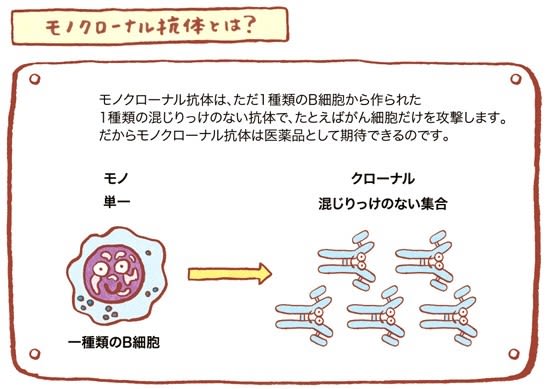
モノクローナル抗体治療薬とは?
抗体医薬品では、モノクローナル抗体が注目されている。
ヒトの体内のウイルスに感染した細胞やがん細胞などの「異物」(抗原)に対して、免疫細胞のB細胞がこれらの異物(抗原)を攻撃するために、特定の「目印」を持つ「異物」(抗原)に結合する抗体をつくる。
たとえば、ほとんどのがん細胞は他の正常な細胞にはない特定の目印を持っている。 「もし、その特定の「目印」だけに結合して攻撃する抗体を大量に作成することができれば、治療薬として期待できる」という発想から生まれたのがモノクローナル抗体治療薬である。
モノクローナル抗体は、ただ1種類のB細胞が作る抗体のコピー、つまりクローンです。モノは「単一」、クローナルは「混じりっけのない集合」を意味する。

出典 中外製薬 HP
モノクローナル抗体は、新型コロナウイルスに対する素早い反応を免疫系に促すと期待されている。考え方としては新型コロナ回復者の血漿を用いる治療法と似ているが、モノクローナル抗体は単なる血液からの抽出物ではなく、バイオ技術によって人工的にに作られる点が異なる。
抗体は、免疫系が病原体に反応して作り出すY字型のたんぱく質で、重要な役割は2つある。
1つは、ウイルスに取り付き、ウイルスが細胞に侵入して複製するのを防ぐこと。もう1つは、病原体に目印を付け、免疫を担う他の細胞やたんぱく質が退治できるようにすることだ。
ワクチンは体に抗体を作らせる。一方、モノクローナル抗体や回復者の血漿を用いた治療は、患者の体内に直接、抗体を送り込む。どちらもウイルスと闘う免疫系にアドバンテージを与えるのが目的だ。
新型コロナ回復者の血液から抽出する血漿には、様々な種類の抗体が含まれる可能性があるのに対して、モノクローナル抗体は特定の抗原(ウイルス)を攻撃する。新型コロナウイルスを対象としたモノクローナル抗体は、鼻や口でウイルスが生存できないようにし、肺に到達して深刻な症状を引き起こすのを防ぐ。
「理論的には、『そもそも肺に行けるようなウイルスがいない』という状態を作りたい」。米ノースカロライナ大学チャペルヒル校の感染症専門医であり、COVID-19予防試験ネットワーク(CoVPN)を率いるマイロン・コーエン氏はそう説明する。「心配すべきは鼻への感染ではなく、下気道への感染です」
米製薬大手イーライリリーをはじめとする多くの企業は、新型コロナ回復者の血液を調べて抗体の開発に役立てようとしている。リジェネロン社の場合は、ヒトの免疫系を持たせたいわゆるヒト化マウスに新型コロナウイルスを感染させ、抗体を作り出すヒトの免疫細胞を抽出した。
その中から、新型コロナウイルスのスパイクたんぱく質に最もよく結合する抗体を作れる細胞がどれかを調べる。スパイクたんぱく質は、ウイルスがヒトの細胞に侵入する際に鍵の役割を果たす。
こうした選別過程を経て、特定の1種類(モノ)の抗体のみを作るクローン細胞の株が生み出される。それを使って作られるのが「モノクローナル」抗体だ。
リジェネロン社ではハムスターの卵巣由来の細胞を用いて抗体を大量に生産している。巨大なタンクの中で細胞を培養し、そこから抗体を抽出する。(米紙ワシントン・ポスト)
最終的にでき上がるREGN-COV2には、新型コロナウイルスへの結合のしかたが少しずつ異なる2種類のモノクローナル抗体が含まれる。エイズウイルス(HIV)に対して複数の抗ウイルス薬を併用する「カクテル」療法と同じように、この抗体の「デュオ」もウイルスに対してより効果的だと考えられている。
効果と安全性は?
REGN-COV2は効果と安全性の確認がまだ取れていないため、試験段階にある治療薬ということになる。米食品医薬品局(FDA)は、回復者の血漿や抗ウイルス薬「レムデシビル」と違い、REGN-COV2に対しては緊急使用許可を出していない。
あらゆる治療法は、臨床試験において検証が行われるのが原則だ。患者を、その薬を投与するグループと、効果がないとされるプラセボ薬を与えるグループにランダムに振り分け、結果を比較する。リジェネロン社のREGN-COV2は、こうした試験の初期段階にある。完全な結果がまだ公表されていないこともあり、この治療薬の使用を懸念した医療関係者もいた。まして大国のリーダーに使うとなるとなおさらだ。
リジェネロン社は9月29日に投資家およびメディア向けの会見を開き、最初の275人の患者に実施した臨床試験の暫定的な結果を発表した。それによると、自分自身の抗体が十分に作られていなかった患者に対し、REGN-COV2を8グラム投与(血管に注入)したところ、鼻の中のウイルス量が減少した。また、症状が軽減する傾向も見られたが、統計的に有意な差が出るには至っていないという。同社はなるべく早い時期に正式な結果を発表したいとしている。
リジェネロン社と提携してREGN-COV2の予防的治療薬としての効果を検証しているCoVPNのコーエン氏は、今のところモノクローナル抗体の安全性に問題はなく、「安全でないと考えるべき理由もありません」と話す。ウイルスのスパイクたんぱく質を攻撃するものですので、どう考えてもヒトの組織には干渉しないとする。
しかし、抗体治療には懸念材料がつきまとう。その1つが、特定の状況下ではかえってウイルスがヒトの細胞と結合する能力を高めてしまい、病状を深刻化させる可能性だ。
抗体依存性感染増強(ADE)と呼ばれるこの現象は、少なくともREGN-COV2を用いた動物実験では見られていない。ただし、この結果を記した論文はまだ査読を終えていない。
リジェネロン社のボウイ氏によれば、これまでに2000人以上が臨床試験に参加し、データを追跡している独立した委員会で安全性への懸念が示されたこともないという。「安全性は私たちの最大の関心事であり、常に注意深く見守っていますが、今のところ問題は起きていない」としている。
(要約 「解説:トランプ米大統領に投与、モノクローナル抗体とは」 National Geographic 2020年10月6日)
一躍脚光抗体治療薬 トランプ大統領にも投与 米イーライリリー社抗体治療薬の臨床試験で被験者の登録を停止
新型コロナの回復期血漿療法、米FDAが緊急使用許可
抗炎症ステロイド剤 デキサメタゾン(Dexamethasone) コロナ治療薬に 厚生労働省
7月17日、厚生労働省は新型コロナウイルス感染症の診療の手引を改定し、抗炎症作用のあるステロイド剤「デキサメタゾン」を二つ目の治療薬と位置づけ、追加掲載した。新型コロナの治療薬では、抗ウイルス薬のRemdesivir(レムデシビル 商品名ベクルリー Gilead Sciences)がすでに承認されている。
「デキサメタゾン」はすでに喘息やリュウマチ、肺炎などの重症感染症向けの抗炎症ステロイド薬として承認されている。新型コロナウイルス感染症も含まれるため、新たな承認手続きなどは不要として、厚労省の診療の手引に掲載された。
新型コロナの治療に薬が使われる場合、治療費は公費でまかなわれ、患者の負担は発生しない。
「デキサメタゾン」については、 6月25日、米感染症学会は、デキサメタゾンを条件付きで推奨するよう治療ガイドラインを更新し、米国立衛生研究所も独自のガイドラインについて同様の変更を行った。厳密には米食品医薬品局(FDA)が承認する治療薬ではないものの、デキサメタゾンは、COVID-19の生存率を高めることが示された最初の治療薬となった。
一方、欧州では、9月18日、欧州医薬品庁(EMA)が新型コロナウイルスに感染して呼吸補助が必要な重症患者に対するステロイド系抗炎症薬「デキサメタゾン」使用を推奨する方針を示した。
これに対して、世界保健機関(WHO)は、「新型コロナの重症・重篤」患者にのみデキサメタゾンを使用するよう推奨している。
一方、7月4日、世界保健機関(WHO)は、COVID-19の治療薬を見つけるために世界各国が協力して実施する「連帯治験」(Solidarity Trial)で、抗HIV薬の「ロピナビル」と「リトナビル」併用の治験と抗マラリア薬ヒドロキシクロロキンの治験の2部門を打ち切ると発表した。
この2部門については、治験担当者の研究会合で暫定結果が説明されたが、2部門とも通常の治療と比較して入院患者の致死率を減らす効果がほとんど見られないと判断が下された。
WHOは「連帯治験」運営委員会の勧告に従い、2部門の治験中止を決めた。このうちヒドロキシクロロキンは、米FDAや英仏が相次いで治験を中止、WHOも6月中旬から新たな患者での治験に入っておらず、治療薬としての研究を事実上止めていた。
「連帯治験」はWHOが設けた国際協力の枠組みで行われるもので、世界39カ国が参加し、5500人近い治験者が協力している。
「デキサメタゾン」は、トランプ大統領が、新型コロナウイルスに感染して入した際に、治療に使用されたとして注目を浴びた。
大統領の医師団は10月4日、トランプ氏がデキサメタゾンの投与を受けていると表明。ホワイトハウスは大統領が順調に回復しているとし、トランプ氏本人は5日午後、この日の夕方に退院するとツイッターに投稿した。
ただ、デキサメタゾンは通常は重症患者に投与される医薬品。米国感染症学会(IDSA)は、デキサメタゾンは酸素吸入が必要になっている重症の新型ウイルス感染症患者に効果がある一方、自己免疫反応が抑制されるため、軽症者に投与された場合はむしろ害になる恐れがあるとしている。
また国際骨髄腫財団によると、副作用として視界不良や不整脈などの身体症状のほか、人格変化や思考困難、攻撃性、錯乱などの精神症状が出る恐れがある。
南カリフォルニア大学(ロサンゼルス)の感染症専門家、エドワード・ジョーンズロペス氏は「ステロイドは非常に危険な医薬品だ」とし、「このため、デキサメタゾンは重症患者に投与されている。神経精神の面で副作用が出る恐れがあるため、極めて慎重に利用されている」と述べた。
一方、ジョンズ・ホプキンズ・センターのシニアスカラー、アメエシュ・アダルジャ氏は、デキサメタゾンは新型ウイルスに感染して血中酸素濃度が低下した多くの患者に投与されており、基本的に害はないとの見解を示している。(出典 Reuters 10月5日)
ステロイド薬でコロナ重篤患者の生存率向上、英国で使用開始へ
新型コロナウイルス感染症の重篤患者の3分の1が、ステロイド薬「デキサメタゾン」の投与により一命を取り留めたとの治験結果が6月16日、発表された。同感染症との闘いにおいて「大きな突破口」となる可能性があると、期待が高まっている。これを受けて英政府はきょうから投与を開始することを明らかにした。
英オックスフォード大学のチームが率いる研究者らは、デキサメタゾンを重篤患者2000人超に投与。
暫定結果によると、人工呼吸器がなければ呼吸できなかった患者らの致死率は、同薬の投与により35%低下。また酸素吸入を受けていた患者では、致死率は20%低下したという。
研究チームによると、同薬を毎日服用することで、人工呼吸器使用患者の8人に1人、酸素吸入のみの患者の25人に1人が命を取り留める可能性があるという。(AFP 6月16日)
英保健当局者によると、デキサメタゾンは1960年代から使用されている抗炎症薬で、ジェネリック(後発薬)として数十年の実績があり、1回の治療にかかる価格は5ポンド(約670円)程度だという。
テドロス事務局長は「酸素吸入や人工呼吸器を必要とする新型コロナ感染症患者の死亡率を下げることが示された最初の治療法だ」と称賛して、研究チームから報告を受けており、数日内に完全なデータ分析が得られるとの見通しを示した。WHOは今後、複数の研究を統合した上で統合的に分析するメタアナリシス(医療 において、最も質の高い根拠)をまとめるとした。
一方、韓国疾病予防管理局(KCDC)の鄭銀敬(チョン・ウンギョン)局長は、新型コロナウイルス感染症患者に使用することに注意を呼び掛け、 同薬は患者の炎症反応を減らすだけでなく、免疫システムも損ない、副作用をもたらす可能性があると警告した。
米国の医療従事者も、デキサメタゾンについて、期待を抱きながらも懐疑的な見方を表明。新型コロナの有力な研究結果が最近撤回されたことに言及し、データを見て確認したいとしている。 (Reuters 6月17日)

アビガン(ファビピラビル) 出典 富士フィルム ホームページ
「アビガン」承認見送り 継続審議
12月21日、厚生労働省の専門部会は、「アビガン」(ファビピラビル)について、現時点では「有効性を明確に判断することは困難」として、継続審議とした。海外で実施中の臨床試験などの結果の提出を待ち、年明け以降に審議するとしている。
富士フイルムホールディングスは、10月16日、新型コロナウイルス感染症の治療薬として「アビガン」の製造販売の承認を厚生労働省に申請した。承認されれば「レムデシビル」と「デキサメタゾン」に続き、新型コロナ薬として国内3例目。2020年5月、当時の安倍晋三首相が「今月中の承認をめざしたい」と発言。厚労省も早期承認を後押して、治験データがなくても承認できるという異例の通知を出し、政権を上げて早期承認に「前のめり」だった。
アビガンは富士フイルム富山化学(富士フイルム子会社)が開発した新型インフルエンザ治療薬で、すでに承認されている。 ただしアビガンは、妊娠中妊婦に投与すると副作用で胎児に影響が出る恐れがあるため、妊婦などは服用できない。
2020年4月、藤田医科大学の土井洋平教授が日本感染症学会のシンポジウムで迅速観察研究の結果を報告し、アビガン投与開始14日後に重症患者の6割が改善、軽症や中等症では9割の患者で改善が認められたとした。その後、俳優の石田純一氏や脚本家の宮藤官九郎氏(50)、フリーアナウンサーの赤江珠緒氏など著名人が投与後の効果を証言して注目を浴びた。
同社では、新型コロナウイルスの治療に効果がある可能性があるとして、早期承認を目指して3月末から第三相臨床試験(治験)を開始した。
治験は20~74歳の重症でない新型コロナウイルス肺炎の患者156人に実施、有効性や安全性をランダム化プラセボ対照試験で検討した。「アビガン」投与群では、解熱や肺機能の改善が進み、PCR検査の結果が陰性になるまでにかかる日数の中央値が11.9日、プラセボ投与群では14.7日となり、症状の早期改善が確認できて、安全性上の新たな懸念は認められなかったとした。しかし、症状回復までの日数はわずか2.8日の短縮にとどまる。富士フイルム幹部は「結果は100点満点ではない。特効薬とまでは言えない」と述べたというが、有効性のエビデンスとしては脆弱である。
さらに治験の実施方法にも問題があった。
一般的な治験は、客観的に評価するため、患者に投与されるのはワクチン候補なのか偽薬か、医師も患者も知らない「二重盲検」という手法で実施される。しかし今回は、医師側はどの患者がワクチン候補を投与されたが知っている「単盲検」という手法だった。
「単盲検」は、重篤な副作用が予測されるなど、医師側が知らないと対処できない場合などに限られる。「二重盲検」に比べ科学的な根拠が薄く、「偽薬は効かない」といった先入観が症状の判断に影響を与える可能性あるとされる。
医薬品医療機器総合機構(PMDA)が部会に提出した報告書は、「単盲検」の手法をとったことなどにより「有効性の結果に影響を及ぼしたと考えられる」と指摘。薬の有効性について「明確に判断することは困難と考える」とした。
出典 富士フイルム富山化学 報道発表資料
富士フイルム、アビガン承認申請 新型コロナ治療薬
10月16日、富士フイルムホールディングス傘下の富士フイルム富山化学(東京)は、新型インフルエンザ治療薬「アビガン」(一般名ファビピラビル)について、新型コロナウイルス感染症の治療薬としても承認するよう厚生労働省に申請したと発表した。軽症者の症状の早期改善に効果が確認されたとしている。
承認されれば「レムデシビル」や「デキサメタゾン」に続き国内3例目の新型コロナ治療薬となる。
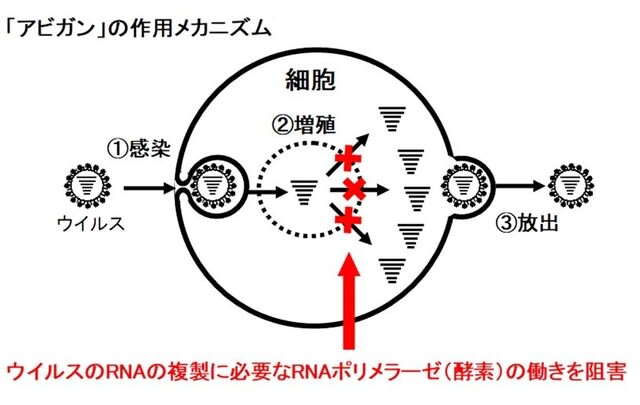
アビガンは富山化学が開発し、新型インフルの治療薬として2014年に承認を受けている錠剤(経口投与)で、ウイルスが複製する際に必要な酵素RNAポリメラーゼを選択的に阻害することでウイルスの増殖を防ぐことができる。
「レムデシビル」と「デキサメタゾン」は重症者が対象とする治療薬に対して、アビガンは比較的症状が軽い新型コロナウイルスの患者に対して効果が確認されていた。
同社は、新型コロナに対しても有効性を持つか確かめる治験を重症でない肺炎患者を対象に今年3月に開始。 症状の改善を早める一定の効果を9月までに確認し、安全上の新たな懸念は認められなかった。
「アビガン」はアビガン」は経口投与であり、患者が簡単に服用可能になるため、医療機関の負担が大幅に軽減できる。これに「レムデシビル」は点滴、「デキサメタゾン」は経口か注射になるため医療機関の負担が大きい。
しかし、アビガンは、妊娠中に服用すると胎児の奇形や流産・死産を起こす恐れがあることが動物実験で分かっており、妊婦らは使用できない。
アビガンの承認に前のめり
アビガンをめぐっては、当初から政府の前のめりな姿勢が目立った。感染拡大防止を前提としつつ社会経済活動を回復させようと急ぐ中で、ワクチンと並び重要視するのが治療薬の開発だ。5月の記者会見で当時の安倍晋三首相が「今月中の承認をめざしたい」と発言。
政府関係者は、タミフルなどの治療薬の開発で新型インフルエンザに対する脅威が下がったとして、治療薬の重要性を指摘。早期承認に慎重な厚生労働省の対応を批判し、日本発のコロナ治療薬への期待を寄せてきた。
経済の活性化や来年夏の五輪開催に向けても、治療薬の存在は大きい。
安倍前首相が5月に承認の意欲を示した後、厚労省は早期承認のための特例を認める異例の通知を出した。治験を経ずに特定臨床研究や観察研究のデータをもとに承認申請をするのでは、と懸念の声が上がっていたが、結局、最も信頼性の高い治験データによる申請となった。
だが国内の感染者数の減少で臨床試験(治験)の参加者が想定どおり集まらず、申請は首相発言から5カ月後だった。
治験には156人が参加した。アビガンを投与した場合、解熱や肺機能の改善が進み、PCR検査の結果が陰性になるまでにかかる日数の中央値が11・9日で、偽薬をのんだ患者より2・8日短くなった。富士フイルム幹部は「結果は100点満点ではない。特効薬とまでは言えない」と話す。
アビガンは新型インフルエンザ治療薬として承認を受けており、一部の病院で患者の希望と医師らの判断で使える「観察研究」という枠組みで新型コロナ患者にも投与することが可能だ。
有効性には疑問の声が相次ぐ
「レムデシビル」と「デキサメタゾン」に続く第三の治療薬の登場を待ち望む声は大きいが、専門家からはアビガンの有効性について疑問の声も出ている。
アビガンは、細胞に入ったウイルスの増殖を抑える。使う対象者は軽症者らが想定され、早期に使うことでウイルスが増えず、重症化予防につながると期待する声が上がる。一方で数日早く熱が下がる程度にどれほどの意味があるのか、疑問視する声もある。
一般的な治験は、思い込みを防ぎ客観的に評価するため、服用するのが薬なのか偽薬か医師も患者も誰も知らない「二重盲検」と呼ばれる方法で行われる。先に承認されたレムデシビルの臨床試験は、千人超を対象に「二重盲検」で行った。
しかし、今回の治験は、患者以外の医師などはアビガンをどの患者が服用しているかを知っている「単盲検」と呼ばれる試験法で行われた。
「単盲検」は、重い副作用が予測され、医師がどの人に薬を使っているか知らないと対処ができない場合などに限定されている。今回は「二重盲検」という手法をとらなかった。
これに対して、富士フイルムは「肺炎が急速に悪化することがあり、偽薬をのんだ患者の治療が遅れることを懸念し、厚労省などと協議して決めた」と説明する。
アビガンは2014年3月、従来の薬が効かない新型インフルエンザの薬として承認された。ただし季節性インフルの患者を対象にした当時の治験で十分な有効性は示せず、国に追加の治験結果を提出することなどが承認の条件とされ、厚労相の要請がなければ製造できないという条件を課せられた。
当時の厚労省の薬事・食品衛生審議会の部会の議事録によると、「新型に効くという根拠がわからない」「今ここで承認しなくてはいけないのか疑問がある」と承認を疑問視する声が出た。だが「一般に流通するわけではないので」と部会長がまとめた。
その後、米国で実施した二重盲検の治験で有効性が一部示され、17年3月に厚労相の要請がなくても製造できるようになり、200万人を目標とした備蓄方針も決まった。
アビガンは今後、PMDAと厚労省の薬事・食品衛生審議会で、その安全性と有効性を審査するが、11月に承認されるという見通しは必ずしも明るくない。
10月6日、田村憲久厚生労働相は、治療薬候補のアビガンについて、政府が審査を3週間で終えて11月に承認する方向で計画しているとの一部報道について、「申請前から承認時期が決まっていることはあり得ない」と否定した。厚労相は「有効性や安全性を確認した上で承認するか決める。時期が決まっていたら審査する意味がない」と述べた。
アビガン、有効性示されず 臨床研究で、藤田医大が発表 国産治療薬誕生に「前のめり」の安倍政権に誤算
抗インフルエンザ薬 アビガン COVID-19の国産初の治療薬として有望視 症状改善に効果 多くの事例相次ぐ
アビガン(AVIGAN)富士フイルム富山化学 ファビピラビル(Faviparavir) 承認済の抗インフルエンザ薬

出典 Europeanpharmaceuticalreview.com
FDA、ギリアドのレムデシビルを承認 米で初のコロナ治療薬に WHO効果に疑問 死亡率・入院期間に影響なし
10月22日、米食品医薬品局(FDA)は、米ギリアド・サイエンシズ社の抗ウイルス薬「レムデシビル」を新型コロナウイルス感染症で入院を必要とする患者の治療薬として承認した。
米国立衛生研究所(NIH)が主導した大規模な臨床試験(治験)で入院期間を短縮させる効果が確認され、FDAが5月に緊急使用を許可していた。
同社株は引け後の時間外取引で4.3%上昇した。
10月15日、Reutersは、WHOが実施した臨床試験で、米バイオ医薬品メーカー、ギリアド・サイエンシズの抗ウイルス薬「レムデシビル」が、新型コロナウイルス感染症の治療で入院期間や死亡率にほとんど影響を与えなかったと伝えた。
レムデシビルは、トランプ米大統領にも投与されていた。
WHOは、世界30カ国以上で計1万1266人の患者を対象に、レムデシビル、ヒドロキシクロロキン、ロピナビル/リトナビル、およびインターフェロンの効果を調べたが、これらの治療薬は、28日間の死亡率や入院期間に全く影響しないか、もしくはほとんど影響しなかったという。 ギリアド社は今月、新型コロナ患者1062人を対象としたレムデシビルの治験で、プラセボ(偽薬)群と比べて治療期間を5日短縮する効果が確認されたと発表している。
ギリアド社は、この治験結果は、複数の無作為化対照試験の結果が査読を経て専門誌に出版され、レムデシビルの臨床的利点が裏付けられているのに対し、WHOの治験は建設的な科学的議論を行うために必要な厳しい審査を受けていないとの見方を示した。
さらに11月20日、世界保健機関(WHO)は、日米などで新型コロナウイルスの治療薬として承認されているレムデシビル( Remdesivir)について、症状の軽重にかかわらず新型コロナ患者には使用しないよう勧告した。 致死率などの改善効果は実証されていない一方、副作用の可能性や医療現場の負担の問題があるためという。 WHOは10月に、WHOが主導する国際的な治験で、入院患者への効果が「ほとんどないか、全くなかった」との暫定結果を発表していたが、不使用の勧告は出していなかった。 勧告を盛り込んだガイドラインを策定した専門家委員会は、メリットがないことが証明されたわけではないが、副作用の可能性やコスト、静脈注射が必要で医療リソースへの負担があることを考慮し、勧告が必要と結論付けたという。ただ、今後も検証を続けることは支持するとした。
これに対して、加藤勝信官房長官は、「厚生労働省において特段、承認について見直す必要はないというのが現時点での認識と承知している」と述べ、承認を見直す考えがないことを明らかにした。

出典 Gilead Sciences HP
レムデシビル1人25万円 ギリアド社が価格公表
レムデシビル 投与期間 5日間と10日間で大差なし 効果は限定的か
レムデシビル、米国では当初患者に十分行き渡らない見通し 患者への投与開始
レムデシビル 薬事承認 厚労省
米FDA、レムデシビルの新型コロナ向け緊急使用を承認 コロナ治療に「明確」な効果
レムデシビル ギリアド・サイエンシズ社[米国]
アクテムラ、コロナ治療に有効…英政府が発表
12月7日、英政府は、関節リウマチの治療薬「トシリズマブ」(製品名アクテムラ:中外製薬)とモノクローナル抗体製剤「サリルマブ」(ケブザラ :リジェネロン)が新型コロナウイルスの治療に有効であると発表した。トシリズマブは岸本忠三・元大阪大学長と中外製薬が開発し、「アクテムラ」の商品名で知られる。
英政府が支援した臨床研究で明らかになったもので、集中治療室の患者に対して抗炎症薬「デキサメタゾン」の投与など通常の治療をした場合の死亡率は35・8%だったのに対し、搬送から24時間以内にトシリズマブなども追加で使った場合は27・3%まで低下したとした。
この結果、二つの薬を追加で投与した場合に死亡リスクが24%下がると結論づけられ、患者が集中治療室に入る期間も7~10日間短縮できたという。英国では今後、集中治療室に運ばれた患者に対して使用する。
今回の「REMAP-CAP」試験では新型コロナの治療薬となりそうなさまざまな医薬品が無作為に患者に投与された。英国を中心に3900人余りが参加したが、アクテムラは350人、ケブザラは45人とごく一部にとどまり、有効性のエビデンスとしては脆弱である。
また投与によって、死亡率が下がったとしているが、その効果はわずか8.5%に過ぎない。
トシリズマブ(中外製薬の「アクテムラ」)
4月8日、スイスの製薬大手ロシェグループの中外製薬は、新型コロナウイルス肺炎治療薬としての承認取得に向け、抗ヒトIL-6(インターロキシン6)モノクローナル抗体製剤、「アクテムラ」(ACTEMRA)(一般名:トシリズマブ)の国内治験(第III相臨床試験)を実施すると発表した。
治験の対象は、国内の重症COVID-19肺炎の入院患者。中外製薬は「今後試験の詳細を確定の上、速やかな患者登録の開始を目指す」としている。
アクテムラは、中外製薬が開発した国産初の抗体医薬品。国内では関節リウマチ、キャッスルマン病などの治療薬としてすでに承認され、海外では米国、欧州で承認されている。
「アクテムラ」は他の生物学的製剤とは異なり、インターロイキン6(IL-6)という物質が引き起こす「免疫暴走(サイトカインストーム)」の働きを抑えるモノクローナル抗体製剤で、体内で過剰に作られたIL-6は免疫暴走を誘発して、炎症を引き起こす作用がある。関節リウマチの患者では、炎症に由来する様々な症状を発生させる。「アクテムラ」はIL-6が入り込もうとする受容体に結合して、IL-6が受容体に結合するのをブロックすることで炎症に由来する様々な症状を抑えて関節破壊の進行を抑制して症状を改善する。
海外では、3月19日に、中外製薬の親会社のロシュ社(スイス)が、重症COVID-19肺炎の入院患者約330例を対象に、アクテムラの安全性・有効性を評価する第III相臨床試験の開始を発表している。
重症の患者に対するアクテムラの効果については、国内の研究者・臨床医から期待する声が上がっており、ノーベル医学生理学賞受賞者の本庶佑京大特別教授も4月6日付で公表したCOVID-19対策の緊急提言で、①急性期には抗ウイルス剤「アビガン」、②重症肺炎時の炎症反応の暴走時にはトシリズマブ(アクテムラ)などを実地導入すべきとだとしている。
免疫暴走(サイトカインストーム)の抑制
トシリズマブ(アクテムラ)は、フランスでは、129人の新型コロナウイルスの患者に投与したところ、アクテムラを投与しなかった患者に比べて、著しく死者が減少したという報告がされている。また中国では、2020年3月から重症の患者に投与したところ、20人中19人が症状が改善し、約2週間で退院したという症例が報告されている。
国内では、大阪はびきの病院では重症患者にアクテムラを投与したところ、全員が症状改善に向かったとしている。
インターパーク倉持呼吸内科院長の倉持仁氏は、「関節リュウマチの患者にはアクテムラをすでに使用しているが、通常、重症の感染症がないことやリューマチ内科の専門医と一緒になって治療にあたっていくことが重要だ」と述べ、「アクテムラを使用すると、どしても感染症がおこったり足が壊疽したりすることが発生する。普通は血液検査でCRPという数字が上昇したり、発熱したりしたりして気が付くことが多いが、アクテムラを服用しているとこうした症状がカバーされてしまい気が付かないケースが発生する。アクテムラ使用の臨床体験がある医師の十分な診療体制が不可欠である」とした。(出典 テレビ朝日 羽鳥慎一モーニングショー 5月6日)
混迷 抗マラリア薬 ヒドロキシクロロキン
トランプ氏 抗マラリア薬を毎日服用
5月18日、トランプ米大統領は、新型コロナウイルス向けに推奨する抗マラリア薬「ヒドロキシクロロキン」について、自身も服用していると明らかにした。ヒドロキシクロロキンをめぐっては、新型コロナへの効果を疑問視する見方が出ているほか、心臓への副作用をもたらす恐れがあると専門家が警告している。
トランプ氏は、ホワイトハウスで記者団に「この1週間半ほど、私も錠剤を毎日飲んでいる」と語った。自身は新型コロナ感染検査で陰性と診断されているが、それでも服用する理由について「いい話を多く聞いている」と説明した。
また、副作用の副作用の危険性を否定するとともに、ホワイトハウスの医師も反対しなかったと主張。「最前線で新型コロナ対応に当たる人も、多くの医師も服用している」と強弁し、新型コロナの予防や治療用にヒドロキシクロロキンを推奨した。
トランプ氏の主治医は同日、大統領報道官を通じて声明を出し「大統領と十分に議論した末、ヒドロキシクロロキン服用の潜在的効能が、リスクを上回るという結論に達した」と説明した。治療法に関する研究成果を引き続き注視していくとも強調した。
米食品医薬品局(FDA)は4月、ヒドロキシクロロキンを新型コロナの治療や予防に用いた場合「命に関わりかねない心拍異常など深刻な副作用が報告されている」と警告を出していた。
6月3日、トランプ米大統領(73)の主治医はランプ氏が新型コロナウイルス感染予防のため2週間の抗マラリア薬「ヒドロキシクロロキン」服用を終え、副作用がなかったことを確認した。ヒドロキシクロロキンをめぐっては、新型コロナへの効果を疑問視する声が出ているほか、心臓への副作用のリスクも指摘されている。
ホワイトハウスがこの日公表した健康診断結果によれば、トランプ氏は体重が前年からやや増加し約111キロになったが、健康状態に大きな変化はなく、マケナニー大統領報道官は3日の記者会見で「大統領は引き続き健康だ」と強調した。トランプ氏は昨年の健診で、肥満度を示す体格指数(BMI)が医学的に「肥満」とされる30を上回っているとしている。
英医学誌 患者の死亡リスクを高めるとする研究結果
5月22日、英医学誌ランセットは、ドナルド・トランプ米大統領が新型コロナウイルスの感染症「COVID-19」予防のために服用していると発言した抗マラリア薬「ヒドロキシクロロキン」について、患者の死亡リスクを高めるとする研究結果を掲載した。
アメリカやスイスの研究者たちの報告によると、ヒドロキシクロロキンを患者に投与しても治療効果はみられなかったという。
ヒドロキシクロロキンはマラリアやループス腎炎、関節炎などの治療には安全に使用できるが、COVID-19への効果は実証されておらず、複数の公衆衛生当局が心臓に悪影響を及ぼす恐れがあると警告している。
この研究では、新型ウイルス患者9万6000人のデータが用いられた。このうち約1万5000人が、ヒドロキシクロロキンあるいはそれに類するクロロキンを、単独もしくは抗生物質との併用で投与されていた。
その結果、抗マラリア薬を使わなかった患者に比べ、使った患者は入院中に死亡する確率が高く、心拍異常がみられたという。
致死率は、ヒドロキシクロロキンを投与された患者では18%、クロロキンでは16.4%、これらを投与されていない場合は9%だった。ヒドロキシクロロキンあるいはクロロキンを抗生物質と併用で投与された場合の致死率はさらに高かった。
研究者たちはヒドロキシクロロキンを臨床試験以外で使用すべきではないと警告している。
しかし、6月5日、この医学誌の論文は、データの信用性に対する懸念を理由に、執筆者によって取り下げられた。
論文の内容について、執筆者のうち3人が正確さを保証できないとした。データを出した医療関連企業サージスフィアが、独立した検証に協力しないためだと説明した。
サージスフィアの最高経営責任者(CEO)で論文の執筆者として名を連ねたサパン・デサイ氏は、英紙ガーディアンに、独立した検証に協力する意向を示したが、データの公表は「顧客との契約と守秘義務に違反」すると述べ拒否をする姿勢だという。
相次ぐ治験中止 ヒドロキシクロロキン
5月25日、世界保健機関(WHO)は関節リウマチの治療などに使われる薬剤の新型コロナウイルス感染症(COVID-19)に対する効果を確かめるため各国で進められている臨床試験について、予防措置として「一時的に」中断したと発表した。
5月27日、フランス政府は使用禁止とする新たな規制を導入した。またイタリアでは臨床試験が差し止めとなり、英規制当局はオックスフォード大学主導で実施されていた試験を停止したと発表した。 同薬剤は、トランプ米大統領がコロナ予防とし服用を公表した薬剤だが、有害となる恐れもあるとして論争が起きていた。
しかし、6月3日、テドロス事務局長は、急遽一転して「ヒドロキシクロロキン」について、安全性を再検証し、治験再開を認めると表明した。担当委員会が服用者の致死率などデータを検証した結果、「ヒドロキシクロロキン」の使用を含めて治験内容を「修正する理由はない」と結論付けた。
一方、6月3日、米ミネソタ大学は、新型コロナウイルス感染症治療への抗マラリア薬「ヒドロキシクロロキン」が最近ウイルスの感染リスクに遭遇した821人を対象に初めて臨床試験を実施してその結果を公表し、投与しても効果が認められないとした。但し深刻な副作用や心臓への副作用は確認されなかったという。
米FDA、抗マラリア薬の許可撤回 コロナ治療効果認められず
6月15日、米食品医薬品局(FDA)は「ヒドロキシクロロキン」と「クロロキン」を新型コロナウイルス感染症治療に用いることを認めた緊急使用許可を撤回した。両薬剤はトランプ米大統領が推奨してきたが、FDAの決定により政治色の強い治療法が利用不可能となった。
両薬剤は当初、研究室での実験で新型ウイルスを不活性化させる効果が確認され、初期の小規模な試験では人間の体内での有効性も示唆されていたことから、FDAが今年3月に新型ウイルス感染症の治療目的での緊急使用を承認した。
しかしその後、より大規模で管理の行き届いた実験により、両薬剤が新型コロナウイルス感染症の治療にも、ウイルスにさらされた人の感染防止にも効果がないことが判明。同時に、特定の患者に不整脈を起こす恐れなどの安全性の懸念が浮上していた。(AFP 6月15日)
深堀情報 Media Close-up Report ~東京オリンピック・新型コロナウイルス・4K/8K 5G~

新型コロナウイルスの治療薬



作成 IMSSR
新型コロナウイルス 治療薬・ワクチン 開発最前線 ~レムデシベル アビガン モデルナ オックスフォード大学/アストラ・ゼネカ Johnson & Johnson臨床試験 勝者は誰が?~
ワクチンの種類 遺伝子ワクチン ウイルス・ベクター・ワクチン プロテイン・ベース・ワクチン 不活性化ワクチン
モデルナModerna BioNTech /Pfizer 最終段階の第三相臨床試験開始 「年内の実用化可能」
Moderna ワクチン価格32-37ドル
モデルナのコロナワクチンで患者全員が抗体を獲得-初期臨床試験 27日ごろから後期大規模治験へ
米モデルナ、臨床試験延期の報道 株価一時7%安
米モデルナ社の新型コロナワクチン、mRNA-1273 前期治験で有望な結果 米政府 約5億ドルの開発費支援
Mederna RNA-1273 最先端の遺伝子技術を駆使して開発するmRNAワクチン
モデルナ ワクチン、mRNA-1273の第2相(フェ―ズⅡ)臨床試験を開始
米FDA PfizerとBioNTechのワクチン、BNT162b1とBNT162b2 ファストトラックに指定 治験で良好な結果
米、規制当局の承認後すぐに配布開始 コロナワクチン計画
BARDA NIH(米国立衛生研究所) NIAID(米国立アレルギー・感染症研究所) CDC(アメリカ疾病予防管理センター)
「ワープ・スピード作戦」 トランプ政権の賭け ワクチン開発でコロナ禍克服
AstraZeneca社 ほとんどの国で製造物責任免責
オックスフォード大/アストラゼネカ ワクチン 抗体とT細胞の「二重防御」の可能性 飛躍的進歩か
英AstraZeneca 米で治験再開 「説明のできない」有害事象発生 最終段階の治験一時中断
厚労省 AstraZenecaと1億2000万回分のワクチン供給で合意 武田薬品 5000万回接種分を国内供給
AstraZeneca 日本での治験8月にも開始 「特例承認」目指す
英アストラ・ゼネカ社 4億本のワクチンを欧州に提供
オックスフォード大学 臨床試験を開始 5000人にボランティアが対象
米Pfizerと独BioNTechのワクチン、治験で良好な結果 9月に最終段階の臨床試験

国際メディアサービスシステム研究所 International Media Service System Research Institute(IMSSR)
2020年1月1日
Copyright (C) 2020 IMSSR
******************************************************
廣谷 徹
Toru Hiroya
国際メディアサービスシステム研究所
代表
International Media Service System Research Institute(IMSSR)
President
thiroya@r03.itscom.net
imssr@a09.itscom.net
******************************************************