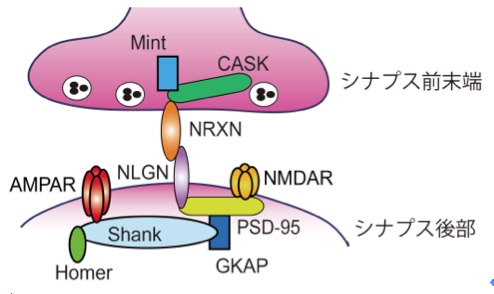
Neurons paralyze us during REM sleep
December 12, 2016
https://www.sciencedaily.com/releases/2016/12/161212152408.htm

※sublaterodorsal tegmental nucleus(SLD): 下背外側被蓋核
(ウイルスベクターで処理したラット (CとD) では、ニューロン(茶色)は存在してはいるが、ニューロンはもはやグルタミン酸(黒色)を放出することができない
Credit: © Sara Valencia Garcia / Patrice Fort, CNRS)
REM睡眠の間の脳は運動器官motor systemを抑制し、眠っている者を動けないようにする
フランスのリヨン神経科学研究センター/Centre de Recherche en Neurosciences de Lyon (CNRS/INSERM/クロード・ベルナール・リヨン第1大学/Université Claude Bernard Lyon 1/ジャン・モネ大学/Université Jean Monnet) の研究者は、この一時的な筋肉の『麻痺paralysis』の原因となるニューロンの集団を突き止めた
今回作られた動物モデルはいくつかの逆説睡眠障害paradoxical sleep disorders、特にこの麻痺を阻害する病態についての源を明らかにすることが期待され、加えて病理に関連性があることからパーキンソン病の研究にも役立つだろう
この研究は2016年12月12日にBrain誌で発表された
※逆説睡眠/paradoxical sleep: REM睡眠のこと
『レム睡眠行動障害/REM sleep behavior disorder(RBD)』は『錯眠/睡眠時随伴症parasomnia』の一種であり、通常50歳ぐらいで生じる
※錯眠/睡眠時随伴症/parasomnia: 睡眠中に起きる異常な身体現象。夢遊病や寝言、夜尿や悪夢など様々な異常行動が含まれる
RBDの患者は深い眠りにもかかわらず話したり蹴ったり、しまいにはベッドから落ちたりする
REM睡眠中の筋肉は休息しているのが普通だがRBDの患者では麻痺が起きず、その理由は明らかになっていない
この患者はおそらく夢の活動を反映して異常行動を示す
CNRSの研究チームはこの病理の解明に向けて一歩進んだ
彼らは脳内の下背外側核/sublaterodorsal nucleusの領域にあるニューロンを特定したのである
それは理想的なことにideally、REM睡眠中に運動器官をコントロールするところに位置している
研究チームはラットでこのニューロンの集団を標的にすべく、遺伝学的に調整したウイルスベクターを加えた
このベクターが神経細胞の中に入ると、シナプスがグルタミン酸の分泌を可能にするための遺伝子の発現を止める
グルタミン酸は興奮性の神経伝達物質excitatory neurotransmitterである
その分泌ができなくなったニューロンはもはや隣のニューロンとコミュニケーションを取ることができなくなり、REM睡眠中に麻痺を生じるために必要な脳のネットワークから切り離される
50年もの間、科学界scientific communityではこれらのグルタミン酸ニューロンがREM睡眠そのものを作り出していると考えられていた
しかし、研究チームが観察したことはこの仮説を無効化する
このニューロン回路の活動がなくてもラットはREM睡眠に入り、すぐに眠り、外界outside worldから切り離されて目は閉じられたが、ラットは麻痺しなかったのである
ラットたちの行動はRBDに罹患する患者の臨床プロファイルを連想させるもので、非常に似ていた
この研究で標的となったグルタミン酸ニューロンは睡眠中の麻痺において必須の役割を演じており、この神経学的疾患neurological diseaseに影響するニューロンとしては初めてのものであるというのが今回の報告である
この研究は睡眠時随伴症parasomniaを模した新たな前臨床モデルを作り出すだけに留まらず、いくつかの神経変性疾患の研究において非常に重要なものになるかもしれない
最近の臨床研究では、RBDと診断された患者はほぼ必ずalmost always、平均して10年後にパーキンソン病の運動症状を発症することが示されている
研究チームは現在、睡眠時随伴症parasomniaからパーキンソン病へと展開evolveする動物モデルを開発しようと試みており、ニューロンの変性がどのようにして起きるのかを理解しようしている
この下背外側核/sublaterodorsal nucleusのグルタミン酸ニューロン/glutamate neuronsは自発的な赤い蛍光を発しており、今回使用したウイルスベクターがうまく加えられたことを示している
http://dx.doi.org/10.1093/brain/aww310
Genetic inactivation of glutamate sublaterodorsal nucleus recapitulates REM sleep Behavior Disorder.
下背外側核でのグルタミン酸の遺伝学的な不活化はREM睡眠中の行動障害を再現する
Summary
特発性REM睡眠行動障害idiopathic REM sleep behaviour disorderの特徴は、逆説睡眠paradoxical sleep(REM睡眠)の間の、正常な筋肉の弛緩atoniaが欠けている状態での、暴力的な夢の行動化the enactment of violent dreamsである
※dream enacting behavior: 夢の行動化
※enactment: (劇の)上演、(法律の)制定
臨床データならびに実験データの蓄積から示唆されるのは、REM睡眠行動障害の原因が『逆説睡眠に関与するグルタミン酸ニューロン』の神経変性によるかもしれないということであり、そのニューロンは橋pontineの『下背外側被蓋核/sublaterodorsal tegmental nucleus』の内部に位置している
※sub下 + lateral側 + dorsal背 + tegmental被蓋 + nucleus核
※laterodorsal tegmental nucleus(LDTN): 背外側被蓋核
※sublaterodorsal tegmental nucleus(SLD): 下背外側被蓋核
ゆえに今回の研究の目的は、まず一つ目は下背外側被蓋核グルタミン酸ニューロンの逆説睡眠における役割を機能的にラットで確定することであり、二つ目はそれらを遺伝学的に不活化することがREM睡眠行動障害を再現するに十分であるかどうかを機能的に確定することである
目的を果たすために我々はまず、下背外側被蓋核が関与するニューロンの回路を解きほぐすdisentangleべく、髄板内視床/intralaminar thalamusならびに腹側髄/ventral medullaに、逆行性のトレーサーretrograde tracersを注入し、
次に、下背外側被蓋核の両側bilaterallyにアデノ随伴ウイルス/adeno-associated viruses(AAV)を注入した
このAAVはSlc17a6のmRNAを標的とするショートヘアピンRNA(shRNA)を持ち、このmRNAは小胞グルタミン酸トランスポーター2/vesicular glutamate transporter 2 (vGluT2) をコードする
これは下背外側被蓋核のグルタミン酸によるシナプスの伝達を長期的chronicallyに抑制するためである
神経解剖学レベルでは、逆説睡眠過眠症hypersomniaの間に特に活性化する下背外側被蓋核ニューロンは、
下行性の遠心性神経descending efferentsを 腹側髄/ventral medullaの内部にあるグリシン/GABAニューロンへと送るが、
上行性の投射ascending projectionsを 髄板内視床/intralaminar thalamusへと送ることはない
これらのデータは、下背外側被蓋核ニューロンが『逆説睡眠の生成』においてというよりもむしろ、『筋肉の弛緩』において決定的な役割を演じることを示唆するものである
この仮説と一致して、下背外側被蓋核へAAV注入した30日後、ラットは日々の逆説睡眠の量/paradoxical sleep daily quantitiesの30パーセントの低下を示したが、
『夢を行動化する異常な運動行動/abnormal motor dream-enacting behaviours』がとてつもなくtremendous増加し、それに伴う『逆説睡眠中の筋緊張muscle tone』の著しい増加を示した
※dream enacting behavior: 夢の行動化
これらのラットは、ヒトのREM睡眠行動障害と非常に似た逆説睡眠中の症状と行動を示す
まとめると、我々のデータは下背外側被蓋核グルタミン酸ニューロンが逆説睡眠中の筋肉の弛緩を作り出すものであり、それはおそらくグリシン/GABA 前運動ニューロンpremotor neuronへの下行性の投射descending projectionsを通じてであることを実証する
それらのニューロンは逆説睡眠の調節に関与はするものの、逆説睡眠の状態そのものを誘導するために必須ではない
さらに、この研究はREM睡眠行動障害の新しく有力な前臨床モデルの正当性を立証するvalidateものであり、それはこの無力化disablingする睡眠障害の研究と治療への道を開き、そしてパーキンソン病のようなシヌクレイノパチーの症状が出る前の段階prodromal stagesに関与する『潜在的な領域』を前進させる
関連記事
https://www.sciencedaily.com/releases/2012/07/120711131030.htm
GABAとグリシンはラットにおいてREM睡眠中の麻痺を引き起こし、それは『筋肉を活動できるようにする脳の特殊な細胞』のスイッチを切ることによる
運動細胞のGABA受容体(イオンチャネル型受容体ionotropic receptorのGABAAだけでなく、代謝調節型受容体metabotropic receptorのGABABも)とグリシン受容体(イオンチャネル型受容体)を阻害すると、REM睡眠麻痺が起きない
REM睡眠障害を持つヒトの約8割が最終的にパーキンソン病のような神経変性疾患を発症する
関連記事
https://www.sciencedaily.com/releases/2012/11/121116085208.htm
呼吸のための筋肉の活動をREM睡眠中に強く阻害するのを仲介する脳の化学物質はアセチルコリンであり、これはムスカリン性受容体を介して作用し、この受容体は特にカリウムチャネルという種類のチャネルと機能的につながりがある
関連記事
https://www.sciencedaily.com/releases/2015/02/150203123423.htm
動物実験によれば、REM睡眠には、脳幹brain stemの中脳橋被蓋核の
背外側被蓋核/laterodorsal tegmentum (LDT) と
脚橋被蓋核 pedunculopontine tegmentum (PPT)
のコリン作動性ニューロンが重要とされてきた
光遺伝学optogeneticsを使ってマウスで実験したところ、ノンレム睡眠中にLDTかPPTのどちらかのコリン作動性ニューロンが活性化するとレム睡眠に入る可能性が高まった
LDTかPPTの活性化はレム睡眠のエピソードは増加させたがレム睡眠の期間は延長しなかったため、レム睡眠の維持には別の仕組みが存在するようである
※脚橋被蓋核は中脳橋被蓋核とも呼ばれる
関連サイト
https://bsd.neuroinf.jp/wiki/%E7%9D%A1%E7%9C%A0%E9%9A%9C%E5%AE%B3
ネコを使った実験では、REM睡眠は情動系の抑制と骨格筋脱力の出現が重要であり、骨格筋脱力は、コリン系の
中脳橋被蓋核(pedunculopontine tegmental nucleus:PPN)と
外背側被蓋核(laterodorsal tegmental nucleus:LDTN)、
アドレナリン系の青斑核(locus coeruleus:LC)から延髄巨大細胞網様体(medullary magnocellular reticular formation:MCRF)を介した系により生じることがわかっている。
齧歯類を用いた実験により、ネコの青斑核(LC)に相当する
下外側背側核(sublateral dorsal nucleus:SLD)
がREM睡眠を促進する働きをもっており、反対に中脳水道周辺の腹外側灰白質(ventrolateral part of the periaqueductal grey matter:vlPAG)、外側橋被蓋(lateral pontine tegmentum:LPT)はREM睡眠を抑制することが示されている。
ネコのLC、SLDの破壊により、レム睡眠行動障害(REM sleep behavior disorder;RBD)が生じることがわかっている。
RBDの症状としてはREM睡眠期に一致して(夜間中~後期に多い)、はっきりとした大きな寝言あるいは発声、腕を振り回す、布団を蹴る、座る、手足をばたつかせるといった複雑な動作が起こる。
関連サイト
https://bsd.neuroinf.jp/wiki/%E5%89%8D%E8%84%B3%E5%9F%BA%E5%BA%95%E9%83%A8
前脳基底部は、睡眠・覚醒に重要な役割を果たす脳幹の縫線核と 大脳皮質との中継的役割を果たしていると考えられており、損傷により睡眠障害がよく見られる。アルツハイマー病の患者では前脳基底部のとくにマイネルト基底核のコリン作動性ニューロンが減少している。
アセチリコリンの作動薬はREM睡眠を促進し、拮抗薬はREM睡眠を抑制する。ネコにおけるマイクロダイアリシス実験では、前脳基底部のアセチリコリンの量がREM睡眠時で最も大きく、non-REM睡眠時に最も小さく、覚醒時にその中間レベルであることが示されている。前脳基底部を破壊すると、皮質の覚醒の度合いが下がるとともに、REM睡眠障害が起こる。
関連記事
https://www.sciencedaily.com/releases/2015/06/150601122442.htm
2013年のロチェスターの研究では、非REM睡眠の間はマウスの脳細胞が萎縮して脳脊髄液のためのスペースを作り、Aβのような毒性のある代謝物を洗い流すことが示された
<コメント>
下背外側被蓋核のグルタミン酸ニューロンがREM睡眠中の麻痺を、
背外側被蓋核のコリン作動性ニューロンがREM睡眠そのものの促進を担当しているということか
フルダイブVRMMO的な応用ができるかもしれない
December 12, 2016
https://www.sciencedaily.com/releases/2016/12/161212152408.htm

※sublaterodorsal tegmental nucleus(SLD): 下背外側被蓋核
(ウイルスベクターで処理したラット (CとD) では、ニューロン(茶色)は存在してはいるが、ニューロンはもはやグルタミン酸(黒色)を放出することができない
Credit: © Sara Valencia Garcia / Patrice Fort, CNRS)
REM睡眠の間の脳は運動器官motor systemを抑制し、眠っている者を動けないようにする
フランスのリヨン神経科学研究センター/Centre de Recherche en Neurosciences de Lyon (CNRS/INSERM/クロード・ベルナール・リヨン第1大学/Université Claude Bernard Lyon 1/ジャン・モネ大学/Université Jean Monnet) の研究者は、この一時的な筋肉の『麻痺paralysis』の原因となるニューロンの集団を突き止めた
今回作られた動物モデルはいくつかの逆説睡眠障害paradoxical sleep disorders、特にこの麻痺を阻害する病態についての源を明らかにすることが期待され、加えて病理に関連性があることからパーキンソン病の研究にも役立つだろう
この研究は2016年12月12日にBrain誌で発表された
※逆説睡眠/paradoxical sleep: REM睡眠のこと
『レム睡眠行動障害/REM sleep behavior disorder(RBD)』は『錯眠/睡眠時随伴症parasomnia』の一種であり、通常50歳ぐらいで生じる
※錯眠/睡眠時随伴症/parasomnia: 睡眠中に起きる異常な身体現象。夢遊病や寝言、夜尿や悪夢など様々な異常行動が含まれる
RBDの患者は深い眠りにもかかわらず話したり蹴ったり、しまいにはベッドから落ちたりする
REM睡眠中の筋肉は休息しているのが普通だがRBDの患者では麻痺が起きず、その理由は明らかになっていない
この患者はおそらく夢の活動を反映して異常行動を示す
CNRSの研究チームはこの病理の解明に向けて一歩進んだ
彼らは脳内の下背外側核/sublaterodorsal nucleusの領域にあるニューロンを特定したのである
それは理想的なことにideally、REM睡眠中に運動器官をコントロールするところに位置している
研究チームはラットでこのニューロンの集団を標的にすべく、遺伝学的に調整したウイルスベクターを加えた
このベクターが神経細胞の中に入ると、シナプスがグルタミン酸の分泌を可能にするための遺伝子の発現を止める
グルタミン酸は興奮性の神経伝達物質excitatory neurotransmitterである
その分泌ができなくなったニューロンはもはや隣のニューロンとコミュニケーションを取ることができなくなり、REM睡眠中に麻痺を生じるために必要な脳のネットワークから切り離される
50年もの間、科学界scientific communityではこれらのグルタミン酸ニューロンがREM睡眠そのものを作り出していると考えられていた
しかし、研究チームが観察したことはこの仮説を無効化する
このニューロン回路の活動がなくてもラットはREM睡眠に入り、すぐに眠り、外界outside worldから切り離されて目は閉じられたが、ラットは麻痺しなかったのである
ラットたちの行動はRBDに罹患する患者の臨床プロファイルを連想させるもので、非常に似ていた
この研究で標的となったグルタミン酸ニューロンは睡眠中の麻痺において必須の役割を演じており、この神経学的疾患neurological diseaseに影響するニューロンとしては初めてのものであるというのが今回の報告である
この研究は睡眠時随伴症parasomniaを模した新たな前臨床モデルを作り出すだけに留まらず、いくつかの神経変性疾患の研究において非常に重要なものになるかもしれない
最近の臨床研究では、RBDと診断された患者はほぼ必ずalmost always、平均して10年後にパーキンソン病の運動症状を発症することが示されている
研究チームは現在、睡眠時随伴症parasomniaからパーキンソン病へと展開evolveする動物モデルを開発しようと試みており、ニューロンの変性がどのようにして起きるのかを理解しようしている
この下背外側核/sublaterodorsal nucleusのグルタミン酸ニューロン/glutamate neuronsは自発的な赤い蛍光を発しており、今回使用したウイルスベクターがうまく加えられたことを示している
http://dx.doi.org/10.1093/brain/aww310
Genetic inactivation of glutamate sublaterodorsal nucleus recapitulates REM sleep Behavior Disorder.
下背外側核でのグルタミン酸の遺伝学的な不活化はREM睡眠中の行動障害を再現する
Summary
特発性REM睡眠行動障害idiopathic REM sleep behaviour disorderの特徴は、逆説睡眠paradoxical sleep(REM睡眠)の間の、正常な筋肉の弛緩atoniaが欠けている状態での、暴力的な夢の行動化the enactment of violent dreamsである
※dream enacting behavior: 夢の行動化
※enactment: (劇の)上演、(法律の)制定
臨床データならびに実験データの蓄積から示唆されるのは、REM睡眠行動障害の原因が『逆説睡眠に関与するグルタミン酸ニューロン』の神経変性によるかもしれないということであり、そのニューロンは橋pontineの『下背外側被蓋核/sublaterodorsal tegmental nucleus』の内部に位置している
※sub下 + lateral側 + dorsal背 + tegmental被蓋 + nucleus核
※laterodorsal tegmental nucleus(LDTN): 背外側被蓋核
※sublaterodorsal tegmental nucleus(SLD): 下背外側被蓋核
ゆえに今回の研究の目的は、まず一つ目は下背外側被蓋核グルタミン酸ニューロンの逆説睡眠における役割を機能的にラットで確定することであり、二つ目はそれらを遺伝学的に不活化することがREM睡眠行動障害を再現するに十分であるかどうかを機能的に確定することである
目的を果たすために我々はまず、下背外側被蓋核が関与するニューロンの回路を解きほぐすdisentangleべく、髄板内視床/intralaminar thalamusならびに腹側髄/ventral medullaに、逆行性のトレーサーretrograde tracersを注入し、
次に、下背外側被蓋核の両側bilaterallyにアデノ随伴ウイルス/adeno-associated viruses(AAV)を注入した
このAAVはSlc17a6のmRNAを標的とするショートヘアピンRNA(shRNA)を持ち、このmRNAは小胞グルタミン酸トランスポーター2/vesicular glutamate transporter 2 (vGluT2) をコードする
これは下背外側被蓋核のグルタミン酸によるシナプスの伝達を長期的chronicallyに抑制するためである
神経解剖学レベルでは、逆説睡眠過眠症hypersomniaの間に特に活性化する下背外側被蓋核ニューロンは、
下行性の遠心性神経descending efferentsを 腹側髄/ventral medullaの内部にあるグリシン/GABAニューロンへと送るが、
上行性の投射ascending projectionsを 髄板内視床/intralaminar thalamusへと送ることはない
これらのデータは、下背外側被蓋核ニューロンが『逆説睡眠の生成』においてというよりもむしろ、『筋肉の弛緩』において決定的な役割を演じることを示唆するものである
この仮説と一致して、下背外側被蓋核へAAV注入した30日後、ラットは日々の逆説睡眠の量/paradoxical sleep daily quantitiesの30パーセントの低下を示したが、
『夢を行動化する異常な運動行動/abnormal motor dream-enacting behaviours』がとてつもなくtremendous増加し、それに伴う『逆説睡眠中の筋緊張muscle tone』の著しい増加を示した
※dream enacting behavior: 夢の行動化
これらのラットは、ヒトのREM睡眠行動障害と非常に似た逆説睡眠中の症状と行動を示す
まとめると、我々のデータは下背外側被蓋核グルタミン酸ニューロンが逆説睡眠中の筋肉の弛緩を作り出すものであり、それはおそらくグリシン/GABA 前運動ニューロンpremotor neuronへの下行性の投射descending projectionsを通じてであることを実証する
それらのニューロンは逆説睡眠の調節に関与はするものの、逆説睡眠の状態そのものを誘導するために必須ではない
さらに、この研究はREM睡眠行動障害の新しく有力な前臨床モデルの正当性を立証するvalidateものであり、それはこの無力化disablingする睡眠障害の研究と治療への道を開き、そしてパーキンソン病のようなシヌクレイノパチーの症状が出る前の段階prodromal stagesに関与する『潜在的な領域』を前進させる
関連記事
https://www.sciencedaily.com/releases/2012/07/120711131030.htm
GABAとグリシンはラットにおいてREM睡眠中の麻痺を引き起こし、それは『筋肉を活動できるようにする脳の特殊な細胞』のスイッチを切ることによる
運動細胞のGABA受容体(イオンチャネル型受容体ionotropic receptorのGABAAだけでなく、代謝調節型受容体metabotropic receptorのGABABも)とグリシン受容体(イオンチャネル型受容体)を阻害すると、REM睡眠麻痺が起きない
REM睡眠障害を持つヒトの約8割が最終的にパーキンソン病のような神経変性疾患を発症する
関連記事
https://www.sciencedaily.com/releases/2012/11/121116085208.htm
呼吸のための筋肉の活動をREM睡眠中に強く阻害するのを仲介する脳の化学物質はアセチルコリンであり、これはムスカリン性受容体を介して作用し、この受容体は特にカリウムチャネルという種類のチャネルと機能的につながりがある
関連記事
https://www.sciencedaily.com/releases/2015/02/150203123423.htm
動物実験によれば、REM睡眠には、脳幹brain stemの中脳橋被蓋核の
背外側被蓋核/laterodorsal tegmentum (LDT) と
脚橋被蓋核 pedunculopontine tegmentum (PPT)
のコリン作動性ニューロンが重要とされてきた
光遺伝学optogeneticsを使ってマウスで実験したところ、ノンレム睡眠中にLDTかPPTのどちらかのコリン作動性ニューロンが活性化するとレム睡眠に入る可能性が高まった
LDTかPPTの活性化はレム睡眠のエピソードは増加させたがレム睡眠の期間は延長しなかったため、レム睡眠の維持には別の仕組みが存在するようである
※脚橋被蓋核は中脳橋被蓋核とも呼ばれる
関連サイト
https://bsd.neuroinf.jp/wiki/%E7%9D%A1%E7%9C%A0%E9%9A%9C%E5%AE%B3
ネコを使った実験では、REM睡眠は情動系の抑制と骨格筋脱力の出現が重要であり、骨格筋脱力は、コリン系の
中脳橋被蓋核(pedunculopontine tegmental nucleus:PPN)と
外背側被蓋核(laterodorsal tegmental nucleus:LDTN)、
アドレナリン系の青斑核(locus coeruleus:LC)から延髄巨大細胞網様体(medullary magnocellular reticular formation:MCRF)を介した系により生じることがわかっている。
齧歯類を用いた実験により、ネコの青斑核(LC)に相当する
下外側背側核(sublateral dorsal nucleus:SLD)
がREM睡眠を促進する働きをもっており、反対に中脳水道周辺の腹外側灰白質(ventrolateral part of the periaqueductal grey matter:vlPAG)、外側橋被蓋(lateral pontine tegmentum:LPT)はREM睡眠を抑制することが示されている。
ネコのLC、SLDの破壊により、レム睡眠行動障害(REM sleep behavior disorder;RBD)が生じることがわかっている。
RBDの症状としてはREM睡眠期に一致して(夜間中~後期に多い)、はっきりとした大きな寝言あるいは発声、腕を振り回す、布団を蹴る、座る、手足をばたつかせるといった複雑な動作が起こる。
関連サイト
https://bsd.neuroinf.jp/wiki/%E5%89%8D%E8%84%B3%E5%9F%BA%E5%BA%95%E9%83%A8
前脳基底部は、睡眠・覚醒に重要な役割を果たす脳幹の縫線核と 大脳皮質との中継的役割を果たしていると考えられており、損傷により睡眠障害がよく見られる。アルツハイマー病の患者では前脳基底部のとくにマイネルト基底核のコリン作動性ニューロンが減少している。
アセチリコリンの作動薬はREM睡眠を促進し、拮抗薬はREM睡眠を抑制する。ネコにおけるマイクロダイアリシス実験では、前脳基底部のアセチリコリンの量がREM睡眠時で最も大きく、non-REM睡眠時に最も小さく、覚醒時にその中間レベルであることが示されている。前脳基底部を破壊すると、皮質の覚醒の度合いが下がるとともに、REM睡眠障害が起こる。
関連記事
https://www.sciencedaily.com/releases/2015/06/150601122442.htm
2013年のロチェスターの研究では、非REM睡眠の間はマウスの脳細胞が萎縮して脳脊髄液のためのスペースを作り、Aβのような毒性のある代謝物を洗い流すことが示された
<コメント>
下背外側被蓋核のグルタミン酸ニューロンがREM睡眠中の麻痺を、
背外側被蓋核のコリン作動性ニューロンがREM睡眠そのものの促進を担当しているということか
フルダイブVRMMO的な応用ができるかもしれない