Experimental drug shows promise in treating Alzheimer’s disease
October 25, 2016
https://www.sciencedaily.com/releases/2016/10/161025201713.htm
2016年アメリカ麻酔学会/ANESTHESIOLOGY(R) 2016で発表されるマウスの実験結果によると、NTRX-07という実験薬は神経の炎症を防ぎ、アルツハイマー病と関連する異常なタンパク質の凝集を取り除くことにより疾患の治療薬として有望であることが示唆されたという
アルツハイマー病の鍵となる重要な特徴は脳内のアミロイドプラークという異常なタンパク質凝集と、繊維のもつれた束tangled bundles of fibersである
これらの変化は脳に炎症を引き起こしてニューロンを傷つけてゆき、損傷の進行が記憶の喪失や混乱、そして認知症へとつながる
NTRX-07という新薬はそのような炎症を減少させる一方でニューロンを保護し、細胞の再生を保つようである
「NTRX-07はアルツハイマー病と関連する脳内の炎症を減少させる」
中心となった研究者lead researcherのMohamed Naguib M.D.は言う
彼はクリーブランド・クリニック・ラーナー医科大学/Lerner College of Medicineの一般麻酔科Department of General Anesthesiologyで麻酔科医physician anesthesiologistである
「NTRX-07は他の現在利用可能な薬剤とは異なるメカニズムで作用し、単なる対症療法ではなく疾患の原因を標的にする」
研究者たちはNTRX-07の記憶を回復する能力を明らかにしただけでなく、神経因性疼痛neuropathic painという複雑な慢性痛を治療する潜在能力についても研究している
「神経因性疼痛の患者は慢性的な神経の炎症が起きている」
Naguib博士は言う
「この化合物は、そのような炎症を抑制する」
今回の研究ではアルツハイマー病で見られるのと同様の神経変性を発生するようにしたマウスに対してNTRX-07をテストした
マウスを詳しく調べると、疾患に応じて生じた炎症は 脳内の免疫細胞であるミクログリアに変化を引き起こしていた
通常、この免疫細胞はアミロイドプラークというタンパク質の凝集を取り除く細胞である
アミロイドプラークがマウスの脳内に蓄積するにつれてミクログリアはそれらを除去することができなくなり、結果として炎症が起きて神経細胞が損傷し、認知能力の低下が引き起こされた
ミクログリアはその表面にカンナビノイド受容体2/cannabinoid receptor 2(CB2)という受容体が存在し、CB2が活性化されると炎症に対抗する応答/抗炎症応答が生じる
NTRX-07はCB2受容体を標的とするアゴニストであり、炎症を抑制して脳組織へのダメージを防ぐ
加えて、異常なアミロイドプラークの除去を改善し、記憶能力memory performanceや他の認知機能cognitive skillsを改善する
さらに、NTRX-07はSOX2というタンパク質のレベルを増大させる
SOX2は新たな脳細胞の発生を助け、アルツハイマー病患者の脳を保護することがこれまでに示されている
NTRX-07を投与したマウスはSOX2のレベルが正常レベルまで回復した一方で、プラセボを投与したマウスはSOX2レベルの低下を示し、
脳内の炎症が活性化し、アミロイドプラークの除去が悪化して、記憶能力は低下した
<コメント>
元の記事ではNTRX-07とNRTX-07が混在してますが、開発元のサイトを見るとNTRX-07の方が正しいようです
サイトにはNTRX-07が以前はMDA7と呼ばれていたとあります
関連記事
http://fface.exblog.jp/21526492/
Aβによる神経炎症はニューロリギン1/Neuroligin-1(NLGN1)をエピジェネティックに抑制してシナプスネットワークを破綻させるが、この神経炎症プロセスは新規に発見されたMDA7という化合物によって阻止された
クリーブランド・クリニックでは近い将来フェーズI試験を開始する予定である
関連記事
https://alzheimersnewstoday.com/2016/09/28/alzheimers-drug-targeting-cannabinoid-receptor-given-almost-2-million-to-move-to-clinical-testing/
NeuroTherapiaは既に治験薬/investigational new drug(IND)の申請を可能にするための研究を始めており、2017年半ばにはNTRX-07のヒトでの臨床試験を開始することを目標としている
関連サイト
https://bsd.neuroinf.jp/wiki/%E3%83%8B%E3%83%A5%E3%83%BC%E3%83%AD%E3%83%AA%E3%82%AE%E3%83%B3
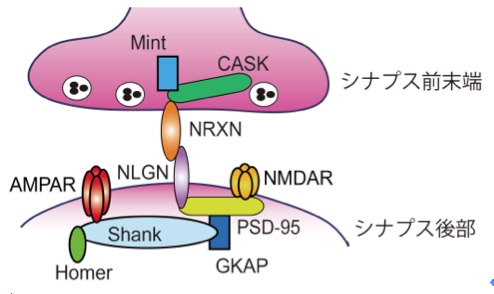
ニューロリギンはシナプス後部に存在する1回膜貫通型タンパク質であり、シナプス前末端に存在するニューレキシン(Neurexin: NRXN)の内因性リガンドであり、シナプスの成熟や機能を調整している
関連サイト
http://www.pharm.or.jp/dictionary/wiki.cgi?%E3%82%AB%E3%83%B3%E3%83%8A%E3%83%93%E3%83%8E%E3%82%A4%E3%83%89
カンナビノイド受容体として、7回膜貫通、Gタンパク質(Gi/Go)共役型のCB1受容体とCB2受容体の2つがある。
CB1受容体は脳などで多量に発現しており、神経伝達の抑制的制御に関与していると考えられている。
CB2受容体は脾臓や扁桃腺など、免疫系の臓器や細胞に多く発現しており、炎症反応や免疫応答の調節に関与していると考えられている。
関連記事
http://blog.goo.ne.jp/news-t/e/c5430d8634bdca32080281683490f6fd
α細胞によって作られたカンナビノイドは膵島に局在するCB1というカンナビノイド受容体を活性化し、細胞機能の分化に影響を与えることでβ細胞がグルコースに応じてインスリンを作る能力を増大させる
関連記事
http://blog.goo.ne.jp/news-t/e/44dd380eae54a796f94b7b5fb5d93849
Aβオリゴマーは補体分子のC1qとC3を活性化し、C3はミクログリアの受容体CR3を通じてシグナルを伝達して、ミクログリアが脆弱なシナプスを飲み込むように刺激する
October 25, 2016
https://www.sciencedaily.com/releases/2016/10/161025201713.htm
2016年アメリカ麻酔学会/ANESTHESIOLOGY(R) 2016で発表されるマウスの実験結果によると、NTRX-07という実験薬は神経の炎症を防ぎ、アルツハイマー病と関連する異常なタンパク質の凝集を取り除くことにより疾患の治療薬として有望であることが示唆されたという
アルツハイマー病の鍵となる重要な特徴は脳内のアミロイドプラークという異常なタンパク質凝集と、繊維のもつれた束tangled bundles of fibersである
これらの変化は脳に炎症を引き起こしてニューロンを傷つけてゆき、損傷の進行が記憶の喪失や混乱、そして認知症へとつながる
NTRX-07という新薬はそのような炎症を減少させる一方でニューロンを保護し、細胞の再生を保つようである
「NTRX-07はアルツハイマー病と関連する脳内の炎症を減少させる」
中心となった研究者lead researcherのMohamed Naguib M.D.は言う
彼はクリーブランド・クリニック・ラーナー医科大学/Lerner College of Medicineの一般麻酔科Department of General Anesthesiologyで麻酔科医physician anesthesiologistである
「NTRX-07は他の現在利用可能な薬剤とは異なるメカニズムで作用し、単なる対症療法ではなく疾患の原因を標的にする」
研究者たちはNTRX-07の記憶を回復する能力を明らかにしただけでなく、神経因性疼痛neuropathic painという複雑な慢性痛を治療する潜在能力についても研究している
「神経因性疼痛の患者は慢性的な神経の炎症が起きている」
Naguib博士は言う
「この化合物は、そのような炎症を抑制する」
今回の研究ではアルツハイマー病で見られるのと同様の神経変性を発生するようにしたマウスに対してNTRX-07をテストした
マウスを詳しく調べると、疾患に応じて生じた炎症は 脳内の免疫細胞であるミクログリアに変化を引き起こしていた
通常、この免疫細胞はアミロイドプラークというタンパク質の凝集を取り除く細胞である
アミロイドプラークがマウスの脳内に蓄積するにつれてミクログリアはそれらを除去することができなくなり、結果として炎症が起きて神経細胞が損傷し、認知能力の低下が引き起こされた
ミクログリアはその表面にカンナビノイド受容体2/cannabinoid receptor 2(CB2)という受容体が存在し、CB2が活性化されると炎症に対抗する応答/抗炎症応答が生じる
NTRX-07はCB2受容体を標的とするアゴニストであり、炎症を抑制して脳組織へのダメージを防ぐ
加えて、異常なアミロイドプラークの除去を改善し、記憶能力memory performanceや他の認知機能cognitive skillsを改善する
さらに、NTRX-07はSOX2というタンパク質のレベルを増大させる
SOX2は新たな脳細胞の発生を助け、アルツハイマー病患者の脳を保護することがこれまでに示されている
NTRX-07を投与したマウスはSOX2のレベルが正常レベルまで回復した一方で、プラセボを投与したマウスはSOX2レベルの低下を示し、
脳内の炎症が活性化し、アミロイドプラークの除去が悪化して、記憶能力は低下した
<コメント>
元の記事ではNTRX-07とNRTX-07が混在してますが、開発元のサイトを見るとNTRX-07の方が正しいようです
サイトにはNTRX-07が以前はMDA7と呼ばれていたとあります
関連記事
http://fface.exblog.jp/21526492/
Aβによる神経炎症はニューロリギン1/Neuroligin-1(NLGN1)をエピジェネティックに抑制してシナプスネットワークを破綻させるが、この神経炎症プロセスは新規に発見されたMDA7という化合物によって阻止された
クリーブランド・クリニックでは近い将来フェーズI試験を開始する予定である
関連記事
https://alzheimersnewstoday.com/2016/09/28/alzheimers-drug-targeting-cannabinoid-receptor-given-almost-2-million-to-move-to-clinical-testing/
NeuroTherapiaは既に治験薬/investigational new drug(IND)の申請を可能にするための研究を始めており、2017年半ばにはNTRX-07のヒトでの臨床試験を開始することを目標としている
関連サイト
https://bsd.neuroinf.jp/wiki/%E3%83%8B%E3%83%A5%E3%83%BC%E3%83%AD%E3%83%AA%E3%82%AE%E3%83%B3
ニューロリギンはシナプス後部に存在する1回膜貫通型タンパク質であり、シナプス前末端に存在するニューレキシン(Neurexin: NRXN)の内因性リガンドであり、シナプスの成熟や機能を調整している

関連サイト
http://www.pharm.or.jp/dictionary/wiki.cgi?%E3%82%AB%E3%83%B3%E3%83%8A%E3%83%93%E3%83%8E%E3%82%A4%E3%83%89
カンナビノイド受容体として、7回膜貫通、Gタンパク質(Gi/Go)共役型のCB1受容体とCB2受容体の2つがある。
CB1受容体は脳などで多量に発現しており、神経伝達の抑制的制御に関与していると考えられている。
CB2受容体は脾臓や扁桃腺など、免疫系の臓器や細胞に多く発現しており、炎症反応や免疫応答の調節に関与していると考えられている。
関連記事
http://blog.goo.ne.jp/news-t/e/c5430d8634bdca32080281683490f6fd
α細胞によって作られたカンナビノイドは膵島に局在するCB1というカンナビノイド受容体を活性化し、細胞機能の分化に影響を与えることでβ細胞がグルコースに応じてインスリンを作る能力を増大させる
関連記事
http://blog.goo.ne.jp/news-t/e/44dd380eae54a796f94b7b5fb5d93849
Aβオリゴマーは補体分子のC1qとC3を活性化し、C3はミクログリアの受容体CR3を通じてシグナルを伝達して、ミクログリアが脆弱なシナプスを飲み込むように刺激する























