北海道大電子科学研究所の永井健治教授らの研究グループは、強い酸性やアルカリ性の中でも高い発光能力を持ち、退色しにくい群青色の「蛍光たんぱく質」の開発に成功した。
青色系の蛍光たんぱく質の開発は世界で2例目。6日付の米科学誌「ネイチャー・メソッズ」電子版に掲載された。
蛍光たんぱく質は、薬剤の体内での働きを確認する目印などに用いられている。ノーベル化学賞を受賞した下村脩博士が発見した緑色系や、赤色系が大半で、青色系はこれまで1種類しかなかった。
研究グループは、緑色蛍光たんぱく質を構成するアミノ酸の一種トリプトファンの一部を、別のアミノ酸フェニルアラニンに置き換えたところ、群青色の蛍光たんぱく質ができたという。酸性、アルカリ性の程度を問わずに発光能力が高く、従来の青色系に比べ、退色する割合が約60分の1だった。
永井教授は「酸に強い特性を生かし、胃の中などのたんぱく質の動きを直接観察したり、蛍光発色の繊維の開発への応用が考えられる」と話している。
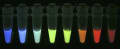
(画像:北大の永井教授らが開発した群青色の蛍光たんぱく質(左端)。
左から4番目が下村脩博士が発見した緑色蛍光たんぱく質)
[読売新聞 2009年04月07日]
http://www.yomiuri.co.jp/science/news/20090407-OYT1T00067.htm
青色系の蛍光たんぱく質の開発は世界で2例目。6日付の米科学誌「ネイチャー・メソッズ」電子版に掲載された。
蛍光たんぱく質は、薬剤の体内での働きを確認する目印などに用いられている。ノーベル化学賞を受賞した下村脩博士が発見した緑色系や、赤色系が大半で、青色系はこれまで1種類しかなかった。
研究グループは、緑色蛍光たんぱく質を構成するアミノ酸の一種トリプトファンの一部を、別のアミノ酸フェニルアラニンに置き換えたところ、群青色の蛍光たんぱく質ができたという。酸性、アルカリ性の程度を問わずに発光能力が高く、従来の青色系に比べ、退色する割合が約60分の1だった。
永井教授は「酸に強い特性を生かし、胃の中などのたんぱく質の動きを直接観察したり、蛍光発色の繊維の開発への応用が考えられる」と話している。
(画像:北大の永井教授らが開発した群青色の蛍光たんぱく質(左端)。
左から4番目が下村脩博士が発見した緑色蛍光たんぱく質)
[読売新聞 2009年04月07日]
http://www.yomiuri.co.jp/science/news/20090407-OYT1T00067.htm