リボヌクレオチドレダクターゼ(RNR)内のチロシルラジカル生成消滅過程(改訂版)
ラジカル研究はドグマ(独断、教条)との闘いの歴史である。tyrosine というありきたりのアミノ酸がまさか室温でもラジカルになっているとは想像もつかなかった。しかし、
(a) 蛋白B2精製段階で410 nm のピークの強度はますます増強された(下記Fig.5参照):
(b) 410 and 360 nm のピークは鉄元素除去と共に消失し、鉄原子の再活性化と共に、再現された:
(c) 410 nm のピークは蛋白B2を特異的に壊すヒドロキシウレアやヒドロキシアミンで消去した。
生成したラジカルが鉄の二核錯体と相互作用してクラスターを形成し、安定化しているらしい。
それまでの研究の経緯はBrownによる下記論文のDiscussionに詳しく語られており、ラジカル研究のドグマとの闘いの典型例であるので、ここにあえて原文のまま抜書きする:
European J. Biochem. 9 (1969) 512-618
Spectrum and Iron Content of Protein B2 from Ribonucleoside Diphosphate Reductase
N. C. BROWN, R . ELUSSON, P . REICHARD, and L. BELANDER
Kemiska Institutionen 11, Karolinska Institutet, Stockholm
(Received April 1, 1969)

DISCUSSION
Our results clearly indicate that protein B2 contains iron and that the presence of this metal is essential for the function of the protein as a component of ribonucleoside diphosphate reductase. One molecule of pure protein B2 contains two atoms of iron, which can be released by cold acid treatment; this finding indicates that the metal is bound in an inorganic or non-heme form. Unpublished experiments indicate that each molecule of protein B2 consists of two polypeptide chains of equal size; it seems reasonable to assume that each iron atom is bound to one polypeptide chain. It is not known how the iron is linked to protein B2. Several well characterized non-heme iron proteins such as the ferredoxins contain “inorganic sulphide” which participates in the iron-protein interaction. Protein B2 does not contain any such sulphide. The metal is bound quite tightly and is not removed during the extensive purification procedure. On the other hand, more drastic treatments result in partial removal. For example, preparative gel electrophoresis of the protein under the conditions given by Ornstein and Davis which involve pH values of above 9.5 resulted in considerable loss of iron. Similarly, treatment with ammonium sulphate at acid pH values removed part of the metal. Aside from treatment at extreme pH values, prolonged dialysis against chelating agents, such as 8-hydroxyquinoline, removed the metal. Removal of iron resulted in loss of enzyme activity.It is probably significant that a relatively minor loss of iron was parallelled by a disproportionally large loss of enzyme activity. This finding might be interpreted by assuming that the loss of one of the two iron atoms is sufficient for enzyme inactivation. However, other, more complicated explanations cannot be excluded. Extensive treatment with 8-hydroxyquinoline and other chelating agents such as EDTA often resulted in an apparently irreversible precipitation of the protein. As a result we have not succeeded in obtaining protein B2 completely devoid of iron. Our best preparations of “apoprotein” never contained less than 15 to 20% of the original iron content. The “apoprotein” preparations could be reactivated completely with iron, but not with any other metals tested. The latter experiments were not extensive, however. Both Fe2+ and Fe3+ could be used for reactivation and at the present time we know nothing about the state of valency of iron in the protein, Protein B2 could be labelled specifically by reactivating a metal-deficient “apoprotein” with radioactive iron. The radioactive protein has been used to study the interaction with protein B1, the second subunit of ribonucleoside diphosphate reductase. In these studies and in other reactivation experiments, the non-specific attachment of iron to the “apoprotein“ caused special problems. Since this type of binding is more pronounced with trivalent iron it could be minimized by adding iron to the apoprotein in the presence of an excess of sodium ascorbate. (We wish to thank Dr. R. Malkin, Dept. of Biochemistry, University of Gothenburg, for suggesting this procedure.) This precaution ensured the reduction of all Fe3+ to Fe2+. When 69Fe-labelled protein B2 was made on the preparative scale for use in binding experiments, we purified the product further to exclude all non-specifically bound iron. For this purpose it was convenient to introduce 59Fe into a fairly impure preparation of protein B2 and to remove extraneous iron by further purification of the labelled protein, either by DEAE-cellulose chromatography or by preparative gel electrophoresis. Fig.5 demonstrates the use of the former method in a typical experiment. The iron content of protein B2 is closely connected with the highly characteristic spectrum of this subunit shown in Fig. 5. We are not aware of any other protein with a similar very sharp peak at 410nm. When we first observed. this peak in preparations of protein B2 we suspected that it arose from contamination by a hemoprotein with a characteristic Soretband. However, we excluded this possibility and established that the spectrum is a characteristic property of protein B2 from the following observations:
(a) during purification of protein B2 the characteristic spectrum intensified ;
(b) the peaks at both 410 and 360 nm disappeared on removal of iron and reappeared on reactivation with the metal, and
(c) the peak at 410 nm disappeared on treatment with hydroxyurea or hydroxylamine which specifically destroy the activity of protein B2.
The details of the spectrum of the final preparation of protein B2, in particular the intensity and sharpness of the peak at 410 nm, depended to some extent on the method of purification. A good measure of the sharpness of the 410 peak is the 410/405 ratio; in some preparations this was as high as 1.18. Both the 410/405 ratio and the intensity of the spectrum above 310 nm were higher when Sephadex G-200 was used as the last purification step rather than gel electrophoresis. This is clear from the experiment shown in Fig.5 in which an identical preparation of protein B2 after the second DEAE step was divided and purified further by the two alternative final purification steps. The reason for this behaviour is not understood. From our results it seems clear that the spectrum of protein B2 depends on the presence of iron. However, only the 360 nm peak gives a direct correlation with the amount of iron present in the protein. The peak at 410 nm disappeared almost completely even when less than half of the metal had been removed. Furthermore, inactivation of the enzyme with hydroxyurea or hydroxylamine resulted in a complete loss of the peak at 410 nm (but not at 360 nm) but did not remove any iron from the protein. These results suggest that the peak at 410 nm comes from an unidentified structural component in protein B2, the integrity of which requires the presence of both atoms of iron.
In collaboration with Prof. A. Ehrenberg we have recently found that protein B2 has a characteristic electron-paramagnetic resonance signal with a g-value of 2.0, apparently caused by the presence of a free radical in the isolated enzyme. The signal disappears on treatment with hydroxylamine and shows other features in common with the peak at 410 nm. The question as to the origin of this peak and the electron paramagnetic resonance signal may be connected with the question of iron-bonding in protein B2. It remains a challenging unsolved problem. It is also closely connected with the mechanism of the inactivation of the enzyme by hydroxyurea and hydroxylamine. Earlier experiments [7] had already established that protein B2 of ribonucleotide reductase was the target for the inhibitory effect of these compounds. The function of iron in the enzyme remains at the present time a matter of speculation. The metal does not appear to be required for the intact quaternary structure of the enzyme. On sucrose gradient contrifugation, the “apoprotein” sedimented with a sedimentation coefficient of 5.5 S, similar to the intact protein B2. Besides, the “apoprotein” retained the capacity to form a B1 :B2 complex in the presence of an excess of protein B1. It appears more likely that iron participates in the reduction of the HCOH group of the ribose. Together with the unidentified group of protein B2 the metal may fulfil a function similar to that of cobamide coenzyme in the related ribonucleoside triphosphatereductase from L. leichmnnii [l0-12]. The clarification of the function of the iron requires the identification of the postulated additional prosthetic group.
以上のような経緯で、今から40年も前の1972年、リボフラビンESRの大家、Ehrenberg の登場となった。図3に示すような、典型的ラジカルのESRデータをJBCにEhrenberg が初めて発表したのである:
http://www.jbc.org/content/247/11/3485.full.pdf

図3 RNR内のtyrosyl radicalのESR(A.Ehrenbsrg)。g=2.0047,a(4-)=19 G, a(2,6-)=7 G.
しかし、問題はこれで終わりではなかった!むしろ始まりであった!
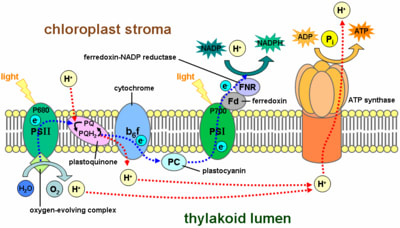
リボヌクレオチドレダクターゼ(RNR)は全ての生物に必須で、DNAの合成および修復において中心的役割を果たす酵素である。Ehrenbergはその酵素の機能にラジカルの生成消滅機構を提唱した。レスベラトロールはこの酵素の機能を阻害する。これは酵素の活性中心にあるチロシルラジカルをレスベラトロールが消去してしまうことによる。即ち、レスベラトロールの抗酸化作用の本体である4’位の水酸基がリボヌクレオチドレダクターゼのチロシルラジカルを還元反応によって消去してしまう為、酵素阻害が起きてDNA複製が阻害され、遺伝毒性を引き起こすのである。

図1 RNR酵素内のチロシルラジカル生成消滅機構(J. Am. Chem. Soc., 2011, 133 (24), pp 9430?9440)。

図2 RNR酵素のチロシルラジカルのENDORスペクトル(J. Am. Chem. Soc., 2012, 134 (42), pp 17661?17670。
要するに、本酵素はβ2(B2) が安定なチロシルラジカル(Y122?)-FeIII2クラスターを有しており、このY122?が35Å以上離れたα2 の活性部位中のシステイン残基(C439-α2)を可逆的に酸化し、生じたチイルラジカルを触媒的に用いてリボヌクレオチド還元反応を触媒する。このような長距離のラジカル移動は金属補因子を経由しないものとしては極めて稀で、芳香族性アミノ酸残基を用いるプロトン共役電子移動 (proton-coupled electrontransfer, PCET) が提唱されている(図2)。このPCET はα2 に基質が結合することで引き起こされるタンパク質のコンフォメーション変化で制御されていると考えられているが、その機構については未解明である。Y122?の還元は一連の反応の第一段階であり、酵素がY122-β2とFeIII2 クラスター間のプロトン移動を通じて、全体の反応を制御している可能性が考えられる。
ここに来てESR、ENDOR、高周波およびマルチESR、およびパルスESRが俄かに活況を呈してきた感がある。因みにGoogleで[tyrosyl radical]を画像で検索してみて下さい。ESRのオンパレードである!
<問合せ先>: ◎ラジカルのことならキーコム。出張測定可!
キーコム(株)
〒170-0005 東京都豊島区南大塚3-40-2
KEYCOM Corp. 3-40-2 Minamiotsuka,Toshima-ku Tokyo 170-0005 Japan
TEL:+81-3-5950-3101, FAX:+81-3-5950-3380
Home Page: http//www.keycom.co.jp/
E-mail: ohya@keycom.co.jp
























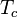 =12Kで、グラファイト構造などが寄与するものと考えられる。
=12Kで、グラファイト構造などが寄与するものと考えられる。
 は触媒特性時間。
は触媒特性時間。