N2Oは、二酸化炭素(CO2)の約300倍強力な温室効果ガス※1で、オゾン層を破壊する最も強力な気体である。土壌や海中に存在する微生物の呼吸により生じるN2Oは人類による窒素系肥料の使用でその排出量が年々増加しており、21世紀の地球環境を議論する上で注目されている。N2Oを産生する微生物は、脱窒※2と呼ばれる呼吸をしており、酸素ではなく硝酸イオンなどの窒素酸化物を使って生きるためのエネルギーを得ている。この脱窒の過程で微生物が持っている「一酸化窒素還元酵素(NOR)」がN2Oを産生している。
SPring-8の研究グループは、大型放射光施設SPring-8※3を用いたX線結晶構造解析により、脱窒細菌が持つ膜タンパク質NORの構造を解明することに成功した。全体構造は細胞膜を貫通する13本のヘリックス(らせん構造)で構成しており、その内部に2つの鉄からなる反応活性中心が存在している。これら鉄原子周辺の詳細な構造から、温室効果ガスN2Oの産生の仕組みを明らかにした。
(引用論文)
"Structural Basis of Biological N2O Generation by Bacterial Nitric Oxide Reductase"
Tomoya Hino, Yushi Matsumoto, Shingo Nagano, Hiroshi Sugimoto, Yoshihiro Fukumori, Takeshi Murata, So Iwata, and Yoshitsugu Shiro
Science 330 (6011), 1666-1670, published online 25 November 2010
PDBID: 3O0R
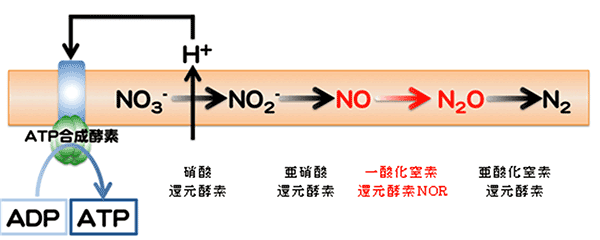
現在の地球上の生物は大部分酸素(O2)を使って呼吸し、生体エネルギーATP(アデノシン三リン酸)を得ている。しかし、地球上に酸素が出現したのは、今から30億年前といわれており、それ以前に生存していた微生物は、酸素の代わりに、窒素や硫黄および水素の酸化物(水)を使って呼吸を行っていた。酸素が出現した後も、土壌に存在する細菌や、人体内に寄生し、さまざまな病気の原因となる細菌は、酸素の無い環境、すなわち嫌気条件でも生きていけるような呼吸の仕組みを保持して生き残っている。これらの細菌は、硝酸イオン(NO3-)や亜硝酸イオン(NO2-)を窒素ガス(N2)まで還元する硝酸呼吸により、ATPを得ている(図1)。
 (クリックで拡大)
(クリックで拡大)
図1 脱窒と硝酸呼吸によるATP生産。脱窒では、窒素酸化物(硝酸イオンNO3-や亜硝酸イオンNO2-)を順次還元し、最終的には窒素ガスN2を発生させる。その途中で一酸化窒素NOと亜酸化窒素N2Oが作り出される。それぞれのステップ(→)は、それぞれ異なる酵素によって触媒される。膜タンパク質である硝酸還元酵素が細胞膜を介した水素イオン濃度勾配を作り出し、そのイオン濃度勾配を利用してATP合成酵素がADPからATPを合成する(硝酸呼吸)。
脱窒は、工業的あるいは生物的窒素固定や落雷によって地表に取り入れられた窒素原子を再び大気へと循環させる唯一の生物過程で、脱窒細菌が地球規模での窒素原子の循環を維持する上で非常に重要な役割を担っている。この脱窒過程の途中で作り出される一酸化窒素(NO)※4は、細胞に対する毒性が非常に強い有毒ガスのため、脱窒細菌は速やかに別の気体である亜酸化窒素(N2O)※5に変換する。この変換を担う酵素が一酸化窒素還元酵素(Nitric Oxide Reductase;NOR)である。NORは、酸素呼吸の重要な酵素であるチトクロム酸化酵素(Cytochrome c Oxidase;COX)※6と共通の祖先を持っている。酸素の出現により、生物が嫌気呼吸から酸素呼吸へと進化して行く過程で、NORはその機能をNO還元(NO→N2O)から、O2還元(O2→H2O)へと変換させて、COXへ分子進化したと考えられている。近年、NORは環境面から非常に注目されている。NOR酵素反応の生成物であるN2O※7が、二酸化炭素CO2の約300倍強力な温室効果ガスで、しかもオゾン層を破壊する21世紀で最も強力な気体であることが明らかとなっている。しかし、人類の産業活動が活発になり、例えば窒素系の人工肥料を多量に使うために、脱窒細菌のNORが作り出すN2Oがどんどん増加している。研究グループは、緑膿菌(Pseudomonas aeruginosa)由来のNORの結晶構造を解明した。NORは、脱窒細菌の細胞膜に埋もれたタンパク質で、一般的にX線結晶構造解析に適した質の良い結晶を得ることが大変難しいとされている。研究グループは、NORの立体構造を解明するために、抗体を使った結晶化法※8を適用し、構造解析に使える良質の結晶を得ることに成功した。取得した結晶について、SPring-8の理研ビームラインを用いたX線結晶構造解析を行い、膜タンパク質である脱窒細菌NORの立体構造を2.7Åの分解能で決定した。
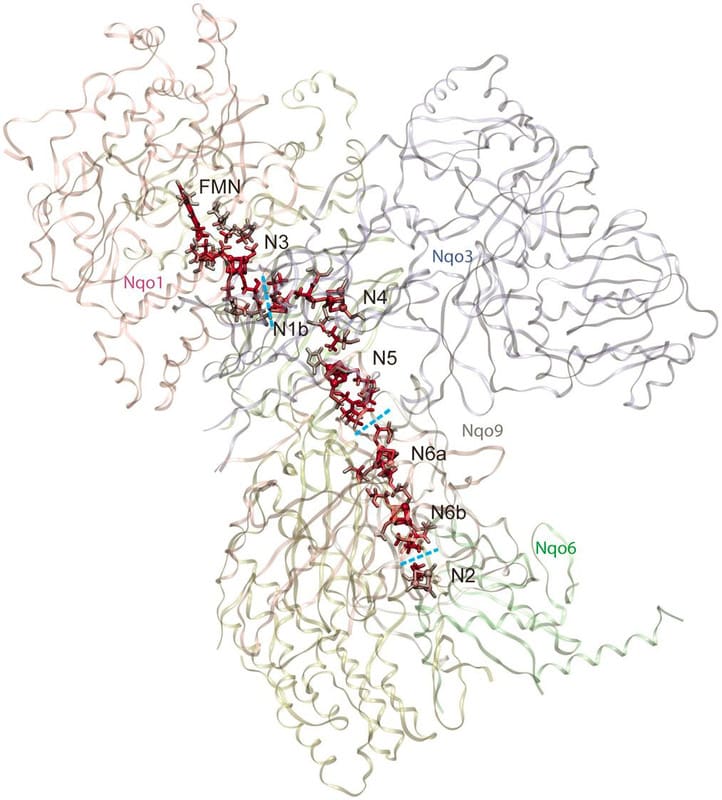
構造解析の結果、NORは13本の膜貫通へリックスと親水性ドメインで構成しており、その全体構造はCOXの主要サブユニットと非常によく似ていた(図2)。
 (クリックで拡大)
(クリックで拡大)
図2 (A)緑膿菌のNORの全体構造と(B)ウシ心筋のCOXの主要サブユニットの構造比較。 膜貫通領域の虹色で示した合計13本のヘリックスの配置はNORとCOXのサブユニットで非常に類似しており、両酵素の祖先が共通のタンパク質であることを構造的に裏付けている。
この結果は、両呼吸酵素が同一の祖先を有しているという今までの予想の構造的な裏付けとなった。しかし、酵素が持っている反応活性中心の構造は、両酵素で異なっていた(図3)。
 (クリックで拡大)
(クリックで拡大)
図3 (A)NORと(B)COXの触媒活性中心の構造。 NORの活性中心には2つの鉄原子(赤とオレンジ色の球)が存在し、ここで一酸化窒素NOは亜酸化窒素N2Oに変換される。NORの片方の鉄(FeB:オレンジ球)がCOXでは銅(CuB:紫球)に置き換わっている。また、これらの金属原子の周りに存在するアミノ酸側鎖の種類や配置も異なっている。この置換により、COXは酸素を還元する反応活性を獲得したといえる。
NORでは、活性中心は1つのヘム分子※9と1つの鉄原子から構成され、COXではこの鉄原子が銅原子となっている。NORには鉄原子を固定するためにグルタミン酸が存在しており、このグルタミン酸はNORによるNO還元(N2O産生)の反応を触媒する上で最も重要である。それに対して、COXの銅原子を固定する役割はヒスチジンとチロシンが担っている。このようなアミノ酸の構造の違いが、NORのNO還元(N2O産生)とCOXのO2還元(H2O産生)の機能の違いとなっている。さらに、これらの酵素反応に使われる水素イオンを供給する道筋もまったく異なっていることが分かった。このように、地球環境の変化に伴って、生物がNOからO2へと呼吸基質を変換していった過程では、全体の構造は変えずに、酵素反応に重要な部位のいくつかのアミノ酸の変異の積み重ねによって分子の構造を変化させる必要があったことが確かとなった。
注) 用語解説
※1 温室効果ガス
地表から放射される赤外線を吸収し、大気温を上昇させる効果を持つガス分子。最もよく知られた温室効果ガスは二酸化炭素(CO2)であるが、CO2の温室効果を1とすると、メタン(CH4)はその21倍、亜酸化窒素(N2O)では実に約300倍の効果を持つ。
※2 脱窒
窒素酸化物(NOx;硝酸イオンと亜硝酸イオン)を窒素ガス(N2)として大気中に変換することやその工程のこと。脱窒反応を行う細菌を脱窒細菌と呼ぶ。
※3 大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。放射光とは、光速に近い速度で加速した電子の進行方向を電磁石で変えたときに発生する、強力な電磁波(X線)のこと。SPring-8の名前はSuper Photon ring-8GeVに由来する。
SPring-8では、この放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われている。
※4 一酸化窒素(NO)
窒素1原子と酸素1原子からなる単純な構造の気体。高い化学反応性を持つフリーラジカルであり、活性酸素と同様、人体には有害なガス分子。NOxの主成分。人体内においてもNO合成酵素により作り出されるが、このNOは細胞情報伝達物質として血管弛緩、血液凝固阻害、記憶・学習、殺菌などさまざまな生理作用に関与している。その一例として、血中の白血球の1つであるマクロファージは、NOを産生して、体内に侵入した細菌やウイルスを殺菌する。
※5 亜酸化窒素(N2O)
吸入すると筋肉が弛緩し、顔が引きつったような表情になることから笑気ガスとも呼ばれ、手術時の麻酔・鎮静、一部の車のエンジンなどにも利用されている。一方でオゾン層破壊作用およびCO2の約300倍の効果を持つ温室効果ガスでもあり、京都議定書で排出規制がかけられた。常温においては反応性の低い安定した気体。
※6 チトクロム酸化酵素(Cytochrome c Oxidase; COX)
酸素呼吸にとって最も重要な酵素。電子、水素イオン、酸素分子を使って水を作り出し、この反応に伴って、アデノシン三リン酸(ATP)合成に必要なエネルギーを生成する。
※7 No laughing matter
2009年8月、アメリカ海洋大気局の研究者らは、亜酸化窒素(N2O)がオゾン層を破壊する最大の要因となっているとする試算に関する論文をScience誌に発表した(Science 326, 123-125, 2009)。この報告を受けてScience誌では、N2Oがlaughing gas(笑気ガス)と呼ばれていることに掛けて「Nitrous Oxide: No Laughing Matter(笑いごとではないよ)」という題名の解説文を掲載した(Science 326, 56-57, 2009)。
※8 抗体を使った結晶化法
結晶がなかなかできないタンパク質に対し、これに特異的に結合する、比較的結晶化しやすいタンパク質である抗体分子を用いることによって目的タンパク質を結晶化しやすくさせる手法。従来は、水溶性タンパク質において行われていた手法だが、1995年、本研究グループの1人岩田想らにより膜タンパク質であるバクテリア由来のチトクロム酸化酵素に適用され、その立体構造解析に初めて成功した。以来、11種類の膜タンパク質の立体構造がこの手法を用いて決定されており、NORが12種類目の成功例となる。
※9 ヘム分子
鉄原子がポルフィリン分子の中心に配位した錯体分子。ヘモグロビンやシトクロムなどタンパク質の補欠分子族として用いられ、電子伝達や酸素分子などのガス分子の結合、化学反応の触媒として機能する。
<問合せ先>: ◎ラジカルのことならキーコム。出張測定可!
キーコム(株)
〒170-0005 東京都豊島区南大塚3-40-2
KEYCOM Corp. 3-40-2 Minamiotsuka,Toshima-ku Tokyo 170-0005 Japan
TEL:+81-3-5950-3101, FAX:+81-3-5950-3380
Home Page: http//www.keycom.co.jp/
E-mail: ohya@keycom.co.jp