"Mechanism of Tyrosine D Oxidation in Photosystem II"
Keisuke Saito, A. William Rutherford, and Hiroshi Ishikita,
PNAS, vol. 110, No. 19, 7690?7695 (2013).
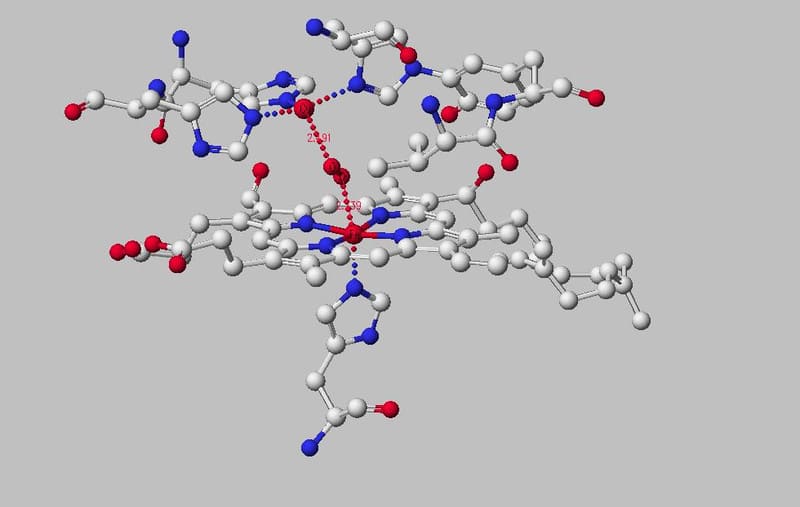
高等植物や藻類は葉緑体にある膜タンパク質PSIIの内部において、太陽光を利用して水を酸素と水素イオンに分解している。その分子機構が未だに不明である。これをとく鍵はPSIIの中にあって光合成を助ける触媒として働く「Mnクラスター」だと考えられてきた。Mnクラスターの分子構造は長年世界中で研究されてきたが、2011年に岡山大学と大阪市立大学の研究グループが解明。これにより、光合成の水分解反応を分子構造に基づいて研究することがようやくできるようになった(Myブログ 06・18・2013 ”いま、Mnクラスターが熱い!”参照)。解明されたMnクラスター周辺の分子構造を見ると、水分子が多数存在していることがわかる。これらの水分子の内、水分解反応に使われる水分子(基質)がどれかを知ることこそが、反応機構を分子レベルで理解するための第1歩である。基質水分子を特定できれば、複数の原子からなるMnクラスターのどの部位で触媒反応が起こるのかがわかり、ひいては反応機構の特定につながる。しかし、分子構造を見ただけでは、どれが基質水分子かはわからないことが問題なのである。
水の分解は
2H2O(水分子×2)→O2(酸素分子)+4H+(プロトン×4)+4e-(電子×4)
式で表され、反応に伴って酸素と共にプロトンが生成される。このプロトンはタンパク質内部のMnクラスター付近で生成された後、タンパク質外部へ移動して排出されるという流れである。もしプロトンの移動経路を特定することができれば、その道筋を逆にたどることで、必ず基質水分子に行き着くことができるのである。よって、水分解機構を明らかにするために達成すべき目標は、プロトンがタンパク質内のどの部位を通って排出されるのか、その経路を特定することである。
図1 PSIIの中心部の模式図とその分子進化。青矢印:プロトンの移動、赤矢印:電子の移動、TyrD:アミノ酸残基TyrD.
PSIIの中心部はD1・D2サブユニットという2つの部品からなる(図1)。D1とD2はどちらもよく似た形をしているが、そっくり同じというわけではない。D1はMnクラスターを持つが、D2は持たないという違いがある。これは、タンパク質の分子進化の過程において、D2も本来はMnクラスターを持っていたと思われ、現在はそれが消失してしまったのだと予想される(図1)。水分解後のプロトン排出はD1におけるMnクラスターの近傍で起こる。しかし、D1のこの領域にはプロトン移動経路の候補となる水分子が多く存在するため、一見しただけでは経路を特定することが不可能である。しかし、D2における対応する領域では水分子が少ないため、プロトン移動経路の解析を行うことが容易であるため、研究グループはD2のこの領域に着目し、プロトン移動のエネルギーを量子化学計算によって解析された。
図2 PSIIの中心部の模式図とその分子進化。青矢印:プロトンの移動、赤矢印:電子の移動、TyrD:アミノ酸残基TyrD。
その結果、図2bの通り、唯一のプロトン移動経路が存在することが見出された。この経路は、D2に存在する、アミノ酸残基からプロトンが放出される時に使用されるもので、複数の水分子とアミノ酸残基が水素結合で強固に結ばれて作られていることも判明した。そして、これらの水分子とアミノ酸残基の上を、プロトンはまるでドミノ倒しのように次々に移動していくこともわかった(図2c)。今回の発見は、D2がかつてD1と同じように行っていた水分解反応の痕跡の可能性がある。重要な要素は進化の過程を経ても失われずに残ることが多いことから、もしそうならば、これと同様なプロトン移動経路がD1にも存在しているはずと推測し、D1において対応する場所を調べたところ、水分子とアミノ酸残基からなる経路の発見に至った(図2a)。D1におけるこの経路が、実際に水分解反応で使われているプロトン移動経路であると考えられる。水分解に伴って排出されるプロトンの移動経路が明らかになったことから、水分解反応がMnクラスターのどこで起こっているのかを特定し易くなったという。これにより今後、水分子の化学結合が開裂する仕組みの解明など、より踏み込んだ反応機構の解明に向けた研究が加速することが考えられる。
<問合せ先>: ◎ラジカルのことならキーコム。出張測定可!
キーコム(株)
〒170-0005 東京都豊島区南大塚3-40-2
KEYCOM Corp. 3-40-2 Minamiotsuka,Toshima-ku Tokyo 170-0005 Japan
TEL:+81-3-5950-3101, FAX:+81-3-5950-3380
Home Page: http//www.keycom.co.jp/
E-mail: ohya@keycom.co.jp