図1 イクオリンはアポイクオリン(白+黄色)、セレンテラジン(Space filling)、および酸素(パーオキシド)からなる複合体である。パーオキシド生成が見えるがCaイオンはEFハンドに配位していない。EFハンドにCaイオンが配位すると炭酸ガスが外れて光る。最近になって、ようやくそのメカニズムの詳細が判ってきた。
イクオリンが発見されてから50年が経つ。今でも営々として研究が続けられている。イクオリンがCa2+と特異的に結合すると青色 (λmax=465nm)の瞬間発光を示し、セレンテラミドと二酸化炭素を生成する。そのさいにGFPが傍にあると緑色に輝く。おわんくらげの発光機構はこれに相当する。イクオリンは微量Ca2+の検出や細胞内カルシウムのイメージングに用いられる。
最近、コントロールが容易な色素としてオベリン(図2)が脚光を浴びている。蛋白の形状はイクオリンと変わらないが、発光特性が異なる.
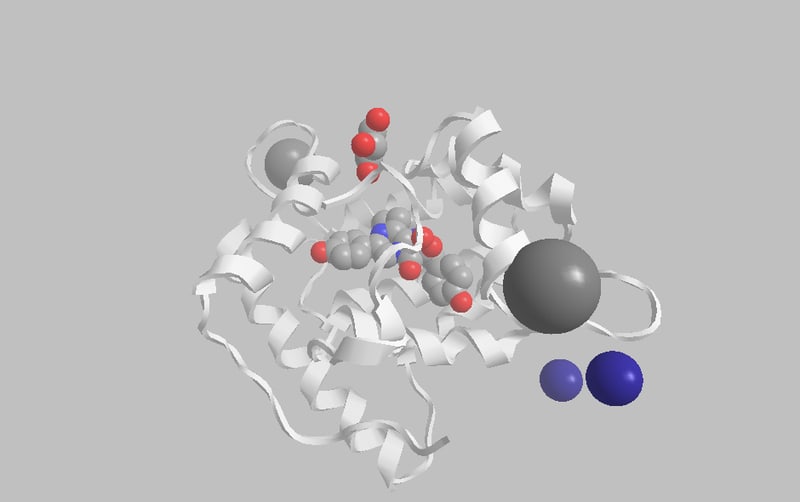
図2 オベリン(Obelin )の結晶構造図(PDBID:1QV1、解像度:1.1A)。2個のCa2+イオン(黒色)がEFハンドに配位している。炭酸ガスも酸素原子2個はまだ基質にある。従って、まだ、この段階ではまだ光らない。3個配位してやっと光る(基質上部にあるグリセロールおよび藍色球形のKイオンはここの議論と関係なし)。
「文献」
"Bioluminescent and spectroscopic properties of His-Trp-Tyr triad mutants of obelin and aequorin."
Photochem Photobiol Sci. 2013 Jun 21;12(6):1016-24.
Eremeeva EV, Markova SV, Frank LA, Visser AJ, van Berkel WJ, Vysotski ES.
Abstract:
Ca(2+)-regulated photoproteins are responsible for the bioluminescence of a
variety of marine organisms, mostly coelenterates. The photoproteins consist of a single polypeptide chain to which an imidazopyrazinone derivative
(2-hydroperoxycoelenterazine) is tightly bound. According to photoprotein spatial structures the side chains of His175, Trp179, and Tyr190 in obelin and His169, Trp173, Tyr184 in aequorin are at distances that allow hydrogen bonding with the peroxide and carbonyl groups of the 2-hydroperoxycoelenterazine ligand. We replaced these amino acids in both photoproteins by residues with different hydrogen bond donor-acceptor capacity. All mutants exhibited luciferase-like bioluminescence activity, hardly present in the wild-type photoproteins, and showed low or no photoprotein activity, except for aeqH169Q (24% of wild-type activity), obeW179Y (23%), obeW179F (67%), obeY190F (14%), and aeqY184F (22%). The results clearly support the supposition made from photoprotein spatial structures that the hydrogen bond network formed by His-Trp-Tyr triad participates in stabilizing the 2-hydroperoxy adduct of coelenterazine. These residues are also essential for the positioning of the2-hydroperoxycoelenterazine intermediate, light emitting reaction, and for the formation of active photoprotein. In addition, we demonstrate that although the positions of His-Trp-Tyr residues in aequorin and obelin spatial structures are almost identical the substitution effects might be noticeably different.