

彦根藩二代当主である井伊直孝公をお寺の門前で手招き雷雨から救っ
たと伝えられる招き猫と、井伊軍団のシンボルとも言える赤備え(戦
国時代の軍団編成の一種、あらゆる武具を朱りにした部隊編成のこと
)と兜(かぶと)を合体させて生まれたキャラクタ-。
【今日は何の日:8月17日】 宗安寺にて施餓鬼供養
❏ 新星マルチメディア革命時代
理化学研究所や産業総合研究所などの研究成果を俯瞰するだけで技術
成長の爆発を感じてしまう昨今。この猛暑と合まって疲労感に包まれ
る。余りにも順当すぎて恐ろしい。


たと伝えられる招き猫と、井伊軍団のシンボルとも言える赤備え(戦
国時代の軍団編成の一種、あらゆる武具を朱りにした部隊編成のこと
)と兜(かぶと)を合体させて生まれたキャラクタ-。
【今日は何の日:8月17日】 宗安寺にて施餓鬼供養
❏ 新星マルチメディア革命時代
理化学研究所や産業総合研究所などの研究成果を俯瞰するだけで技術
成長の爆発を感じてしまう昨今。この猛暑と合まって疲労感に包まれ
る。余りにも順当すぎて恐ろしい。




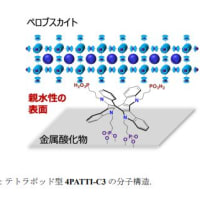
シリーズ:ナノフッ素樹脂
❏ フッ素系オリゴアミドナノリングによる超純水 ⑥
Ultrafast water permeation through nanochannels with a densely fluorous inte-
rior surface.
DOI番号:10.1126/science.abd0966
rior surface.
DOI番号:10.1126/science.abd0966
Supplementary Materials ☈
1.6. 水の浸透に関するストップトフロー蛍光研究の方法
ストップトフロー測定は、励起波長 492 nm のストップトフロー装置
(DPPC) を 25 °C で使用して実施しました。蛍光減衰曲線は、ナノ
リングが埋め込まれた DPPC ベシクルと等量の高張緩衝液 ([HEPES] =
10 mM、[NaCl] = 500 mM、pH = 5.8) を混合して得られた。
(中略)
後者の値は、25℃でのDPPCリン脂質二重膜では無視できるほど小さい
ことが報告されている。Mは、単位面積あたりの小胞内のチャネル数で
ある。小胞内のチャネル数は、以下の方法を使用して計算。まず、脂
質分子の断面積と、DLS測定に基づく小胞の直径から得られた小胞表
面積を考慮し、1つの小胞内の脂質分子の平均数を計算(38、39)。
次に、脂質中のナノリングの供給%モル分率χfeedを使用して、1つの
小胞内のナノリングの数を計算し、3.1で説明した方法で補正して実
際のχ値を得た。チャネルあたりのナノリングの数は、DFT(密度汎
関数理論)最適化されたナノリングのスタッキング距離(図S28〜S31)
とDPPC小胞の膜の厚さ(3.7 nm)を使用して推定した。1つの小胞内
のナノリングの数を1つのチャネルに必要な数で割ることで、小胞内
のチャネルの平均数を取得できる。
ストップトフロー測定は、励起波長 492 nm のストップトフロー装置
(DPPC) を 25 °C で使用して実施しました。蛍光減衰曲線は、ナノ
リングが埋め込まれた DPPC ベシクルと等量の高張緩衝液 ([HEPES] =
10 mM、[NaCl] = 500 mM、pH = 5.8) を混合して得られた。
(中略)
後者の値は、25℃でのDPPCリン脂質二重膜では無視できるほど小さい
ことが報告されている。Mは、単位面積あたりの小胞内のチャネル数で
ある。小胞内のチャネル数は、以下の方法を使用して計算。まず、脂
質分子の断面積と、DLS測定に基づく小胞の直径から得られた小胞表
面積を考慮し、1つの小胞内の脂質分子の平均数を計算(38、39)。
次に、脂質中のナノリングの供給%モル分率χfeedを使用して、1つの
小胞内のナノリングの数を計算し、3.1で説明した方法で補正して実
際のχ値を得た。チャネルあたりのナノリングの数は、DFT(密度汎
関数理論)最適化されたナノリングのスタッキング距離(図S28〜S31)
とDPPC小胞の膜の厚さ(3.7 nm)を使用して推定した。1つの小胞内
のナノリングの数を1つのチャネルに必要な数で割ることで、小胞内
のチャネルの平均数を取得できる。
1.7. ストップトフロー光散乱研究の方法
ストップトフロー光散乱測定は、ストップトフロー装置を使用し、25
℃ (DOPC) で入射光 594 nm で実施した。散乱角 90° での光散乱デ
ータは、ナノリングが埋め込まれた DOPC ベシクルと、8-ヒドロキシ
ピレン-1,3,6-トリスルホン酸三ナトリウム塩 (HTPS) ([HEPES] =
10 mM、[HPTS] = 4 mM、pH = 5.8) を含む高張 HEPES 緩衝液の等量
を混合して取得した。光散乱データを 2つの指数関数の合計に当ては
めると、2 つの指数係数 k1 と k2 が得られた。より小さい指数係数
k1 は、ナノリングのない DOPC 小胞を使用して得られた値に近い
ため、チャネルを通した水透過ではなく、小胞のリン脂質二重層を通
した水透過に対応。より大きな指数係数 k2 は、χ とともに変化す
るため、チャネルを通した水透過に対応。チャネルによる浸透水透過
係数 Pf (cm s–1) は、式 (12) を使用し決定した。
ストップトフロー光散乱測定は、ストップトフロー装置を使用し、25
℃ (DOPC) で入射光 594 nm で実施した。散乱角 90° での光散乱デ
ータは、ナノリングが埋め込まれた DOPC ベシクルと、8-ヒドロキシ
ピレン-1,3,6-トリスルホン酸三ナトリウム塩 (HTPS) ([HEPES] =
10 mM、[HPTS] = 4 mM、pH = 5.8) を含む高張 HEPES 緩衝液の等量
を混合して取得した。光散乱データを 2つの指数関数の合計に当ては
めると、2 つの指数係数 k1 と k2 が得られた。より小さい指数係数
k1 は、ナノリングのない DOPC 小胞を使用して得られた値に近い
ため、チャネルを通した水透過ではなく、小胞のリン脂質二重層を通
した水透過に対応。より大きな指数係数 k2 は、χ とともに変化す
るため、チャネルを通した水透過に対応。チャネルによる浸透水透過
係数 Pf (cm s–1) は、式 (12) を使用し決定した。
1.8. CF 透過研究の方法
1.3.1 で説明したプロトコルに従って調製した、CF (0.5 mM) を封入
した F18NR6 包埋 DPPC ベシクル (χ = 0.0064) を使用しました。ス
トップトフロー蛍光測定は、ベシクル分散液と等張緩衝液 ([HEPES]
= 10 mM、[NaCl] = 100 mM) を急速に混合して行いました。
1.3.1 で説明したプロトコルに従って調製した、CF (0.5 mM) を封入
した F18NR6 包埋 DPPC ベシクル (χ = 0.0064) を使用しました。ス
トップトフロー蛍光測定は、ベシクル分散液と等張緩衝液 ([HEPES]
= 10 mM、[NaCl] = 100 mM) を急速に混合して行いました。
(中略)
1.9. 水輸送時の Cl– 透過研究の方法
1.3.1 で説明したプロトコルに従って、ルシゲニン (2 mM) と HEPES
緩衝液 ([HEPES] = 10 mM、[NaNO3] = 100 mM) を封入した F18NR6
包埋 DPPC ベシクル (χ = 0.0064) を調製しました。ストップトフ
ロー蛍光測定は、小胞分散液と高張緩衝液([HEPES] = 10 mM、[NaN
O3] = 100 mM、[NaCl] = 400 mM)を急速に混合して行った。
1.10. ルシゲニン浸透試験の方法
ルシゲニン(2 mM)とHEPES緩衝液([HEPES] = 10 mM、[NaNO3] = 100
mM)を封入したF18NR6包埋DPPC小胞(χ = 0.0064)を、1.3.1で説明
したプロトコルに従って調製した。ストップトフロー蛍光測定は、小
胞分散液と等張緩衝液([HEPES] = 10 mM、[NaNO3] = 100 mM)を急
速に混合して行った。
1.11. HPTS 浸透研究の方法
HPTS (16 mM) を封入した F18NR6 包埋 DOPC ベシクル (χ = 0.0055)
を、1.3.2 で説明したプロトコルに従って調製。ストップトフロー蛍
光測定は、励起波長 450 nm でベシクル分散液と等張緩衝液 ([HEPES]
= 10 mM、[NaCl] = 100 mM) を急速に混合して行った。
HPTS (16 mM) を封入した F18NR6 包埋 DOPC ベシクル (χ = 0.0055)
を、1.3.2 で説明したプロトコルに従って調製。ストップトフロー蛍
光測定は、励起波長 450 nm でベシクル分散液と等張緩衝液 ([HEPES]
= 10 mM、[NaCl] = 100 mM) を急速に混合して行った。
(中略)
1.12. 膜流動性研究の方法(ラウルダンアッセイ)
DPPCおよびDOPC小胞は、1.4で説明したプロトコルに従って調製した。
ラウルダン包埋小胞分散液の蛍光スペクトルは、励起波長350 nmを使
用し取得された。一般化偏光GPは、対応する発光強度から式(40)を
使用して計算。
DPPCおよびDOPC小胞は、1.4で説明したプロトコルに従って調製した。
ラウルダン包埋小胞分散液の蛍光スペクトルは、励起波長350 nmを使
用し取得された。一般化偏光GPは、対応する発光強度から式(40)を
使用して計算。
(中略)
1.13. イオン伝導性研究の方法
平面脂質二重層は、以前に報告された手順 (41–43) を使用して作成
した。n-デカン中の DOPC 溶液 (10 mg/mL) を、トリス緩衝液 ([ト
リス] = 10 mM、[KCl] = 100 mM、pH = 7.0、各 0.30 mL) を含む 2
つのチャンバーに挟まれたオリフィス (d = 150 μm) に適用した。
ナノリングを組み込むため、1.5 で説明したプロトコルで作成した
DOPC 小胞を平面脂質二重層に滴下。チャネル電流をモニターするため
に、F12NR4 を含む二重層に 125、150、および 175 mV の膜電圧を適
用し、F15NR5 を含む二重層に 50、60、75、および 90 mV の膜電圧
を適用。 F18NR6含有二重膜には75、100、125、150 mVの膜電圧を印
加し、F12NR6含有二重膜には50、75、100 mVの膜電圧を印加した。
1.14. PEG存在下での水透過試験方法
PEG(25 mM)を封入したF15NR5包埋DOPC小胞(χ = 0.0044)を1.3.2
で説明したプロトコルに従って調製。ストップトフロー光散乱測定は、
1.7で説明したプロトコルに従って、小胞分散液と高張緩衝液([HEPES]
= 10 mM、[PEG] = 25 mM、[HPTS] = 4 mM)を急速に混合して実施。
測定にはPEG62、PEG400、PEG1000、PEG2000、PEG4000を使用。
平面脂質二重層は、以前に報告された手順 (41–43) を使用して作成
した。n-デカン中の DOPC 溶液 (10 mg/mL) を、トリス緩衝液 ([ト
リス] = 10 mM、[KCl] = 100 mM、pH = 7.0、各 0.30 mL) を含む 2
つのチャンバーに挟まれたオリフィス (d = 150 μm) に適用した。
ナノリングを組み込むため、1.5 で説明したプロトコルで作成した
DOPC 小胞を平面脂質二重層に滴下。チャネル電流をモニターするため
に、F12NR4 を含む二重層に 125、150、および 175 mV の膜電圧を適
用し、F15NR5 を含む二重層に 50、60、75、および 90 mV の膜電圧
を適用。 F18NR6含有二重膜には75、100、125、150 mVの膜電圧を印
加し、F12NR6含有二重膜には50、75、100 mVの膜電圧を印加した。
1.14. PEG存在下での水透過試験方法
PEG(25 mM)を封入したF15NR5包埋DOPC小胞(χ = 0.0044)を1.3.2
で説明したプロトコルに従って調製。ストップトフロー光散乱測定は、
1.7で説明したプロトコルに従って、小胞分散液と高張緩衝液([HEPES]
= 10 mM、[PEG] = 25 mM、[HPTS] = 4 mM)を急速に混合して実施。
測定にはPEG62、PEG400、PEG1000、PEG2000、PEG4000を使用。
1.15. 浸透圧調節物質としてショ糖を使用した水透過性研究の方法
ナノリングを包埋した DPPC ベシクルは、1.3.1 で説明したプロトコ
ルに従って調製。ストップトフロー測定は、1.6 で説明したプロトコ
ルに従って、ベシクル分散液と高張緩衝液 ([HEPES] = 10 mM、[NaCl]
= 100 mM、[ショ糖] = 800 mM) を急速に混合して実施。
1.16. ショ糖透過性研究の方法
1.3.1 で説明したプロトコルに基づいて、SEC に通す前に HEPES 緩
衝液 ([HEPES] = 10 mM、[NaCl] = 500 mM) を使用して 1 mL の
F18NR6 包埋 DPPC ベシクル (χ = 0.0055) 分散液を調製した。こ
の分散液に、1 mL のスクロース含有 HEPES 緩衝液 ([スクロース]
= 800 mM、[HEPES] = 10 mM、[NaCl] = 100 mM) を加え、よく混合し
た (実験番号 1、図 S47A)。30 秒または 24 時間のインキュベーシ
ョン後、0.9 ml の分散液を、溶出液として HEPES 緩衝液 ([HEPES]
= 10 mM、[NaCl] = 500 mM) を使用して Sephadex (G-25) SEC カラ
ムに通し、小胞の外側に残っているスクロースを除去しました。SEC
の所要時間は合計 5 分でした。 SEC後の分散液100μlにTriton X-100
(20%水溶液)10μlを加えて小胞を溶解し、存在するショ糖の量を
ESUC-100ショ糖アッセイキット(BioAssay Systems)で定量した。
対照実験として、同じ実験を行ったが、HEPES緩衝液([HEPES] = 10 m
M、[NaCl] = 500 mM)を使用してチャネル非埋め込み型DPPC小胞を調
製し、ショ糖を含むHEPES緩衝液([ショ糖] = 800 mM、[HEPES] = 10
mM、[NaCl] = 100 mM)1mLと混合した(実験番号2、図S47A)。この
ショ糖感知法の妥当性を確認するために、ショ糖を含む HEPES 緩衝
液 ([ショ糖] = 400 mM、[HEPES] = 10 mM、[NaCl] = 300 mM) を使
用して、F18NR6 包埋 DPPC 小胞 (χ = 0.0055) 分散液 1 ml を調
製し、同じショ糖を含む HEPES 緩衝液 1 ml と混合しました (実験
番号 0、図 S47A)。F18NR6 包埋 DPPC 小胞内に封入されたショ糖の
量は、上記の手順を使用して、30 秒および 24 時間の S14 インキュ
ベーション後に定量された。
1.17. Cl– 透過性の測定方法
Cl– 透過性は、以前に報告された手順 (27) に基づいて測定した。ル
シゲニン (1 mM) を封入したナノリング埋め込み DPPC ベシクルは、
1.3.1 で説明したプロトコルに従って調製しました。ストップトフロ
ー測定は、ストップトフロー装置を使用して 25 ℃で励起波長 455 nm
で実施し、蛍光強度を 505 nm でトレースしました。ナノリング埋め
込み DPPC ベシクルと等量の塩化物イオン含有緩衝液 ([HEPES] = 10
mM、[KNO3] = (100–X) mM、[KCl] = X mM、X = 0、20、40、60、80、
100) を混合して蛍光減衰曲線を得ました。 Cl– jCl の小胞膜モルフ
ラックス (mol s–1 m–2) は、次の式を使用して計算した:
95- = ("⁄:) ![Cl–]⁄!$ |782 = [– "⁄(: × @9: × A2)] !A⁄!$ |782
(6)
ここで、V と S は、それぞれ DLS 測定から得られた小胞の表面積と
体積を表す。[Cl–] は、小胞内の Cl– のモル濃度。KSV は、3.7 で
説明した別の一連の実験によって決定、小胞内のルシゲニン色素の
Stern-Volmer 定数 (135 M–1) 。 F0 は t = 0 での蛍光強度。膜の
Cl– 透過係数 BCl (cm s–1) は、Cl– 濃度勾配の関数としての JCl
プロットの傾きから次の式を使用して得られた (図 S48)。
B5- = !95-⁄![Cl–] (7)
※文中の公式(数式)は省略。
2. 合成と特性評価
2.1. 1の合成

ナノリングを包埋した DPPC ベシクルは、1.3.1 で説明したプロトコ
ルに従って調製。ストップトフロー測定は、1.6 で説明したプロトコ
ルに従って、ベシクル分散液と高張緩衝液 ([HEPES] = 10 mM、[NaCl]
= 100 mM、[ショ糖] = 800 mM) を急速に混合して実施。
1.16. ショ糖透過性研究の方法
1.3.1 で説明したプロトコルに基づいて、SEC に通す前に HEPES 緩
衝液 ([HEPES] = 10 mM、[NaCl] = 500 mM) を使用して 1 mL の
F18NR6 包埋 DPPC ベシクル (χ = 0.0055) 分散液を調製した。こ
の分散液に、1 mL のスクロース含有 HEPES 緩衝液 ([スクロース]
= 800 mM、[HEPES] = 10 mM、[NaCl] = 100 mM) を加え、よく混合し
た (実験番号 1、図 S47A)。30 秒または 24 時間のインキュベーシ
ョン後、0.9 ml の分散液を、溶出液として HEPES 緩衝液 ([HEPES]
= 10 mM、[NaCl] = 500 mM) を使用して Sephadex (G-25) SEC カラ
ムに通し、小胞の外側に残っているスクロースを除去しました。SEC
の所要時間は合計 5 分でした。 SEC後の分散液100μlにTriton X-100
(20%水溶液)10μlを加えて小胞を溶解し、存在するショ糖の量を
ESUC-100ショ糖アッセイキット(BioAssay Systems)で定量した。
対照実験として、同じ実験を行ったが、HEPES緩衝液([HEPES] = 10 m
M、[NaCl] = 500 mM)を使用してチャネル非埋め込み型DPPC小胞を調
製し、ショ糖を含むHEPES緩衝液([ショ糖] = 800 mM、[HEPES] = 10
mM、[NaCl] = 100 mM)1mLと混合した(実験番号2、図S47A)。この
ショ糖感知法の妥当性を確認するために、ショ糖を含む HEPES 緩衝
液 ([ショ糖] = 400 mM、[HEPES] = 10 mM、[NaCl] = 300 mM) を使
用して、F18NR6 包埋 DPPC 小胞 (χ = 0.0055) 分散液 1 ml を調
製し、同じショ糖を含む HEPES 緩衝液 1 ml と混合しました (実験
番号 0、図 S47A)。F18NR6 包埋 DPPC 小胞内に封入されたショ糖の
量は、上記の手順を使用して、30 秒および 24 時間の S14 インキュ
ベーション後に定量された。
1.17. Cl– 透過性の測定方法
Cl– 透過性は、以前に報告された手順 (27) に基づいて測定した。ル
シゲニン (1 mM) を封入したナノリング埋め込み DPPC ベシクルは、
1.3.1 で説明したプロトコルに従って調製しました。ストップトフロ
ー測定は、ストップトフロー装置を使用して 25 ℃で励起波長 455 nm
で実施し、蛍光強度を 505 nm でトレースしました。ナノリング埋め
込み DPPC ベシクルと等量の塩化物イオン含有緩衝液 ([HEPES] = 10
mM、[KNO3] = (100–X) mM、[KCl] = X mM、X = 0、20、40、60、80、
100) を混合して蛍光減衰曲線を得ました。 Cl– jCl の小胞膜モルフ
ラックス (mol s–1 m–2) は、次の式を使用して計算した:
95- = ("⁄:) ![Cl–]⁄!$ |782 = [– "⁄(: × @9: × A2)] !A⁄!$ |782
(6)
ここで、V と S は、それぞれ DLS 測定から得られた小胞の表面積と
体積を表す。[Cl–] は、小胞内の Cl– のモル濃度。KSV は、3.7 で
説明した別の一連の実験によって決定、小胞内のルシゲニン色素の
Stern-Volmer 定数 (135 M–1) 。 F0 は t = 0 での蛍光強度。膜の
Cl– 透過係数 BCl (cm s–1) は、Cl– 濃度勾配の関数としての JCl
プロットの傾きから次の式を使用して得られた (図 S48)。
B5- = !95-⁄![Cl–] (7)
※文中の公式(数式)は省略。
2. 合成と特性評価
2.1. 1の合成

この項つづく
【関連情報】 2022.05.13 東京大学:
水を超高速で通すにもかかわらず塩を通さないフッ素ナノチューブを
開発 —次世代超高効率水処理膜の実現に向けて—

























※コメント投稿者のブログIDはブログ作成者のみに通知されます