[歴史]
最初の肺炎球菌ワクチンはSir Almroth Wrightによって1911年に開発された
多糖体ワクチンは1940年代に市場に出たが、抗菌薬の出現により、流通しなかった
耐性菌の出現もあり、14価のPPSVが1977年に米国で承認
1983年に14価から現在の23価に(PPSV23)
ニューモバックス®(23価価肺炎球菌莢膜ポリサッカライドワクチン)は国内で1988 年 3 月 29 日に輸入承認が与えられ、1988 年 11 月 10 日に発売された。
1992 年 8 月 28 日に、「脾摘患者における肺炎球菌(23価価肺炎球菌莢膜ポリサッカライドワクチン)による感染症の発症予防」について健保等一部限定適用が認められている(*)。
生産性向上のため抗原を変更したニューモバックスNP®は製造販売承認年月日:2006 年 10 月 20 日、薬価基準収載年月日:1992 年 08 月 28 日(健保等一部限定適用)、発 売 年 月 日:2006 年 11 月 29 日
*脾臓摘出患者における保険適応については、初回及び再接種の限定はなく、医学的な妥当性をもって判断される者と考えられる。
侵襲性肺炎球菌に対する中等度の効果はあるが、血流感染を伴わない肺炎(NPP)に対する効果は低く、NPPは10倍以上多い
侵襲性肺炎球菌感染は乳児に最も多いが、細胞性免疫を介さないため、免疫原性が低い
一方コンジュゲートワクチンはT細胞を介した免疫原性であるため乳児にも免疫原性が高く、再感染によるブースター効果も期待される
→ 2000年、PCV7が乳児の定期接種化
→ 2010年、PCV7からPCV13へ変更
23価の肺炎球菌成人用ワクチンは肺炎球菌莢膜ポリサッカライド(ニューモバックスNP®)
肺炎球菌中で高頻度にみられる23種類の莢膜型の肺炎球菌を型別に培養・増殖し, 殺菌後に各々の型から抽出、精製した莢膜ポリサッカライドを混合した液剤である
種菌を調製する前段階でウシ由来成分 (ヘミン) を使用し, 製造工程に用いる酵素の製造にウシの乳由来成分 (カザミノ酸) を使用している
接種が推奨されるのは臓器移植患者, 無脾症, 慢性疾患, 高齢者, その他の仕事等により肺炎球菌に対するリスクがある人
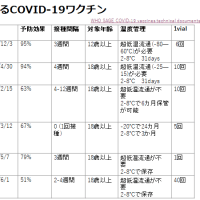
有効期間は1回接種後に約5年
ワクチン接種の3週間後までに免疫が構築されるが, 2歳以下では反応が乏しい
T細胞(細胞性免疫)とは独立して、B細胞を通じて免疫を構築する
胚中心形成ができないため、高い抗体価を長期的に維持したり、記憶反応によりブースター効果を期待したりすることができない
費用対効果
厚生労働省審議会の報告書に記載された試算によると、仮に65歳の方全員が成人用肺炎球菌ワクチンワクチンを接種した場合には、肺炎関連の医療費が削減されることで、保健医療費全体では5115億円の医療費削減効果が期待されている(肺炎球菌ポリサッカライドワクチン 作業チーム報告書)
23価ポリサッカライドワクチン(PPSV23)の追加接種に関して
5年後の2回目の追加接種は、免疫不全がある19-64歳でワクチンを初回接種した人には推奨(3回目は推奨されない)。
65歳での初回接種は全員に推奨されるが、65歳以上での追加接種は推奨なし。
http://www.cdc.gov/mmwr/pdf/wk/mm5934.pdf
日本のガイドラインでは65歳以上での追加接種対象。
http://www.kansensho.or.jp/topics/pdf/pneumococcus_vaccine.pdf
免疫不全者における侵襲性肺炎球疾患リスク(100,000人当たりの罹患者数)
健康な人: 8
脳血管障害:26
糖尿病28
呼吸器疾患:32
腎疾患:41
肝疾患:52
アルコール:59
HIV/AIDS: 173
血液悪性疾患:186
成人の免疫不全者には最初にPCVを接種、8週間以上の間隔をあけてPPSVの接種が推奨される
PPSVの接種間隔は5年以上
既にPPSV接種歴があれば1年以上の間隔をあけてPCVの接種が推奨される、それ以外は上記同様