一部2016年6月、2020年6月に情報更新
黄熱はAedes属またはHaemagogus属、Sabethes属の蚊によって媒介される致死性のウイルス性疾患であり、サハラ砂漠以南や南米に流行を認め、2018年に報告された症例数は2,064例であるが、2013年に抗体検査結果及び疫学調査から推計されたアフリカでの黄熱患者数及び死亡者数はそれぞれ 13 万人、 7.8 万人にものぼるとされる。

概要:
蚊によって媒介されるウイルス性出血熱で肝・腎・心の臓器障害や出血を伴い高い致死率を認める
南アメリカ、サハラ砂漠以南で認められ, これらの地域への渡航者はワクチン接種を必要とする
ウイルス:
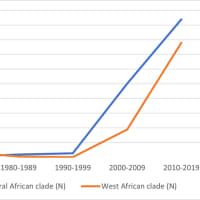
1927年に発見、フラビウイルス(Flavivirus)属, single-stranded RNA virusでserotypeは1つだが遺伝子レベルでは7つのgenotypeに分けられる
疫学:
主に中南米とアフリカに流行地域(47カ国)を認め、8億人が流行地域に住んでいる[Fact sheet in WHO]
年間に推定感染数約180,000例のうち90%はアフリカの症例で、78,000人が死亡している[ProS Med, 2014]
1980年以降、WHOに報告される症例の9割はアフリカからの報告。
アフリカでの感染はヒトへウイルスを媒介するAedes mosquitoの生息地域によって様々であり, 広く認める。公式の報告は流行のある都市で年間5000例程度であるが、実際には100,000例以上の感染があるとされる
http://apps.who.int/immunization_monitoring/en/globalsummary/timeseries/tsincidenceyfe.htm
アフリカでの流行は人工密度が高い場所での蚊による感染が主であり、蚊を介さないヒト-ヒト間での感染は起こらない
一方で, 南アフリカでの流行は蚊も少なく, 猿からヒトへの感染が主であり, さらにワクチン普及率が高いため小規模(年間300例まで)に留まっている
アフリカでも南アフリカでも都市部から離れた奥地で感染が発生し, 診断のための医療資源が限られていることからも, 少数の症例しか報告されていない
アフリカでのアウトブレイクを調査した報告では罹患率は20-40%, 重症化する例が3-5%, 死亡率は20-30%であった
一方で, 南アメリカでの調査では死亡率が50-60%に上り, アフリカと死亡率が異なる原因は不明
死亡症例に関しては下記の報告あり
1996年にブラジルで感染したアメリカ人とスイス人の死亡症例2例 [Clin Infect Dis 1997 Nov;25(5):1143-7.]
1999年にワクチン未接種でベネズエラの熱帯雨林を半年間旅行したアメリカ人の死亡症例1例 [MMWR Morb Mortal Wkly Rep 2000 Apr 14;49(14):303-5.]
1999年にワクチン未接種でコートジボワールを旅行したドイツ人の死亡症例1例 [J Clin Virol. 2005 Aug;33(4):274-80.]
2001年にワクチン未接種でガンビアを旅行したベルギー人の死亡症例1例 [Clin Infect Dis 2002 Nov 15;35(10):e113-6.]
2002年にワクチン未接種でブラジルのリオネグロを旅行したアメリカ人の死亡症例1例 [MMWR Morb Mortal Wkly Rep 2002 Apr 19;51(15):324-5.]
近年では、国際化の進展と海外渡航者数の増加、都市部での黄熱の流行等の影響により、渡航者での発症頻度が増加し、2015年12⽉から2016年10月にかけてアンゴラ共和国及びコンゴ民主共和国で大規模な流行。合計7,334例の確定を含む疑い症例及び498例の死亡例が報告された。アンゴラ共和国からの輸入感染例がケニア共和国(2例)及び中華⼈⺠共和国(11例)で報告された。
南米のブラジルにおいても、これまで流行を認めていなかったリオデジャネイロ及びサンパウロ周辺で流行を認め、2016-2017年には778例の患者と262例の死亡症例を、2017-2018年には1376例の患者と483例の死亡症例が報告されている。
また、4名の死亡を含む10名のブラジルへの海外渡航者の黄熱患者が報告された。
アジア及び太平洋地域に黄熱は存在しないが、都市部において媒介蚊が生息する環境が整っている地域もあるため、輸入感染症により新たな流行の発生や感染が定着による流行地域の拡大等が懸念されている。
ウイルス(感染)のライフサイクル
主にサルの間で日中の蚊による媒介によってサイクルが成立
媒介蚊は木の穴に溜まる水で発生するHaemagogus mosquito(南米), Aedes mosquito(アフリカ)
森の中に入っていくヒトに感染のリスクがありジャングル黄熱(jungle yellow fever)と呼ばれ、感染者は森野中に入る若い男性であることが多く, 南米で主に認める
アフリカではAedes mosquitoによる感染が多く認められ, 雨季にヒトの居住する地域近くのサバンナでウイルスのサイクルが成立する
この場合宿主はヒトもしくはヒト以外のサルどちらでも認め, ヒトが居住する地域で繁殖するAedes aegyptiが主な媒介者となることから都市型黄熱(urban yellow fever)と呼ばれる
病因:
感染したメスの蚊に吸血されることで約1000~100,000のウイルスが体内に入る
おそらく皮膚の樹枝状明細胞内でウイルスが増殖し, リンパを通じてリンパ節, 血流を通じて臓器に広がる
特に肝臓と脾臓は多くのウイルスを血流に放出し, 蚊の吸血から3-6日後にウイルス血症が引き起こされる
黄熱は肝機能障害, 腎機能障害, 凝固異常, ショックを特徴とし, 死亡症例の約80%で肝細胞の凝固壊死を認める
肝葉の中心に特に障害を認め, 同部位にウイルスが限局して存在することからウイルスによる直接の障害が肝機能障害の原因と考えられ, ウイルス量に応じて肝機能障害や脾機能障害も増悪する [J Clin Virol. 2005 Aug;33(4):274-80.]
腎機能障害に関しても同様に好酸球性変性と炎症によらない尿細管上皮の脂肪変性によると考えられる [Am J Trop Med Hyg 1981; 30:431.]
臨床像:
不顕性感染, 黄疸を伴わない非特異的な発熱, 黄疸, 腎機能障害, 出血を伴った致死的な発熱の3つに大別される
どの年齢でも感染しうるが, 高齢者で重症化しやすい
蚊の吸血があった3-6日後に突然の発熱で発症
感染期:
全身の倦怠感, 頭痛, 光線過敏, 仙腰痛, 下肢関節痛, 筋肉痛, 食欲不振, 嘔気, 嘔吐, 不隠, 易刺激性, 眩暈等の非特異的な症状を呈し, 発症後3-4日間続く
別の疾患との鑑別は困難
身体所見上は紅潮した皮膚, 結膜の充血, 心窩部痛, 肝腫大と圧痛等を認めることあり
舌は特徴的に先と辺縁が紅くなり, 中心が白色に被覆される
比較的徐脈を認める(Fagets’s sign)
発症から急に起きる好中球減少を伴う白血球の低下(1500 to 2500 per microL)
発症から48-72時間後には黄疸に先行してtransaminasesの上昇を認め, 異常の程度は肝機能障害の重症度と相関すると考えられる
緩解期:
感染期の後に発熱や症状の改善を認める
多くの感染者はそのまま状態が改善するが, 約15%の感染者で第3期であるintoxication期に移行する
intoxication期:
発症から6日目以降に再発熱, 虚弱, 嘔気, 嘔吐, 心窩部痛, 黄疸, 乏尿, 出血素因を認める
ウイルス血症は終息し, 血中に抗体価を認める
肝臓, 腎臓, 心臓等の様々な多臓器不全を特徴とする
肝不全:
ウイルスによる心筋, 骨格筋障害と考えられるASTの優位の肝機能障害(他のウイルス性肝障害との鑑別)を認める
重症度に比例して上昇を認め, 死亡症例ではAST 2766U, ALT 660Uであったのに対し, 生存症例ではAST929U, ALT351Uであったとの報告あり [Bull World Health Organ 1970; 42:95.]
ALPは正常~軽度の上昇に留まり, 直接ビリルビンは典型的には5~10mg/dL程度であり, 死亡症例でより高値となる
腎不全:
乏尿, 高尿素血症, 高度の蛋白血症等の腎障害
血清Cr値は正常値の3~8倍まで上昇し, 生存症例では腎機能障害が肝機能障害より有意であることがある
完全な無尿は死亡の原因となる
出血:
第3期にコーヒー残渣様の吐血, 性器出血, 血尿, 子宮出血, 点状出血, 斑状出血, 鼻出血, 歯肉出血, 針刺入部からの出血等を認める
消化管出血は循環動態を破綻させる原因となる
血小板減少, PT延長, 肝機能障害による凝固因子減少を認め, DICの病態をとる場合もある
心筋障害:
心筋障害の臨床的意義はあまり分かっていないが, 臨床経験からは黄熱罹患中に急性心拡大が報告されている
ECGでは伝道障害を伴わない洞性徐脈, ST-T異常, T波上昇, 期外収縮を認める
徐脈と心筋炎は代謝性アシドーシスや循環血流量減少による低血圧と関連があると考えられる
不整脈の報告は第3期回復期の死亡症例の原因となっているかもしれない
中枢神経障害:
錯乱, 興奮, 痙攣, 昏迷, 昏睡等の症状を認める
重症例では頭蓋内圧が亢進し, CSFに蛋白を認めるが細胞数の上昇は認めない
炎症性変化のないウイルス性の脳炎は微小血管周囲の出血や浮腫等を原因とした代謝性脳障害によることが大半であり, 黄熱ウイルスそのもの脳炎は極めて稀である
結果:
発症から2週間で回復するか死亡するかの結果は出て, 第3病期に移行した患者の20-30%が死亡する
死亡前には無尿, ショック, 低体温, 興奮, 難治性の吃逆, 痙攣, 低血糖, 高カリウム血症, 代謝性アシドーシス, Cheyne-Stokes呼吸, 昏迷, 意識障害等の症状を呈する
回復期において倦怠感は数週間に渡り持続し, 黄疸や肝機能障害が数ヶ月持続することもある
稀ではあるが回復期の死亡において心筋炎, 不整脈, 心不全によって起こることがある
診断:
鑑別としてデング熱, ワイル病, 回帰熱, ウイルス性肝炎, リフトバレー熱, Q熱, 腸チフス, 重症マラリア等が挙げられ, 臨床診断は難しい
他のウイルス性出血熱であるラッサ熱, マールブルグ熱, エボラ出血熱, ボリビア・アルゼンチン出血熱, クリミアコンゴ出血熱は通常黄疸を呈しない
軽度の症状しか呈さない黄熱は発熱, 頭痛, 倦怠感, 筋肉痛等がその他のアルボウイルス感染やインフルエンザによく似ている
診断はPCRによるウイルスの同定または血清学的にされる
1982年にコートジボワールで起きたアウトブレイクで黄熱と診断された90症例のうち, 27例(30%)で血液からウイルスを同定できたが, 2例を除いて黄疸出現前の黄疸出現前の検体での同定であった [Bull World Health Organ 1985; 63:527.]
病理学的に肝臓標本で中心性の壊死等の特徴的な所見を呈するが, 急性期の肝生検は避けるべき
死亡症例における剖検例において, 肝臓等の臓器からウイルスがPCRや免疫染色で同定されることがある
免疫血清学的な診断(ELISA for IgM)が最も有用
ペア血清で判断されるべきであり, 他のフラビウイルス感染により交差反応を示すことを考慮する必要あり
治療:
基本的に対症療法(栄養管理, 低血糖予防, NGチューブでの吸引, 輸液での低血圧予防, 必要に応じて昇圧剤, 酸素投与, アシドーシスの是正, 輸血, 腎不全に対する透析, 肺炎等の二次性感染症の治療, DICに対する慎重なヘパリン投与)
終末期の多臓器不全は細菌性の敗血症やSIRSに認める高サイトカイン血症と類似しており, 敗血症生ショックの患者にcorticosteroid200-300mg/日を使用して軽快した報告あり [Crit Care Med 2004 Mar;32(3):858-73.]
vaccine-associated viscerotropic disease (YEL-AVD)の患者においても, corticosteroidの使用が病態を改善するかもしれない [The Yellow Fever Vaccine Safety Working Group, unpublished data, 2005]
特異的な抗ウイルス治療はない
暴露後の予防に関して免疫グロブリン治療は有効だが, 発症後の効果は確かではない
リバビリンはin vivoで黄熱ウイルスに対して活性があるが, 臨床的に到達できない高濃度下の状況においてであり, サルを用いた研究では有意な予防効果を認めていない
ハムスターにおいて容量は最適化されていないものの, リバビリンが死亡率を有意に下げたとの報告あり, 感染したヒトへの使用も許容されるかもしれない [Am J Trop Med Hyg 2004 Sep;71(3):306-12.]
ワクチン:
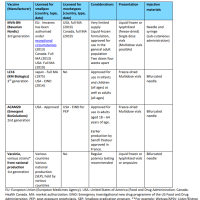
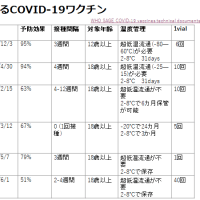
弱毒化生ワクチンである(yellow fever 17D vaccine)は1936年に開発され, 1937年に実用化され(Lancet, 2016)、75年間で6億5000万本以上が使用されている(NEJM, 2016)。
もうひとつのネズミの脳細胞を用いて製造するフランスの向神経性黄熱ワクチン(French neurotropic vaccine)は、天然痘ワクチンと同様にscarificationにより接種するため、短時間に多くの接種を実施できる等の利点が多く1953年までに5600万人が接種したが、神経性の重篤な副作用のため使用されなくなり、1983年に製造が中止された。
全世界で6つの製造販売業者が黄熱ワクチンを製造し、年間5000万本~1億本の生産体制がある。
WHOによって事前承認(Prequalified)されている製造販売業者は、Institut Pasteur (Senegal); Bio-Manguinhos/Fiocruz (Brazil); Chumakov Institut of Poliomyelitis and Viral Encephalitides (Russia); Sanofi Pasteur (France)の4社
国内向けに製造している製造販売業者は、Sanofi Pasteur (United States); Wuhan Institute of Biological Products (China)の2社
日本で使用されている製剤はSanofi-Pasteurによってアメリカで生産されている。
2016年時点で緊急使用用の備蓄ワクチンは約600万本。
ワクチンに必要な最小力価は3(10^3.0 IU)だが、上限は定められていないため1000倍以上(力価6.5)の抗原を含む製剤もある。
ワクチン株は17D株に限られるが、17D-204, 17DD, 17D-213などの亜株に違いがある(遺伝子配列は僅かな違いで、効果に違いはない)。
ワクチンの予防域での抗体産生率は95%以上 [Virology 2001 Nov 25;290(2):309-19.]
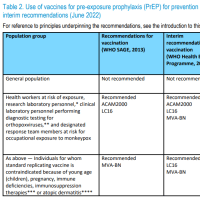
黄熱流行地域であるアフリカや南アメリカへ旅行するヒトに対するワクチン接種が推奨されており, ワクチン接種の証明書がWHOによって定められた国への入国の際に必要となる。
以前のワクチンの供給体制は年間3000万本であったが、2016年には年間8300万本以上に増加し、流行時の緊急接種のために約600万本が備蓄されている(Lancet, 2016)。
国内での黄熱ワクチン接種者数は検疫所関連で約15,000本、検疫衛生協会で約5000本弱
検疫業務年報、検疫衛生協会事業報告書
1951年に世界保健機関(WHO: World Health Organization)が制定した国際衛生規則、現在ではWHO憲章第21条に基づく国際保健規則(IHR〔2005〕: International Health Regulation)に基づき、黄熱が流行する地域への渡航の際には、国や地域ごとに黄熱の予防接種が義務付けられている。
IHRに基づき、政府により指定された黄熱接種医療機関で黄熱ワクチンの予防接種を受けると、接種機関より被接種者に黄熱予防接種の国際証明書が発行され、接種10日後から証明書が有効となる。
予防効果は少なくとも20-35年間持続し、一生予防効果が持続すると考えられている。予防接種証明書(yellow card)の有効期間は10年間であったが(WHO position paper, 2013)、2014年5月の世界保健総会にてIHR 2005のAnnex 7における記載変更が承認され、有効期間が無制限となることとなった。
この有効期間の変更は2016年7月11日以降には全ての国が批准することとなっている[Annex 1 - Period of validity for yellow fever vaccination: certificate for countries requiring yellow fever vaccination - 2016 update]。
また、過去に10年間の期限が記載された証明書を保持している渡航者は、その証明書を継続して使用可能であるとの見解をWHOが示している[Amendment to International Health Regulations (2005), Annex 7 (yellow fever)]。一方で、一部の国ではビザ申請等の手続きに有効な証明書の提示を求めることがあるため、必要に応じて証明書の再発行や再接種の手続きを要することがある。




また、近年では大規模な黄熱の流行を受けて、流行地での疾病コントロールを強化するため、A Global Strategy to Eliminate Yellow Fever Epidemics (EYE)が策定され、定期接種として乳児に黄熱ワクチンが接種されるようになったが、生後9-12月で黄熱ワクチン接種後の抗体持続率(≧0.5IU/mL)に関するガーナでの研究では、2.5年後に27.8%のみ、マリでの研究では4.5年後に50.4%と報告され。接種年齢によっては、再接種の必要性を検討する必要が生じている。
副反応:
4億本以上のワクチンが接種されており, 軽度の発熱, 頭痛, 筋肉痛, 倦怠感, ワクチン接種部位の局所的痛みが報告されている [Am J Trop Med Hyg. 2005 Feb;72(2):189-97.]
副反応は一般に軽度で10-30%に接種日から軽度発熱, 筋肉痛を認め5-10日持続する, 日常生活に支障をきたすような副反応の発現率は1%程度
アレルギー反応は極めて低く, アナフィラキシー反応の発現率は10万人に1.8人程度
重篤な副反応はyellow fever vaccine-associated neurotropic disease (YEL-AND) and yellow fever vaccine-associated viscerotropic disease (YEL-AVD)を含めて稀である
yellow fever vaccine-associated neurotropic disease (YEL-AND):ワクチン接種後3-28日で起こる脳炎等の神経症状を呈する症候群, 確定診断はCSFにおけるウイルスの同定やIgM抗体価の上昇によってなされる
発症は初回免疫後3-28日(平均14日)に頭痛・発熱で発症する
古い文献で黄熱ワクチン接種後の21症例のYEL-ANDが記述され, 1人の症例が死亡して, 残りの症例は合併症を残さずに回復, YEL-ANDで死亡することは稀
古典的には1950年代にワクチンが禁忌となる前に生後9ヵ月以下の乳幼児起こるとされるが, 前年齢で発生しうる
アメリカのVaccine Adverse Reporting System (VAERS)によれば2001年6月~2002年8月までに4例のYEL-ANDが報告されており, 年齢はそれぞれ36, 71, 41, 16歳 [MMWR Morb Mortal Wkly Rep 2002 Nov 8;51(44):989-93.]
全4例が発熱を, 2例が失語を生じ, CSFは前例で特異的YF IgM抗体陽性だが, PCRでのウイルス同定及び培養検査での同定は陰性だった
また欧州でも4例のYEL-ANDが1991年から2003年にかけて報告されており, 2002年タイで53歳男性に起きた症例では接種後にHIV既感染であったことが分かり, 死亡症例となった [J Med Assoc Thai 2002 Jan;85(1):131-4.]
CDCよれば, 米国での推定YEL-AND発症率は100万人に8人であり, 60-69歳では100万人に16人,70歳以上では100万人に23人とされる
脳炎に加えて, 数例でGuillain-Barré症候群やADEM等の自己免疫疾患を呈した症例が報告されている
yellow fever vaccine-associated viscerotropic disease (YEL-AVD):
黄熱17Dワクチン接種した後まもなく, 野生株の黄熱に類似した症状を呈することがあり, これがyellow fever vaccine-associated viscerotropic disease (YEL-AVD)と呼ばれている [Yellow fever vaccine. In Vaccines. 4th Ed. WB Saunders. Philadelphia 2003, pg. 1095.]
この症候群は初めて免疫のないヒトが初めてワクチンを接種する時に起こりやすい
2001年にYEL-AVDが公表されて以来, 世界で40例以上の報告がある [CDC, 2010]
30例のYEL-AVDが報告中17例(57%)が死亡し, 死亡率は南アメリカに置ける野生株の黄熱と同等であり, 臓器の組織学的所見も野生株の黄熱と類似していた[Lancet 2001 Jul 14;358(9276):98-104.]
AVDの症例報告(March 20, 2015 / 64(10);279-281)
2014年9月,以前は健康であった米Oregonの60代の女性が倦怠感,呼吸困難,嘔吐,下痢を呈し救急科を受診。6日前に黄熱ワクチンおよび腸チフスワクチンの単回接種を受けていた。患者は人工呼吸機を要する急性呼吸器不全,心原性ショック,急性腎不全などを呈し,入院3日後に死亡。剖検により,胸腺腫と一致するびまん性の胸腺腫大が認められた。
黄熱ワクチン接種と症状の発現との経時的な関連は黄熱ワクチン関連内臓向性疾患(YEL-AVD)と一致した。黄熱ウイルス特異性抗原の存在が複数の臓器から示され,組織から黄熱17DウイルスRNAが増幅されたことから,黄熱ワクチンとYEL-AVDの因果関係はdefiniteとされた。
本患者のワクチン接種時の年齢と潜在性の胸腺の疾患が,YEL-AVDを発症させる傾向にあった可能性がある。
YEL-AVDに罹患した患者はワクチン接種後の3-5日後に発熱や倦怠感で発症, 黄疸, 乏尿, 循環動態不安定, 出血, 肝の中心層壊死所見を呈し, 多量の黄熱ウイルスが肝臓やその他の感染臓器で同定された
他にも黄熱17Dワクチン使用歴が見過ごされ, YEL-AVDが診断されていない症例もあると考えられる
CDCによれば100万人中の罹患率は4人であり, 60-69歳では100万人に10人,70歳以上では100万人に23人とされる[CDC, 2010]
アメリカでの全体でのYEL-AVD発生率は100万人に2.2人であり, イギリスでも同様の頻度で起こるとされるが, 高齢者では頻度がその10倍程度になるかもしれない [Vaccine 2004 Jun 2;22(17-18):2103-5.]
原因は分かっていないが, アメリカでの旅行者の罹患率が6.1人/100万人であるのに対して, 軍人では0.3人/100万人と低い
発生頻度が低いため原因の評価は困難であるが, YEL-AVDに罹患して死亡した症例から同定されたウイルスに遺伝子変異は証明されておらず, ワクチン接種を受けるヒトの感受性によると考えられている [Virology 2001 Nov 25;290(2):309-19.]
リスク因子として考えられているものとして, 高年齢と胸腺疾患が挙げられる [Trans R Soc Trop Med Hyg. 2007 Oct;101(10):967-71.]
年齢が60-69歳のヒトと70歳以上のヒトは, 若年成人と比較して発症のリスクがそれぞれ4.4倍, 13.4倍になる
また報告された23例のVEL-AVD中, 4例に胸腺腫や重症筋無力症等の胸腺疾患の既往があり胸腺切除術を施行されていた [Lancet 2004; 364:936.]
推奨:
アメリカの渡航者において, YEL-ANDやYEL-AVDに罹患するリスクは2-6人/10万人とされるが高齢者では有意にリスクが上昇する(75歳以上では重篤な副反応が1/4000とも言われる)
一方で, ワクチン未接種者が黄熱流行地域で黄熱に罹患するリスクと死亡するリスクはそれぞれ推定1/1000人/月, 1/5000人/月と高い [Clin Infect Dis. 2002 May 15;34(10):1369-78.]
ACIPでは黄熱罹患のリスクがある生後9ヵ月以上の旅行者に対してワクチンの接種を推奨している [ACIP, 2002. MMWR Recomm Rep 2002; 51(RR17):1.]
黄熱流行国の郊外に渡航する場合は, 公式に黄熱が報告されていない地域の場合も, 高齢者を除いて黄熱ワクチンを接種しておくべき(高齢者は渡航予定と罹患のリスクをよく吟味するべき)
黄熱流行国では入国に際して国際黄熱ワクチン接種証明を要求する場合があり, 黄熱流行地域でない国でも黄熱流行地域からの入国や黄熱流行地域の渡航歴によって国際黄熱ワクチン接種証明が要求される [MMWR Morb Mortal Wkly Rep 2002 Nov 8;51(44):989-93.]
初回接種は0.5mlを1回皮下接種する
黄熱発症予防のための免疫はワクチン接種10日後で90%の接種者が, 4週間後でほぼ100%の接種者が獲得する
予防接種証明書(yellow card)の有効期間は10年間であったが(WHO position paper, 2013)、2014年5月の世界保健総会にてIHR 2005のAnnex 7における記載変更が承認され、有効期間が無制限となることとなった。
この有効期間の変更は2016年7月11日以降には全ての国が批准することとなっている[Annex 1 - Period of validity for yellow fever vaccination: certificate for countries requiring yellow fever vaccination - 2016 update]。
流行時にワクチンが不足する際には、0.1mLの接種で少なくとも12月は有効とされる[Lower doses of yellow fever vaccine could be used in emergencies]。
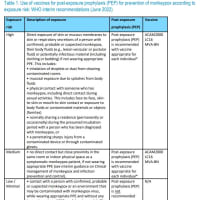
卵白アレルギー:
ワクチンはニワトリ胚細胞ワクチンであり, 卵白にアレルギーが明らかであるヒトへの接種は禁忌となる
原則として卵の摂取ができる場合にはワクチン接種には問題がないと考えられる
卵白に対するアレルギーは0.8-1.8cases/100,000
そのような禁忌者は禁忌証明(waiver letter)を医療者から発行するか, 野生株ウイルスとの暴露の可能性がある等でワクチン接種が必ず必要な場合には, 上皮スクラッチテストや皮内テストが有効であり, 陽性であれば脱感作を行う [J Allergy Clin Immunol 1995; 95:1064.]
スキンテストの適応は、過去に卵白の摂取後に全身のアナフィラキシー反応(全身の蕁麻疹、血圧低下、気道閉塞徴候)が生じた既往がある場合
重篤な卵アレルギーの家族歴があってもワクチン接種の禁忌とはならない
卵に対する軽度または局所的亜アレルギー反応のみの場合は黄熱ワクチンあるいはインフルエンザ接種の禁忌ではなく、ワクチンのスキンテストも必要ではない
[Redbook 2009 p48]
スキンテストや脱感作は経験のあるアレルギーの専門家によって施行されるべき
妊娠:
他の生ワクチン同様に妊婦への黄熱ワクチン接種は禁忌 [2002. MMWR Recomm Rep 2002; 51(RR17):1.]
黄熱のリスクが低い地域では禁忌証明書が受け入れられるかもしれない
妊娠中の黄熱ワクチン接種の安全性は確率していない
先天感染のリスクは低い(1-2%程度)ものの起こり, 胎児奇形と関連していると報告はない [J Infect Dis 1993 Dec;168(6):1520-3.]
授乳婦:
母乳からの経口感染の報告が3例あり
1. ブラジルにおいて生後15日で母がワクチン接種(発症は8日後)[MMWR Vol. 59 / No. 5 February 12, 2010pp.130ー132] http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5905a2.htm
2. ベネズエラにおける生後10日で母がワクチン接種(発症は25日後)[Kuhn S, et al. CMAJ 2011] http://www.ncbi.nlm.nih.gov/pubmed/21324845
3. ブラジルにおける生後10日で母がワクチン接種(発症は24日後)[Yactayo S. Personal communication WHO. Wkly Epidemiol Rec. 85:291, 2010] http://www.who.int/wer/2010/wer8530.pdf
YEL-ANDの報告あり[PHAC, unpublished data, 2008; 123]
授乳婦のワクチン接種も推奨できない
接種後はウイルス血症が生じる期間(3-4d peak, 7-10dまで)は授乳を中止、(3-)4週間が経過すれば再開しても問題が生じる可能性は考えにくい
免疫不全者:
免疫不全者への接種は他のワクチン同様に禁忌
http://www.lilac.cc/~infinity/blog_im/index.php?view-center=Blog::Entry.html&entryID=4e71dc3ab3411
胸腺不全, DiGeorge’s syndrome, 胸腺切除術を施行した場合も禁忌
症状のないHIV罹患者は暴露のリスクが明らかであれば, リスクを説明して接種される場合がある [Clin Infect Dis. 2009 Mar 1;48(5):659-66.]
CD4カウントが200/microL以上である場合は, 全例で免疫が獲得され, 副反応もなかったとする報告あり [AIDS 2004; 18:825.]
他のワクチンとの相互作用
黄熱ワクチンとの干渉作用はコレラの非経口不活化ワクチンとは3週間間隔をあける必要があるが、経口不活化ワクチン(Dukoral®)との問題はなし
[Lancet. 1973 Mar 3;1(7801):457-8.]
ブラジルで1769人の1歳児にMMRと黄熱ワクチンを同時接種した検討で、30日以上の間隔を置いて両ワクチン接種した風疹、黄熱、ムンプスに対する抗体陽転率(それぞれ、97%、87%、71%)に対して、同時接種した場合には抗体陽転率がそれぞれ、90%、70%、61%と低下することが報告されている。麻疹の抗体陽転率の低下は認めなかったが、風疹及び黄熱の幾何平均力価(GMT)は同時接種者で約1/3となっていた(麻疹及びムンプスでのGMT低下は認めなかった)。
[Vaccine. 2011 Aug 26;29(37):6327-34.]
渡航者
渡航地域による
Riskはendemic, transitional, low potential for exposure, no riskの4段階
推奨の国でも流行地域から別の国に移動する場合にはYellow Card が要求されることがあるので注意
標高2300m以上の地域ではリスクはない
(Yellow book 2013)
渡航者の黄熱の罹患リスクは予防接種歴、渡航地域、渡航時季、渡航期間、渡航目的、現地での流行状況等により様々である。
渡航者においては、低い罹患率、高い予防接種率、現地での調査体制の不備などから、発症例の報告がリスクを評価するための重要な指標となる。
地方の西アフリカにおける流行状況は季節により異なり、雨期の終わりから乾期の始め(おおよそ7月から10月)にかけてリスクが上昇する。
ただし、場合によってはAe. aegyptiによる流行が乾期であっても地方や都市部でみられる。
南米における感染のリスクは雨期(1月から5月、特に2月から3月)に高くなる。
感染者におけるウイルス血症時にAe. aegyptiがウイルスを媒介することで、都市部においても大規模な流行が生じるリスクがある。
1970年から2011年にかけて、これまで9例の予防接種歴がない渡航者の黄熱症例が報告されている。
症例は欧米からの渡航者で、西アフリカへの渡航者が5例、南米への渡航者が4例であった。
9例中8例の渡航者は死亡している。
1988年に1例のみ予防接種歴のある渡航者での黄熱発症報告(生存例)があり、スペインから西アフリカへの渡航歴があった。
2週間での流行地域への渡航で非接種者が黄熱を発症するリスクとそれにより死亡するリスクは、西アフリカでそれぞれ10万人に50人と10人、南米でそれぞれ10万人に5人と1人と推計される。
当該製剤を輸入して使用している国は日本とカナダになるが、カナダでは熱帯医学・渡航医学諮問委員会(CATMAT)が承認されている黄熱ワクチンであるYF-VAX(日本で使用されているワクチンと同じ製剤)を0.1mLを皮下注射で使用することを推奨し、承認された用法と異なることから、予防接種証明書を発行せずに免除証明書に部分接種について記載する対応を行った。その結果、免疫陰性者の98%で免疫陽転し、97%で1年後も予防に有効な抗体価が維持されることが報告されている。同製剤の不足は2020年4月の時点でも持続しており、同年9月末まで持続する見込みとなっている。
日本国内における対応としては、2018年4月1日に施行された臨床研究法に基づき、未承認であるStamarilを用いた特定臨床研究を実施することとなった。
当該臨床研究は、日本において現行の黄熱ワクチン(YF-VAX)の代替として黄熱ワクチンStamaril®を用いるにあたり、当該ワクチン接種直後の安全性情報を収集すること、及び当該ワクチンの安全性自発報告情報を収集することを目的として実施された。
参加研究施設は、日常の黄熱接種を実施している国に指定された黄熱接種実施機関とし、国立国際医療研究センターの他、18医療機関が本研究に参加した。
また、PMDAによる医薬品副作用被害救済制度が当該臨床研究には適用されないため、別に同等の研究研究の保険に加入することで副反応に対する補償体制を確保した。
研究実施に当たり、サノフィパスツール社と国立国際医療研究センターとの間で研究の契約を締結し、サノフィパスツール社からワクチンと資金の提供を受けて実施した。
2018年10月24日より研究を開始し、実際の予防接種の実施を11月20日より行った。最終の予防接種の実施は2019年8月19日に行われ、システムに基づく副反応報告の受付を2019年末に終了した。
予防接種を受けた研究参加者は11,287例で、年齢の中央値は34歳(0-85歳)、男性が7,147例(63.4%)であった。有害事象を発現した症例数は696例(6.17%)であり、軽度・中等度・重度の有害事象を発現した症例数はそれぞれ602例(5.34%)、168例(1.49%)、4例(0.04%)であった。重篤な有害事象等を発現した症例数は7例(0.06%)であり、そのうち4例(0.04%)が重篤な有害事象、3例(0.03%)が要報告事項の事象であった。これらの重篤な有害事象等はすべて回復または軽快した。
IHR2005による黄熱ワクチンに関する規定はWHO ITH country list, 01 July 2019を参照
国内における黄熱ワクチン接種機関(google map, FORTH)