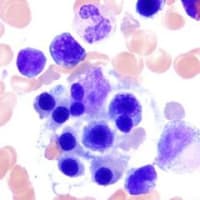
先月大阪での総合診療(ONRC 3rd)カンファに参加したおり抗核抗体(ANA)陰性SLE症例の発表がありました。大量の胸水腹水、血球減少、蛋白尿、腎尿細管性アシドーシスを来し、ANAやSSA抗体は陰性ながら腎生検を施行され免疫蛍光染色で抗体の沈着あり、糸球体腎炎所見から SLE診断に至ったとのことでした。それまで病歴なく初発で、尿細管性アシドーシスの原因ともなった、ANA陰性のSLEということで、まだまだ鑑別疾患も幅広く、SLE診断を疑うのは難しかっただろうなと思いました。
実際、臨床上である程度SLEも念頭においたのにANA検査陰性のときどう考えればいいのでしょうか。文献からまとめてみました。
→過去ブログも「全身性エリテマトーデスの診断について」 「ループス模倣疾患Lupus mimickersについて」
まとめ
・全身性エリテマトーデス(SLE)は、複数の器官系の関与や自己抗体の存在を特徴とする原型自己免疫疾患
・SLEの診断基準で現在認められている血清学的マーカーは、抗核抗体(ANA)と抗二本鎖DNA(抗ds-DNA)抗体、抗スミス、および抗リン脂質抗体が含まれる。
・SLEは頻繁にANA、抗dsDNA抗体に関連付けられているが、ANA陽性試験は、診断のために必須ではない。
・また、ANA試験は健常人でも一部陽性である。
・SLEの診断は多くの場合、臨床的基準、ANAなどの血清学的マーカーの存在の両方に依存する。これらのマーカーが存在せずさらに他の支援基準が満たされている場合、用語 血清陰性SLE “seronegative” SLEが与えられる。
・抗核抗体(ANA)は自己免疫疾患の診断のための基本であり、何十年もの間、間接蛍光抗体法(IIFA)によって決定されてきた。
・専門家の国際的なグループは、様々な方法でのANAテストのための提言を作成している[Ann Rheum Dis. 2014 Jan;73(1):17-23.]
・IIFA 法はANAスクリーニングのための方法。この方法の偽陰性と偽陽性率が異なることがあることを念頭に、代替的なアッセイを使用することができる。
・IIFA法のANAスクリーニングのため複合体は蛍光色素で標識した抗ヒトIgG特異的二次抗体で構成する必要がある。
・異常ANAは健常対照群の95パーセンタイル以上の力価でなければならない。一般的には、従来のHEp-2(000)基板上の1:160のスクリーニング希釈は、多くの場合、成人集団におけるANAの検出に適しSARDのために評価されている。
・ANAの結果が陽性である場合、抗dsDNA抗体についての試験は、SLEの臨床的疑いがある場合に推奨される。
SLE分類基準
・米国リウマチ学会(ACR)のSLEの分類基準(診断基準ではない)では11定義され、臨床的および/または血清学的基準のうち最小で4つを満たしている必要がある。 [Arthritis Rheum. 1997 Sep;40(9):1725.]
・2012年に全身性ループス国際協力クリニック(SLICC)グループが開発した分類基準は、少なくとも臨床と血清学的基準の1つずつを必要とし17の基準のうち4つの存在に基づいて疾患分類としている新しい基準を提案した [Arthritis Rheum. 2012 Aug;64(8):2677-86.]
・又は 抗核抗体または抗dsDNA抗体の存在下で、腎生検でループス腎炎所見を持つ。
・免疫学的基準の変化は、SLEにおける血清学的検査の新しい理解を反映している。抗核抗体以外の、抗dsDNA抗体、抗Sm抗体、ループスアンチコアグラント、梅毒偽陽性試験、抗カルジオリピン抗体は、別個の項目に分割される。
・ANA基準は変更されていない。新しい抗dsDNA抗体の基準は、ELISAアッセイのためのより厳密なカットオフを必要とする。
ANA陰性の原因・解釈
まず検査方法が時代によって異なる:1980年代以前の文献
・ANA陰性ループスの概念は最初、1976年にKollerらによって報告された。SLEと一致した臨床特徴を有するにもかかわらず、ANA陰性であった5人の患者のその説明した。 [Am J Clin Pathol. 1976 Sep;66(3):495-505.]
・しかし後に陰性ANA例の多くの結果は、検査でマウスの組織基質の使用に起因していたことが発見された後、最小化された。ANAマウス分析からヒト細胞株へ進歩した後、ANA陰性ループスの報告数が大幅に落がった。
・ANA陰性のSLEのためのメカニズムの一つは、間接免疫蛍光アッセイにおける低い感受性であるラットやマウス肝臓基板にある。
・ヒト上皮の専用(HEP-2)基板では ANAアッセイの感度は増加している。その結果、真のANA陰性SLEの発生率が著しく減少した。
・McHardyや同僚8で採用されたラット肝臓基板は、ANA陰性などのSLE患者のかなり大きな割合(8.9%)を定義した。[J Clin Pathol. 1982 Oct;35(10):1118-21.]。 その後、HEP-2細胞を用いての研究ではANA陰性の推定値は(2%)大幅に下回った[Q J Med. 1990 Mar;74(275):319-30.]
・Cross LSらは、‘antinuclear antibody negative lupus’を検索語にして検索を行い、1976年から2003年の間に164人の患者を記述する19論文を同定した。うち、患者の97%は1976年から1987年の期間に記載されていた。ANA陰性SLEの報告された症例の大多数は1987年以前に発生したことを示している。164名のうち27名のみ(16%)は、適切にHep-2細胞を基板に使用した報告であった。[QJM. 2004 May;97(5):303-8.]
・米国病理学会やACR主導のリウマチ性疾患におけるANAテストの使用と解釈の枠組み設定では、Hep-2細胞時代のANA陰性ループスは非常にまれであることを示唆している。 [Arch Pathol Lab Med. 2000 Jan;124(1):71-81.]
・いまだに信じられないほど、いくつかの報告では、そのANA決定に用いられた基板を指定せずにANA陰性SLE患者の発見を議論している。
他に推定される原因・解釈
・未確認の抗原系、例えば、抗リボソームP抗体(抗P)等は、SLEの小グループの病因に関与している、 現在、抗核や核関連抗原のために使用されるアッセイは疾患を検出するのに十分に敏感ではない。[Intern Med. 2002 Nov;41(11):1047-51.]
・間接免疫蛍光法によっては 血清中の免疫複合体に結合したANAを検出することができない
・ANAは免疫複合体の中に隠されてもよく、血清中で検出することができない [ Eur J Immunol. 1971 Nov;1(5):396-8.] これは、ループス腎炎5人の患者に記載され、そのANAsはDNAと主に反応しANAsが循環免疫複合体から解離されるまで 間接免疫蛍光法による血清中で検出されなかった。
・多量の蛋白尿の患者における腎臓を通してANAが損失する
・大量の蛋白尿を伴って腎臓を通してANAの損失は別の可能性として報告されている。[J Rheumatol. 1980 Jul-Aug;7(4):547-50.] その場合にはANAテストは免疫抑制治療にてフォローアップ期間中臨床的回復時に陽性になった。
・Ferreiroらによって報告された他の潜在的な損失として、活動性の漿膜炎にてANAの浸出を含む、ANAは胸水中で検出されるが、血清中には容易に検出されない。 [Am J Med. 1984 Jun;76(6):1100-5.]
・組織によって吸収された抗体 (例えば 腎臓などの臓器によるANA吸収はANA陰性SLEの一つのケースに記載されている、ここで、抗シチジン抗体は腎生検標本で発見された)
・SLE患者が治療と臨床的寛解状態にある場合は、ANAも陰性であるかもしれない。
・初期の研究者らは、高用量のコルチコステロイドは、ANAの結果に影響を与えていることを認識した。 それはANA陰性SLE疑い患者のコホートでの免疫抑制療法を検討することが適切である。
・Wallace and Linker-Israeliは、ANA陰性SLEの診断を受け入れる前に検討すべきである交絡因子のいくつかを強調している。
・実際にはANA陰性SLEの約10%が最終的には診断後、数年にてANA陽性になる可能性がある。
・自己抗体の進行性蓄積や、自己抗体の経時的な損失も知られている。
・50名の SLE患者のスウェーデンの研究では、異常なANA力価は、SLE血清のわずか76%でのみ発生した、 それは、以前に「ANA陽性であった。」とみなされていた。[J Rheumatol. 2008 Oct;35(10):1994-2000. ]
・449 名のSLE患者におけるベリムマブの多施設第II相試験では、エントリー時点ではSLE患者の71.3%のみがベースライン時ANAが陽性であった(検査室のカットオフ1:80)、 しかし98%は歴史的に陽性だった。 [Arthritis Rheum. 2009 Sep 15;61(9):1168-78.]
・Fesselは、彼が10年間にわたって永続的なANA陰性SLE(ヒト顆粒基板上に評価されるような)の10例を報告し見つけた。[Am J Med. 1978 Jan;64(1):80-6.]
・ほとんどのANA陰性患者は、長いフォローアップ期間の後にもANAのために持続的に陰性のテストを持っている。技術的因子またはプロゾーンprozone効果が、このための可能な理由として記載されている。 [ Scand J Immunol. 1976;5(5):513-9.]
・専門家の意見は、ANA陰性SLEは希少でSLE患者の<2%の発生率、であろうことを示唆。 [Q J Med. 1990 Mar;74(275):319-30.]
・Ferreiroらは、ANA陰性SLEの真の有病率は、ANA陰性SLEの過小診断の可能性も考え、5%を超える可能性があることを感じた。[Am J Med. 1984 Jun;76(6):1100-5.]
血清学的パラドックス(ANA陰性下で、抗dsDNA抗体陽性)
・Morrisと同僚23は、二本鎖DNA抗体陽性にもかかわらず、Hep-2細胞上の4つのANAの陰性結果に関連付けられているSLEの非定型例(異栄養性石灰化)を記述した。 これは、合理化することは困難です。テストの治療の時間的関係を記載しておりません。おそらく蛋白尿とステロイド治療に続発した偽陰性のANA、あるいは静脈内免疫グロブリン治療に続けての偽陽性のdsDNA、が 説明として
・ANAのためのHep-2基板を用いてANAテスト陰性結果にもかかわらず、抗DNA抗体アッセイ陽性を有する患者の有病率は約0-0.8%のみで報告。
・よって、ANAが偽陰性であるとの合理的な疑いがある場合を除き、 抗DNA抗体の検査は一般的に、ANA陰性患者では提唱されていない。
ANA陰性SLEの特徴
・Reichlinらは、ANA(マウス肝臓基板テスト)陰性SLEを有するほぼすべての患者は、抗Ro/SSA抗体が陽性であったことがわかった。 [Lupus. 2000;9(2):116-9.]
・ANA陰性者でしかし抗Ro抗体陽性の存在は、典型的な血管炎性皮膚症状を伴う。他の臨床的特徴は、日光過敏性、腎疾患、先天性心ブロックと新生児ループスが含まれる。
・Maddisonらは、間接免疫蛍光により陰性のANAで66人のSLE患者を観察した。これらで細胞質成分に対する血清抗体を発見した。 患者の62%は抗Ro抗体を、27%が抗La抗体を持っていた。 [ Medicine (Baltimore). 1981 Mar;60(2):87-94.]
・ANA陰性にもかかわらずSLEの臨床上の疑いが高いままにおいては、 抗dsDNA, 抗Sm, 抗Ro/SSA, 抗La/SSB 、抗RNP抗体 を含む追加の特定の抗体検査を続行するのが妥当かもしれない。
・いわゆるANA陰性SLEは一般的に良好な転帰と生存期間の延長を持つと考えられているSLEのサブグループのようである。
・これらの患者は皮膚症状の優位性と内部臓器病変の相対的なスペアリングを持っている。
・ANA陽性SLEと比較すると、ANA陰性SLEは、皮膚の発疹、日光過敏性、抗Roの抗体の高い有病率を有することが報告されている。[ J Am Acad Dermatol. 1981 Jan;4(1):84-9.] そして、中枢神経系や腎臓などの主要臓器病変の有病率は低い [ Medicine (Baltimore). 1981 Mar;60(2):87-94.]
・Madisonらは、91%の患者で非瘢痕の頬部発疹や79%で日光過敏性を観察した。ANA陽性のSLE患者でそれぞれ61%と50%に比べて。
・Fesselが報告された別の研究では、ANA陰性のSLE患者において、よりレイノー現象の頻度、脱毛症、および口腔潰瘍の頻度が多い、 ANA陽性者とは対照的に。
・発症年齢と女性の優位は、ANA陽性SLEとANA陰性SLEで同様だった。
・ANA陰性SLE患者の約10%では、抗SS-DNA、抗RO、及び抗La抗体でさえ欠如し、 そして、このような患者は皮膚外症状を持つのはさらにより少ない頻繁であった。
ループス様糸球体腎炎
・SLEの非存在下で、ループス腎炎の免疫複合体の沈着特性の特定のパターンを有する糸球体腎炎の発見はループス様糸球体腎炎と呼ばれています。
・“フルハウス“免疫蛍光パターン“Full-house” immunofluorescence patternとして知られている糸球体の免疫グロブリンG(IgG)、IgA、IgM抗体、補体(C3)、およびC1qの沈着の検出ための免疫蛍光染色は、ループス腎炎などで見られる特徴の一つ。
・フルハウス免疫蛍光パターンが存在する場合、ループス腎炎の診断が疑われるべきで、患者はSLEの臨床的および免疫学的証拠を評価する必要がある。
・Pirkle JLらは、ACRのSLE分類基準のうち3つを持ち基準には満たないながら、蛋白尿、日光過敏皮膚炎、およびループス抗凝固試験陽性で、メサンギウム、内皮下、及び尿細管基底膜のIgG、IgA、IgM、C3、およびC1q沈着を伴う膜性分布の免疫複合体疾患の症例を報告した。膜性糸球体症の他の原因を除外した後に、ループス様糸球体腎炎の診断がなされた。[Am J Kidney Dis. 2013 Jul;62(1):159-64.]
・Caltik Aらは、発疹と血管炎、下部消化器出血や急性腎不全として提示したSLEで、ANA、抗二本鎖DNA、P‐ANCA、C‐ANCA、抗カルジオリピンIgMおよびIgG力価は陰性であった珍しい例を報告。腎生検では、免疫蛍光顕微鏡検査でフルハウス染色パターンでびまん性増殖性糸球体腎炎を明らかにし、クラスIVループス腎炎を示唆した。[Rheumatol Int. 2013 Jan;33(1):219-22.]
・Gianvitiらは、フルハウス腎症で31人の小児をレビューし、14名は自己抗体陽性で他のループス基準もありSLEと診断、3名はループスのための血清学的検査は陰性で、追跡期間中に自己抗体を開発、しかし14名はSLE臨床所見を伴わないままで血清陰性のままであった。[Pediatr Nephrol. 1999 Oct;13(8):683-7.]
・Kim HAらは、セロコンバージョンをしないANA陰性ループス腎炎の非常にまれなケースを報告した。[Korean J Intern Med. 2009 Mar;24(1):76-9.] ANAなどの自己抗体は、糸球体に強いIgG沈着があったにも関わらず、フォローアップ期間中に陰性であった。可能な説明として筆者らは、血清中ANAレベルは、従来の臨床アッセイにより検出することが低すぎる可能性、フォローアップ期間は患者がANAを開発するために不十分な長さ、患者における腎損傷はANAと反応しない自己抗体によって媒介された可能性、を上げている。
・ACRの分類基準(少なくとも4つがSLE診断のために必要とされているが)において、フルハウス免疫蛍光パターンの存在下でのSLEの診断では2つだけの基準が存在する場合でも疾患を排除することはできない。 [ Medicine (Baltimore). 1981 Mar;60(2):87-94.]
・不完全エリテマトーデスIncomplete lupus erythematosus(ILE)とは、4より少ない1997 ACR分類基準を持っている臨床SLEの指標と症状はなくて、個人を参照するために使用される用語
・ILE及びSLE患者は、同様の平均ANAレベルを有していた(P> 0.05)、 それはFDRS(p <0.001)、健康な対照(p≤0.5)より有意に高かった[J Autoimmun. 2006 Nov;27(3):153-60. ]
・ANAはSLEの診断のための必須のテストではない
・「フルハウス免疫蛍光パターン」が腎生検標本中に存在する場合にはループス腎炎の診断を疑うべき
・ANAテスト陰性は常に、SLE診断を除外するものではない
参考文献
Methodist Debakey Cardiovasc J. 2015 Jul-Sep;11(3):186-8.
Indian J Dermatol. 2015 Mar-Apr;60(2):215.
Ann Rheum Dis. 2014 Jan;73(1):17-23.
Rheumatol Int. 2013 Jan;33(1):219-22.
QJM. 2004 May;97(5):303-8.