こちらは、まともな医師や科学者たちの意見表明
COVID Vaccines: Necessity, Efficacy and Safety
COVIDワクチン:必要性、有効性、安全性 Doctors for Covid Ethics
https://doctors4covidethics.medium.com/covid-vaccines-necessity-efficacy-and-safety-b1d8bfbc9d2
要旨:COVID-19 ワクチンメーカーは、ワクチンによる危害に対する法的責任を免除されている。したがって、COVID-19ワクチンの接種を許可、施行、管理するすべての人にとって、害の責任は彼らにあるので、これらのワクチンのリスクと利益に関する証拠を理解することは有益である。
要するに、入手可能な証拠と科学は、COVID-19ワクチンが不要であり、効果がなく、安全ではないことを示している。

• 必要性:免疫力のある人は、細胞性免疫によってSARS-CoV-2から守られている。したがって、リスクの低いグループにワクチンを接種する必要はない。免疫不全者がCOVID-19に罹患した場合、安全性と有効性が証明されている様々な治療法がある。したがって、弱者へのワクチン接種も同様に不要である。免疫力の高いグループも弱いグループも、自然に獲得した免疫や薬によって、ワクチン接種よりもSARS-CoV-2の亜種に対してよりよく保護されている。
• 有効性:Covid-19ワクチンは、気道へのSARS-CoV-2感染に対する有効な作用メカニズムを持たない。抗体を誘導しても、SARS-CoV-2のように気道から侵入する病原体の感染を防ぐことはできない。また、どのワクチン試験においても、ワクチンを接種した人が感染するのを防ぐという証拠はなく、「他人を守る」ためにワクチンを接種することには何の根拠もない。
• 安全性:出血性疾患、脳内血栓症、脳卒中、心筋梗塞などを含む致死的および非致死的な血液凝固障害のリスク、自己免疫反応やアレルギー反応、抗体依存性疾患の増強、急ごしらえの製造や規制されていない製造基準によるワクチンの不純物混入などの理由により、健康な人と慢性疾患を持つ人の両方にとってそれらのワクチンは危険である。
したがって、リスク・ベネフィットの計算は明確であり、実験的なワクチンは必要なく、効果がなく、危険である。実験的なCOVID-19ワクチンの接種を許可、強制、管理する行為者は、集団や患者を深刻で不必要な、そして不当な医療リスクにさらしている。
1. ワクチンは不要
1. 複数の研究によると、免疫力の高い人は、SARS-CoV-2とその亜種を含むSARS-CoVウイルスに対して、「強固な」持続的な細胞(T細胞)免疫を示すことが示されている[1]。T細胞の保護は,SARS-CoV-2自体への曝露だけでなく,以前に風邪やSARSコロナウイルスに曝露した際の交差反応性免疫にも起因する[1,3-10].このような免疫は、最大で17年前の感染でも検出された[1,3]。したがって、免疫力のある人はSARS-CoV-2に対するワクチン接種を必要としない。
2. 自然のT細胞免疫は、単一の(スパイク)タンパク質だけでなく、複数のウイルスエピトープとコスティミュレーショナルシグナルを認識するため、ワクチンよりも強力かつ包括的にすべてのSARS-CoV-2株を防御することができる。したがって、免疫力の高い人は、SARS-CoV-2やその亜種に対して、現行のワクチンよりも自らの免疫力でよりよく保護されるのである。
3. ワクチンは、無症候性感染[11]、ひいては「無症候性感染」を予防する手段として注目されている。しかし、「無症候性感染」は、無効で信頼性の低いPCR検査の手順と解釈の産物であり、高い偽陽性率をもたらしている[12-15]。エビデンスによると、PCR陽性の無症候性の人々は健康な偽陽性であり、キャリアではない。中国の9,899,828人を対象とした包括的な研究では、COVID-19に陽性反応を示す無症候性の人が他の人を感染させることはないことがわかった[16]。一方、米国疾病管理センターが無症候性感染の主張を正当化するために引用した論文[17,18]は、経験的な研究ではなく、仮説的なモデルに基づいており、証拠ではなく仮定と推定を提示している。無症候性感染を防ぐことは、一般の人々へのワクチン接種を促進するための有効な理由にはならない。
4. 現在、ほとんどの国では、ほとんどの人がSARS-CoV-2に対する免疫を持っている[19]。以前に獲得した交差免疫の程度に応じて、症状が出なかったり、軽度で特徴のない症状が出たり、あるいはより重度の症状が出て、場合によっては無嗅覚症(嗅覚の喪失)やその他のCOVID-19病の特徴的な徴候を含むこともあるだろう。病気の重症度にかかわらず、彼らは現在、再び暴露された場合に重症の病気から保護されるのに十分な免疫を持っている。このような大多数の人々は、ワクチンを接種しても全くメリットがない。(訳注:むしろ危険である。自己免疫疾患で早死にするだろう)
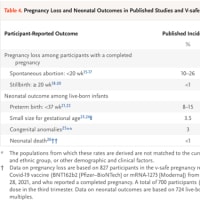
5. COVID-19の人口生存率は世界的に99.8%を超えている[20-22]。数ヶ月にわたって集中的に感染した国では、人口の0.2%未満が死亡し、その死因が「COVID-19あり」と分類されている。また、COVID-19は通常、軽度から中程度の重症である。したがって、圧倒的多数の人はCOVID-19によるリスクを負っておらず、自己防衛のためのワクチン接種を必要としていない。
6. 重度の感染症にかかりやすい人では、Covid-19は治療可能な病気である。既存の薬剤を用いた早期治療により、入院率が約85%、死亡率が約75%減少することが多くのエビデンスから示されている[23-27]。これらの薬には、抗炎症薬、抗ウイルス薬、抗凝固薬、モノクローナル抗体、亜鉛、ビタミンC、Dなど、多くの実績のある薬が含まれている。産業界や政府は、選択的な研究支援 [24]、規制による偏見、さらには、このような治療法を自発的に使用しようとする医師に対する明白な制裁措置によって、このような実績のある治療法を傍観するという決定を下したが、これは既存の法律、標準的な医療行為、研究とはかけ離れたものであり、現実世界の証拠を考慮するという法的要件は道を踏み外してしまった [28]。このような効果的な治療法を組織的に否定・非難することで、「標準的に受け入れられる治療法がない」ことを要件とするワクチンの緊急使用許可の偽りの正当性を支えてきた [29]。平たく言えば、ワクチンは重篤な疾患を予防するためには必要ないということである。
2. それらのワクチンは有効性を欠如している
1. メカニズム的レベルでは、COVID-19のワクチン接種のように、抗体の誘導によってCOVID-19に対する免疫を獲得するという概念は、医学的にはナンセンスである。SARS-CoV-2のような空気感染するウイルスは、気道や肺を経由して体内に入るが、ここでは抗体濃度が低すぎて感染を防ぐことができない。ワクチンで作られた抗体は主に血液中を循環するが、肺や気道の粘膜では濃度が低い。COVID-19が主にこれらの粘膜に感染して拡散し、病気を引き起こすことを考えると、ワクチンは免疫学的には的外れである。ワクチンメーカーが各規制機関に提出した資料には、感染の連鎖を断ち切るために重要となる気道感染をワクチン接種によって防ぐという証拠は含まれていない。このように、COVID-19にとってワクチンは免疫学的に不適切なのである。
2. 中長期的なワクチンの有効性は不明である。フェーズ3の中期的な24ヶ月間の試験が終了するのは2023年である。COVID-19ワクチンの有効性に関する中期・長期の縦断的データはない。
3. 短期間のデータでは重症化の予防は確立されていない。欧州医薬品庁は、コミルナティ(ファイザー社のmRNA)ワクチンについて、COVID-19の重症化は「この研究ではまれであり、統計的に確実な結論は導き出せない」と指摘している[30]。同様に、FDAに提出されたファイザーの文書[31]では、死亡率に対する有効性は証明できなかったと結論づけている。このように、ワクチンは短期的にも死亡や重症化を防ぐことができないのである。
4. COVID-19に対する保護の相関関係は不明である。研究者は、COVID-19に対する保護を測定する方法をまだ確立していない。そのため、有効性に関する研究は暗中模索の状態にある。例えば、第1相と第2相の研究が終了した後、『Vaccine』誌に掲載された論文では、「防御の相関関係を理解しなければ、ワクチンによる防御、COVID-19の再感染のリスク、集団免疫、そしてヒト集団からのSARS-CoV-2の排除の可能性に関する疑問に現在対処することは不可能である」と指摘している[32]。このように、ワクチンの有効性を評価できないのは、その測定方法が確立されていないからである。
3. それらのワクチンは危険である
1. 喫煙が第一原理に基づいて肺がんを引き起こす可能性があり、それが予測されていたように、すべての遺伝子ベースのワクチンは、その分子的な作用メカニズムに基づいて、血液凝固や出血の障害を引き起こすことが予測される[33]。これと矛盾しないように、この種の疾患は年齢層を超えて観察されており、世界中でワクチンの一時的な中止が行われている-それらおワクチンは安全ではない。
2. ワクチン接種後の血液障害は「まれ」であるという主張に反して、多くの一般的なワクチンの副作用(頭痛、吐き気、嘔吐、全身の血腫のような「発疹」)は、血栓症やその他の重篤な異常を示す可能性がある。さらに、ワクチンによって誘発される肺のびまん性微小血栓症は、肺炎をまねくことがあり、COVID-19と誤診されることがある。現在メディアで注目されている血栓イベントは、「巨大な氷山の一角」に過ぎない可能性が高い [34] – それらのワクチンは安全ではない。
3. 免疫学的なプライミングにより、血液凝固、出血、その他の有害事象のリスクは、ワクチンを再接種したり、コロナウイルスにさらされたりするたびに増加すると予想される。数ヶ月、数年と時間が経つにつれ [35]、若くて健康な年齢層にとっては、ワクチン接種もコロナウイルスも危険なものとなってしまうが、ワクチンを接種しなければCOVID-19は実質的なリスクにはならない。
ワクチンが普及して以来、ワクチン接種率の高い多くの地域でCOVID-19の発生率が上昇している[36-38]。さらに、高齢者施設ではワクチン接種開始直後にCOVID-19による死亡事故が複数回発生している[39,40]。これらの事例は、抗体依存性の増強だけでなく、ワクチンの一般的な免疫抑制効果によるものかもしれない。このことは、特定の患者で帯状疱疹の発生が増加したことからも示唆されている[41]。免疫抑制により、以前は無症状だった感染症が臨床的に顕在化したのかもしれない。これらの報告された死亡例の原因となる正確なメカニズムにかかわらず、ワクチンはCOVID-19の致死率を低下させるのではなく、むしろ増加させると予想しなければならない-それらのワクチンは安全ではない。
4. このワクチンは、定義上、実験的なものである。2023年までは第3相試験が行われている。被験者は、ニュルンベルク条約や欧州評議会の決議2361[42]、FDAの緊急使用許可条件[29]などの保護のもと、自由なインフォームド・コンセントを受ける権利を有する。第1相および第2相試験の安全性データについては,当初はサンプル数が多かったにもかかわらず,雑誌『Vaccine』は,「さらなる開発のために選ばれたワクチン接種戦略は,わずか12人の参加者にしか行われなかったかもしれない」と報告している[32]。このようにサンプル数が極めて少ないことから,同誌は,安全性を確認するためには「より長期間にわたる大規模な第3相試験が必要である」と指摘している。2023年に向けて、全人口を対象とした第3相試験で評価されるべきリスクには、血栓症や出血異常だけでなく、その他の自己免疫反応、アレルギー反応、脂質ナノ粒子の未知のトロピズム(向性、組織への到達点)[35]、抗体依存性増強[43-46]、急がされ、疑問視され、規制されておらず[47]、報告されている一貫性のない製造方法の影響、管理されていないDNA残留物などの潜在的に有害な不純物のリスク[48]などがある。それらのワクチンは、接種者にとっても、それを投与する人や使用を許可する人にとっても、安全ではない。
5. 初期の経験では、アデノウイルス由来のワクチン(AstraZeneca/Johnson&Johnson)の方が、mRNAワクチン(Pfizer/Moderna)よりも副作用が大きいと思われるかもしれない。しかし、アデノウイルス由来のワクチンは、繰り返し注射することにより、アデノウイルスベクターのタンパク質に対する抗体が形成される。この抗体は、ワクチンウイルス粒子の大部分を中和し、細胞に感染する前に廃棄してしまうため、組織障害の強度を抑えることができる。
一方、mRNAワクチンでは、抗体が認識するタンパク質抗原がない。そのため、免疫力の有無にかかわらず、ワクチンのmRNAは標的である体細胞に到達する。そして、体細胞はスパイクタンパク質を発現し、その後、免疫システムの猛攻撃を受けることになる。mRNAワクチンでは、重篤な有害事象が発生するリスクは、注射を繰り返すたびにほぼ確実に増加する。したがって、長期的にはベクターワクチンよりも危険なワクチンといえる。これらのワクチンは安全ではない。
4. 倫理・法律上の留意点
1. ワクチンを推奨・推進する一方で、代替戦略(自然免疫への依存や早期治療)を非難する科学文献や組織には、利益相反が多く存在している。当局、医師、医療関係者は、利益相反に関する情報源を極めて注意深く評価することで、自らを守る必要がある。
2. 当局、医師、医療関係者は、ワクチンの必要性、安全性、有効性に関する信頼できる独立した文献を無視しないよう、同様に注意する必要がある。なぜなら、ワクチン接種キャンペーンを中止しない限り、予測される大量の死や害があるからである。
3. ワクチンメーカーが有害事象に対する法的責任を免除されているのには理由がある。ワクチンによる死亡や被害が発生した場合、責任を負うのはワクチンの認可、投与、ワクチンパスポートによる強制などの責任者であり、これらは冷静な証拠に基づくリスク・ベネフィット分析では正当化できない。
4. COVID-19の接種に関わるすべての政治・規制・医療関係者は、自らを守るために、ニュルンベルクコードやその他の法規定に精通すべきである。
References
1. Le Bert, N.; Tan, A.T.; Kunasegaran, K.; Tham, C.Y.L.; Hafezi, M.; Chia, A.; Chng, M.H.Y.; Lin, M.; Tan, N.; Linster, M.; Chia, W.N.; Chen, M.I.; Wang, L.; Ooi, E.E.; Kalimuddin, S.; Tambyah, P.A.; Low, J.G.; Tan, Y. and Bertoletti, A. (2020) SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 584:457–462
2. Tarke, A.; Sidney, J.; Methot, N.; Zhang, Y.; Dan, J.M.; Goodwin, B.; Rubiro, P.; Sutherland, A.; da Silva Antunes, R.; Frazier, A. and al., e. (2021) Negligible impact of SARS-CoV-2 variants on CD4+ and CD8+ T cell reactivity in COVID-19 exposed donors and vaccinees. bioRxiv -:x-x
3. Anonymous, (2020) Scientists uncover SARS-CoV-2-specific T cell immunity in recovered COVID-19 and SARS patients.
4. Beasley, D. (2020) Scientists focus on how immune system T cells fight coronavirus in absence of antibodies.
5. Bozkus, C.C. (2020) SARS-CoV-2-specific T cells without antibodies. Nat. Rev. Immunol. 20:463
6. Grifoni, A.; Weiskopf, D.; Ramirez, S.I.; Mateus, J.; Dan, J.M.; Moderbacher, C.R.; Rawlings, S.A.; Sutherland, A.; Premkumar, L.; Jadi, R.S. and al., e. (2020) Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 181:1489–1501.e15
7. Mateus, J.; Grifoni, A.; Tarke, A.; Sidney, J.; Ramirez, S.I.; Dan, J.M.; Burger, Z.C.; Rawlings, S.A.; Smith, D.M.; Phillips, E. and al., e. (2020) Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. Science 370:89–94
8. McCurry-Schmidt, M. (2020) Exposure to common cold coronaviruses can teach the immune system to recognize SARS-CoV-2.
9. Palmer, S.; Cunniffe, N. and Donnelly, R. (2021) COVID-19 hospitalization rates rise exponentially with age, inversely proportional to thymic T-cell production. J. R. Soc. Interface 18:20200982
10. Sekine, T.; Perez-Potti, A.; Rivera-Ballesteros, O.; Strålin, K.; Gorin, J.; Olsson, A.; Llewellyn-Lacey, S.; Kamal, H.; Bogdanovic, G.; Muschiol, S. and al., e. (2020) Robust T Cell Immunity in Convalescent Individuals with Asymptomatic or Mild COVID-19. Cell 183:158–168.e14
11. Drake, J. (2021) Now We Know: Covid-19 Vaccines Prevent Asymptomatic Infection, Too.
12. Bossuyt, P.M. (2020) Testing COVID-19 tests faces methodological challenges. Journal of clinical epidemiology 126:172–176
13. Jefferson, T.; Spencer, E.; Brassey, J. and Heneghan, C. (2020) Viral cultures for COVID-19 infectivity assessment. Systematic review. Clin. Infect. Dis. ciaa1764:x-x
14. Borger, P.; Malhotra, R.K.; Yeadon, M.; Craig, C.; McKernan, K.; Steger, K.; McSheehy, P.; Angelova, L.; Franchi, F.; Binder, T.; Ullrich, H.; Ohashi, M.; Scoglio, S.; Doesburg-van Kleffens, M.; Gilbert, D.; Klement, R.J.; Schrüfer, R.; Pieksma, B.W.; Bonte, J.; Dalle Carbonare, B.H.; Corbett, K.P. and Kämmer, U. (2020) External peer review of the RTPCR test to detect SARS-CoV-2 reveals 10 major scientific flaws at the molecular and methodological level: consequences for false positive results.
15. Mandavilli, A. (2020) Your Coronavirus Test Is Positive. Maybe It Shouldn’t Be.
16. Cao, S.; Gan, Y.; Wang, C.; Bachmann, M.; Wei, S.; Gong, J.; Huang, Y.; Wang, T.; Li, L.; Lu, K.; Jiang, H.; Gong, Y.; Xu, H.; Shen, X.; Tian, Q.; Lv, C.; Song, F.; Yin, X. and Lu, Z. (2020) Post-lockdown SARS-CoV-2 nucleic acid screening in nearly ten million residents of Wuhan, China. Nat. Commun. 11:5917
17. Moghadas, S.M.; Fitzpatrick, M.C.; Sah, P.; Pandey, A.; Shoukat, A.; Singer, B.H. and Galvani, A.P. (2020) The implications of silent transmission for the control of COVID-19 outbreaks. Proc. Natl. Acad. Sci. U. S. A. 117:17513–17515
18. Johansson, M.A.; Quandelacy, T.M.; Kada, S.; Prasad, P.V.; Steele, M.; Brooks, J.T.; Slayton, R.B.; Biggerstaff, M. and Butler, J.C. (2021) SARS-CoV-2 Transmission From People Without COVID-19 Symptoms. JAMA network open 4:e2035057
19. Yeadon, M. (2020). What SAGE got wrong. Lockdown Skeptics.
20. Ioannidis, J.P.A. (2020) Global perspective of COVID‐19 epidemiology for a full‐cycle pandemic. Eur. J. Clin. Invest. 50:x-x
21. Ioannidis, J.P.A. (2021) Reconciling estimates of global spread and infection fatality rates of COVID‐19: An overview of systematic evaluations. Eur. J. Clin. Invest. -:x-x
22. CDC, (2020) Science Brief: Community Use of Cloth Masks to Control the Spread of SARS-CoV-2.
23. Orient, J.; McCullough, P. and Vliet, E. (2020) A Guide to Home-Based COVID Treatment.
24. McCullough, P.A.; Alexander, P.E.; Armstrong, R.; Arvinte, C.; Bain, A.F.; Bartlett, R.P.; Berkowitz, R.L.; Berry, A.C.; Borody, T.J.; Brewer, J.H.; Brufsky, A.M.; Clarke, T.; Derwand, R.; Eck, A.; Eck, J.; Eisner, R.A.; Fareed, G.C.; Farella, A.; Fonseca, S.N.S.; Geyer, C.E.; Gonnering, R.S.; Graves, K.E.; Gross, K.B.V.; Hazan, S.; Held, K.S.; Hight, H.T.; Immanuel, S.; Jacobs, M.M.; Ladapo, J.A.; Lee, L.H.; Littell, J.; Lozano, I.; Mangat, H.S.; Marble, B.; McKinnon, J.E.; Merritt, L.D.; Orient, J.M.; Oskoui, R.; Pompan, D.C.; Procter, B.C.; Prodromos, C.; Rajter, J.C.; Rajter, J.; Ram, C.V.S.; Rios, S.S.; Risch, H.A.; Robb, M.J.A.; Rutherford, M.; Scholz, M.; Singleton, M.M.; Tumlin, J.A.; Tyson, B.M.; Urso, R.G.; Victory, K.; Vliet, E.L.; Wax, C.M.; Wolkoff, A.G.; Wooll, V. and Zelenko, V. (2020) Multifaceted highly targeted sequential multidrug treatment of early ambulatory high-risk SARS-CoV-2 infection (COVID-19). Reviews in cardiovascular medicine 21:517–530
25. Procter, {.B.C.; {APRN}, {.C.R.{.; {PA}-C, {.V.P.; {PA}-C, {.E.S.; {PA}-C, {.C.H. and McCullough, {.{.P.A. (2021) Early Ambulatory Multidrug Therapy Reduces Hospitalization and Death in High-Risk Patients with SARS-CoV-2 (COVID-19). International journal of innovative research in medical science 6:219–221
26. McCullough, P.A.; Kelly, R.J.; Ruocco, G.; Lerma, E.; Tumlin, J.; Wheelan, K.R.; Katz, N.; Lepor, N.E.; Vijay, K.; Carter, H.; Singh, B.; McCullough, S.P.; Bhambi, B.K.; Palazzuoli, A.; De Ferrari, G.M.; Milligan, G.P.; Safder, T.; Tecson, K.M.; Wang, D.D.; McKinnon, J.E.; O’Neill, W.W.; Zervos, M. and Risch, H.A. (2021) Pathophysiological Basis and Rationale for Early Outpatient Treatment of SARS-CoV-2 (COVID-19) Infection. Am. J. Med. 134:16–22
27. Anonymous, (2020) Real-time database and meta analysis of 588 COVID-19 studies.
28. Hirschhorn, J.S. (2021) COVID scandal: Feds ignored 2016 law requiring use of real world evidence.
29. Anonymous, (1998) Emergency Use of an Investigational Drug or Biologic: Guidance for Institutional Review Boards and Clinical Investigators.
30. Anonymous, (2021) EMA assessment report: Comirnaty.
31. Anonymous, (2020) FDA briefing document: Pfizer-BioNTech COVID-19 Vaccine.
32. Giurgea, L.T. and Memoli, M.J. (2020) Navigating the Quagmire: Comparison and Interpretation of COVID-19 Vaccine Phase 1/2 Clinical Trials. Vaccines 8:746
33. Bhakdi, S.; Chiesa, M.; Frost, S.; Griesz-Brisson, M.; Haditsch, M.; Hockertz, S.; Johnson, L.; Kämmerer, U.; Palmer, M.; Reiss, K.; Sönnichsen, A.; Wodarg, W. and Yeadon, M. (2021) Urgent Open Letter from Doctors and Scientists to the European Medicines Agency regarding COVID-19 Vaccine Safety Concerns.
34. Bhakdi, S. (2021) Rebuttal letter to European Medicines Agency from Doctors for Covid Ethics, April 1, 2021.
35. Ulm, J.W. (2020) Rapid response to: Will covid-19 vaccines save lives? Current trials aren’t designed to tell us.
36. Reimann, N. (2021) Covid Spiking In Over A Dozen States — Most With High Vaccination Rates.
37. Meredith, S. (2021) Chile has one of the world’s best vaccination rates. Covid is surging there anyway.
38. Bhuyan, A. (2021) Covid-19: India sees new spike in cases despite vaccine rollout. BMJ 372:n854
39. Morrissey, K. (2021) Open letter to Dr. Karina Butler.
40. Anonymous, (2021) Open Letter from the UK Medical Freedom Alliance: Urgent warning re Covid-19 vaccine-related deaths in the elderly and Care Homes.
41. Furer, V.; Zisman, D.; Kibari, A.; Rimar, D.; Paran, Y. and Elkayam, O. (2021) Herpes zoster following BNT162b2 mRNA Covid-19 vaccination in patients with autoimmune inflammatory rheumatic diseases: a case series. Rheumatology -:x-x
42. Anonymous, (2021) Covid-19 vaccines: ethical, legal and practical considerations.
43. Tseng, C.; Sbrana, E.; Iwata-Yoshikawa, N.; Newman, P.C.; Garron, T.; Atmar, R.L.; Peters, C.J. and Couch, R.B. (2012) Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS One 7:e35421
44. Bolles, M.; Deming, D.; Long, K.; Agnihothram, S.; Whitmore, A.; Ferris, M.; Funkhouser, W.; Gralinski, L.; Totura, A.; Heise, M. and Baric, R.S. (2011) A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge. J. Virol. 85:12201–15
45. Weingartl, H.; Czub, M.; Czub, S.; Neufeld, J.; Marszal, P.; Gren, J.; Smith, G.; Jones, S.; Proulx, R.; Deschambault, Y.; Grudeski, E.; Andonov, A.; He, R.; Li, Y.; Copps, J.; Grolla, A.; Dick, D.; Berry, J.; Ganske, S.; Manning, L. and Cao, J. (2004) Immunization with modified vaccinia virus Ankara-based recombinant vaccine against severe acute respiratory syndrome is associated with enhanced hepatitis in ferrets. J. Virol. 78:12672–6
46. Czub, M.; Weingartl, H.; Czub, S.; He, R. and Cao, J. (2005) Evaluation of modified vaccinia virus Ankara based recombinant SARS vaccine in ferrets. Vaccine 23:2273–9
47. Tinari, S. (2021) The EMA covid-19 data leak, and what it tells us about mRNA instability. BMJ 372:n627
48. Anonymous, (2021) Interview with Dr. Vanessa Schmidt-Krüger.
More from Doctors for Covid Ethics
We are doctors and scientists from 30 countries, seeking to uphold medical ethics, patient safety and human rights in response to COVID-19. t: @Drs4CovidEthics
COVID Vaccines: Necessity, Efficacy and Safety
COVIDワクチン:必要性、有効性、安全性 Doctors for Covid Ethics
https://doctors4covidethics.medium.com/covid-vaccines-necessity-efficacy-and-safety-b1d8bfbc9d2
要旨:COVID-19 ワクチンメーカーは、ワクチンによる危害に対する法的責任を免除されている。したがって、COVID-19ワクチンの接種を許可、施行、管理するすべての人にとって、害の責任は彼らにあるので、これらのワクチンのリスクと利益に関する証拠を理解することは有益である。
要するに、入手可能な証拠と科学は、COVID-19ワクチンが不要であり、効果がなく、安全ではないことを示している。

• 必要性:免疫力のある人は、細胞性免疫によってSARS-CoV-2から守られている。したがって、リスクの低いグループにワクチンを接種する必要はない。免疫不全者がCOVID-19に罹患した場合、安全性と有効性が証明されている様々な治療法がある。したがって、弱者へのワクチン接種も同様に不要である。免疫力の高いグループも弱いグループも、自然に獲得した免疫や薬によって、ワクチン接種よりもSARS-CoV-2の亜種に対してよりよく保護されている。
• 有効性:Covid-19ワクチンは、気道へのSARS-CoV-2感染に対する有効な作用メカニズムを持たない。抗体を誘導しても、SARS-CoV-2のように気道から侵入する病原体の感染を防ぐことはできない。また、どのワクチン試験においても、ワクチンを接種した人が感染するのを防ぐという証拠はなく、「他人を守る」ためにワクチンを接種することには何の根拠もない。
• 安全性:出血性疾患、脳内血栓症、脳卒中、心筋梗塞などを含む致死的および非致死的な血液凝固障害のリスク、自己免疫反応やアレルギー反応、抗体依存性疾患の増強、急ごしらえの製造や規制されていない製造基準によるワクチンの不純物混入などの理由により、健康な人と慢性疾患を持つ人の両方にとってそれらのワクチンは危険である。
したがって、リスク・ベネフィットの計算は明確であり、実験的なワクチンは必要なく、効果がなく、危険である。実験的なCOVID-19ワクチンの接種を許可、強制、管理する行為者は、集団や患者を深刻で不必要な、そして不当な医療リスクにさらしている。
1. ワクチンは不要
1. 複数の研究によると、免疫力の高い人は、SARS-CoV-2とその亜種を含むSARS-CoVウイルスに対して、「強固な」持続的な細胞(T細胞)免疫を示すことが示されている[1]。T細胞の保護は,SARS-CoV-2自体への曝露だけでなく,以前に風邪やSARSコロナウイルスに曝露した際の交差反応性免疫にも起因する[1,3-10].このような免疫は、最大で17年前の感染でも検出された[1,3]。したがって、免疫力のある人はSARS-CoV-2に対するワクチン接種を必要としない。
2. 自然のT細胞免疫は、単一の(スパイク)タンパク質だけでなく、複数のウイルスエピトープとコスティミュレーショナルシグナルを認識するため、ワクチンよりも強力かつ包括的にすべてのSARS-CoV-2株を防御することができる。したがって、免疫力の高い人は、SARS-CoV-2やその亜種に対して、現行のワクチンよりも自らの免疫力でよりよく保護されるのである。
3. ワクチンは、無症候性感染[11]、ひいては「無症候性感染」を予防する手段として注目されている。しかし、「無症候性感染」は、無効で信頼性の低いPCR検査の手順と解釈の産物であり、高い偽陽性率をもたらしている[12-15]。エビデンスによると、PCR陽性の無症候性の人々は健康な偽陽性であり、キャリアではない。中国の9,899,828人を対象とした包括的な研究では、COVID-19に陽性反応を示す無症候性の人が他の人を感染させることはないことがわかった[16]。一方、米国疾病管理センターが無症候性感染の主張を正当化するために引用した論文[17,18]は、経験的な研究ではなく、仮説的なモデルに基づいており、証拠ではなく仮定と推定を提示している。無症候性感染を防ぐことは、一般の人々へのワクチン接種を促進するための有効な理由にはならない。
4. 現在、ほとんどの国では、ほとんどの人がSARS-CoV-2に対する免疫を持っている[19]。以前に獲得した交差免疫の程度に応じて、症状が出なかったり、軽度で特徴のない症状が出たり、あるいはより重度の症状が出て、場合によっては無嗅覚症(嗅覚の喪失)やその他のCOVID-19病の特徴的な徴候を含むこともあるだろう。病気の重症度にかかわらず、彼らは現在、再び暴露された場合に重症の病気から保護されるのに十分な免疫を持っている。このような大多数の人々は、ワクチンを接種しても全くメリットがない。(訳注:むしろ危険である。自己免疫疾患で早死にするだろう)
5. COVID-19の人口生存率は世界的に99.8%を超えている[20-22]。数ヶ月にわたって集中的に感染した国では、人口の0.2%未満が死亡し、その死因が「COVID-19あり」と分類されている。また、COVID-19は通常、軽度から中程度の重症である。したがって、圧倒的多数の人はCOVID-19によるリスクを負っておらず、自己防衛のためのワクチン接種を必要としていない。
6. 重度の感染症にかかりやすい人では、Covid-19は治療可能な病気である。既存の薬剤を用いた早期治療により、入院率が約85%、死亡率が約75%減少することが多くのエビデンスから示されている[23-27]。これらの薬には、抗炎症薬、抗ウイルス薬、抗凝固薬、モノクローナル抗体、亜鉛、ビタミンC、Dなど、多くの実績のある薬が含まれている。産業界や政府は、選択的な研究支援 [24]、規制による偏見、さらには、このような治療法を自発的に使用しようとする医師に対する明白な制裁措置によって、このような実績のある治療法を傍観するという決定を下したが、これは既存の法律、標準的な医療行為、研究とはかけ離れたものであり、現実世界の証拠を考慮するという法的要件は道を踏み外してしまった [28]。このような効果的な治療法を組織的に否定・非難することで、「標準的に受け入れられる治療法がない」ことを要件とするワクチンの緊急使用許可の偽りの正当性を支えてきた [29]。平たく言えば、ワクチンは重篤な疾患を予防するためには必要ないということである。
2. それらのワクチンは有効性を欠如している
1. メカニズム的レベルでは、COVID-19のワクチン接種のように、抗体の誘導によってCOVID-19に対する免疫を獲得するという概念は、医学的にはナンセンスである。SARS-CoV-2のような空気感染するウイルスは、気道や肺を経由して体内に入るが、ここでは抗体濃度が低すぎて感染を防ぐことができない。ワクチンで作られた抗体は主に血液中を循環するが、肺や気道の粘膜では濃度が低い。COVID-19が主にこれらの粘膜に感染して拡散し、病気を引き起こすことを考えると、ワクチンは免疫学的には的外れである。ワクチンメーカーが各規制機関に提出した資料には、感染の連鎖を断ち切るために重要となる気道感染をワクチン接種によって防ぐという証拠は含まれていない。このように、COVID-19にとってワクチンは免疫学的に不適切なのである。
2. 中長期的なワクチンの有効性は不明である。フェーズ3の中期的な24ヶ月間の試験が終了するのは2023年である。COVID-19ワクチンの有効性に関する中期・長期の縦断的データはない。
3. 短期間のデータでは重症化の予防は確立されていない。欧州医薬品庁は、コミルナティ(ファイザー社のmRNA)ワクチンについて、COVID-19の重症化は「この研究ではまれであり、統計的に確実な結論は導き出せない」と指摘している[30]。同様に、FDAに提出されたファイザーの文書[31]では、死亡率に対する有効性は証明できなかったと結論づけている。このように、ワクチンは短期的にも死亡や重症化を防ぐことができないのである。
4. COVID-19に対する保護の相関関係は不明である。研究者は、COVID-19に対する保護を測定する方法をまだ確立していない。そのため、有効性に関する研究は暗中模索の状態にある。例えば、第1相と第2相の研究が終了した後、『Vaccine』誌に掲載された論文では、「防御の相関関係を理解しなければ、ワクチンによる防御、COVID-19の再感染のリスク、集団免疫、そしてヒト集団からのSARS-CoV-2の排除の可能性に関する疑問に現在対処することは不可能である」と指摘している[32]。このように、ワクチンの有効性を評価できないのは、その測定方法が確立されていないからである。
3. それらのワクチンは危険である
1. 喫煙が第一原理に基づいて肺がんを引き起こす可能性があり、それが予測されていたように、すべての遺伝子ベースのワクチンは、その分子的な作用メカニズムに基づいて、血液凝固や出血の障害を引き起こすことが予測される[33]。これと矛盾しないように、この種の疾患は年齢層を超えて観察されており、世界中でワクチンの一時的な中止が行われている-それらおワクチンは安全ではない。
2. ワクチン接種後の血液障害は「まれ」であるという主張に反して、多くの一般的なワクチンの副作用(頭痛、吐き気、嘔吐、全身の血腫のような「発疹」)は、血栓症やその他の重篤な異常を示す可能性がある。さらに、ワクチンによって誘発される肺のびまん性微小血栓症は、肺炎をまねくことがあり、COVID-19と誤診されることがある。現在メディアで注目されている血栓イベントは、「巨大な氷山の一角」に過ぎない可能性が高い [34] – それらのワクチンは安全ではない。
3. 免疫学的なプライミングにより、血液凝固、出血、その他の有害事象のリスクは、ワクチンを再接種したり、コロナウイルスにさらされたりするたびに増加すると予想される。数ヶ月、数年と時間が経つにつれ [35]、若くて健康な年齢層にとっては、ワクチン接種もコロナウイルスも危険なものとなってしまうが、ワクチンを接種しなければCOVID-19は実質的なリスクにはならない。
ワクチンが普及して以来、ワクチン接種率の高い多くの地域でCOVID-19の発生率が上昇している[36-38]。さらに、高齢者施設ではワクチン接種開始直後にCOVID-19による死亡事故が複数回発生している[39,40]。これらの事例は、抗体依存性の増強だけでなく、ワクチンの一般的な免疫抑制効果によるものかもしれない。このことは、特定の患者で帯状疱疹の発生が増加したことからも示唆されている[41]。免疫抑制により、以前は無症状だった感染症が臨床的に顕在化したのかもしれない。これらの報告された死亡例の原因となる正確なメカニズムにかかわらず、ワクチンはCOVID-19の致死率を低下させるのではなく、むしろ増加させると予想しなければならない-それらのワクチンは安全ではない。
4. このワクチンは、定義上、実験的なものである。2023年までは第3相試験が行われている。被験者は、ニュルンベルク条約や欧州評議会の決議2361[42]、FDAの緊急使用許可条件[29]などの保護のもと、自由なインフォームド・コンセントを受ける権利を有する。第1相および第2相試験の安全性データについては,当初はサンプル数が多かったにもかかわらず,雑誌『Vaccine』は,「さらなる開発のために選ばれたワクチン接種戦略は,わずか12人の参加者にしか行われなかったかもしれない」と報告している[32]。このようにサンプル数が極めて少ないことから,同誌は,安全性を確認するためには「より長期間にわたる大規模な第3相試験が必要である」と指摘している。2023年に向けて、全人口を対象とした第3相試験で評価されるべきリスクには、血栓症や出血異常だけでなく、その他の自己免疫反応、アレルギー反応、脂質ナノ粒子の未知のトロピズム(向性、組織への到達点)[35]、抗体依存性増強[43-46]、急がされ、疑問視され、規制されておらず[47]、報告されている一貫性のない製造方法の影響、管理されていないDNA残留物などの潜在的に有害な不純物のリスク[48]などがある。それらのワクチンは、接種者にとっても、それを投与する人や使用を許可する人にとっても、安全ではない。
5. 初期の経験では、アデノウイルス由来のワクチン(AstraZeneca/Johnson&Johnson)の方が、mRNAワクチン(Pfizer/Moderna)よりも副作用が大きいと思われるかもしれない。しかし、アデノウイルス由来のワクチンは、繰り返し注射することにより、アデノウイルスベクターのタンパク質に対する抗体が形成される。この抗体は、ワクチンウイルス粒子の大部分を中和し、細胞に感染する前に廃棄してしまうため、組織障害の強度を抑えることができる。
一方、mRNAワクチンでは、抗体が認識するタンパク質抗原がない。そのため、免疫力の有無にかかわらず、ワクチンのmRNAは標的である体細胞に到達する。そして、体細胞はスパイクタンパク質を発現し、その後、免疫システムの猛攻撃を受けることになる。mRNAワクチンでは、重篤な有害事象が発生するリスクは、注射を繰り返すたびにほぼ確実に増加する。したがって、長期的にはベクターワクチンよりも危険なワクチンといえる。これらのワクチンは安全ではない。
4. 倫理・法律上の留意点
1. ワクチンを推奨・推進する一方で、代替戦略(自然免疫への依存や早期治療)を非難する科学文献や組織には、利益相反が多く存在している。当局、医師、医療関係者は、利益相反に関する情報源を極めて注意深く評価することで、自らを守る必要がある。
2. 当局、医師、医療関係者は、ワクチンの必要性、安全性、有効性に関する信頼できる独立した文献を無視しないよう、同様に注意する必要がある。なぜなら、ワクチン接種キャンペーンを中止しない限り、予測される大量の死や害があるからである。
3. ワクチンメーカーが有害事象に対する法的責任を免除されているのには理由がある。ワクチンによる死亡や被害が発生した場合、責任を負うのはワクチンの認可、投与、ワクチンパスポートによる強制などの責任者であり、これらは冷静な証拠に基づくリスク・ベネフィット分析では正当化できない。
4. COVID-19の接種に関わるすべての政治・規制・医療関係者は、自らを守るために、ニュルンベルクコードやその他の法規定に精通すべきである。
References
1. Le Bert, N.; Tan, A.T.; Kunasegaran, K.; Tham, C.Y.L.; Hafezi, M.; Chia, A.; Chng, M.H.Y.; Lin, M.; Tan, N.; Linster, M.; Chia, W.N.; Chen, M.I.; Wang, L.; Ooi, E.E.; Kalimuddin, S.; Tambyah, P.A.; Low, J.G.; Tan, Y. and Bertoletti, A. (2020) SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 584:457–462
2. Tarke, A.; Sidney, J.; Methot, N.; Zhang, Y.; Dan, J.M.; Goodwin, B.; Rubiro, P.; Sutherland, A.; da Silva Antunes, R.; Frazier, A. and al., e. (2021) Negligible impact of SARS-CoV-2 variants on CD4+ and CD8+ T cell reactivity in COVID-19 exposed donors and vaccinees. bioRxiv -:x-x
3. Anonymous, (2020) Scientists uncover SARS-CoV-2-specific T cell immunity in recovered COVID-19 and SARS patients.
4. Beasley, D. (2020) Scientists focus on how immune system T cells fight coronavirus in absence of antibodies.
5. Bozkus, C.C. (2020) SARS-CoV-2-specific T cells without antibodies. Nat. Rev. Immunol. 20:463
6. Grifoni, A.; Weiskopf, D.; Ramirez, S.I.; Mateus, J.; Dan, J.M.; Moderbacher, C.R.; Rawlings, S.A.; Sutherland, A.; Premkumar, L.; Jadi, R.S. and al., e. (2020) Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 181:1489–1501.e15
7. Mateus, J.; Grifoni, A.; Tarke, A.; Sidney, J.; Ramirez, S.I.; Dan, J.M.; Burger, Z.C.; Rawlings, S.A.; Smith, D.M.; Phillips, E. and al., e. (2020) Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. Science 370:89–94
8. McCurry-Schmidt, M. (2020) Exposure to common cold coronaviruses can teach the immune system to recognize SARS-CoV-2.
9. Palmer, S.; Cunniffe, N. and Donnelly, R. (2021) COVID-19 hospitalization rates rise exponentially with age, inversely proportional to thymic T-cell production. J. R. Soc. Interface 18:20200982
10. Sekine, T.; Perez-Potti, A.; Rivera-Ballesteros, O.; Strålin, K.; Gorin, J.; Olsson, A.; Llewellyn-Lacey, S.; Kamal, H.; Bogdanovic, G.; Muschiol, S. and al., e. (2020) Robust T Cell Immunity in Convalescent Individuals with Asymptomatic or Mild COVID-19. Cell 183:158–168.e14
11. Drake, J. (2021) Now We Know: Covid-19 Vaccines Prevent Asymptomatic Infection, Too.
12. Bossuyt, P.M. (2020) Testing COVID-19 tests faces methodological challenges. Journal of clinical epidemiology 126:172–176
13. Jefferson, T.; Spencer, E.; Brassey, J. and Heneghan, C. (2020) Viral cultures for COVID-19 infectivity assessment. Systematic review. Clin. Infect. Dis. ciaa1764:x-x
14. Borger, P.; Malhotra, R.K.; Yeadon, M.; Craig, C.; McKernan, K.; Steger, K.; McSheehy, P.; Angelova, L.; Franchi, F.; Binder, T.; Ullrich, H.; Ohashi, M.; Scoglio, S.; Doesburg-van Kleffens, M.; Gilbert, D.; Klement, R.J.; Schrüfer, R.; Pieksma, B.W.; Bonte, J.; Dalle Carbonare, B.H.; Corbett, K.P. and Kämmer, U. (2020) External peer review of the RTPCR test to detect SARS-CoV-2 reveals 10 major scientific flaws at the molecular and methodological level: consequences for false positive results.
15. Mandavilli, A. (2020) Your Coronavirus Test Is Positive. Maybe It Shouldn’t Be.
16. Cao, S.; Gan, Y.; Wang, C.; Bachmann, M.; Wei, S.; Gong, J.; Huang, Y.; Wang, T.; Li, L.; Lu, K.; Jiang, H.; Gong, Y.; Xu, H.; Shen, X.; Tian, Q.; Lv, C.; Song, F.; Yin, X. and Lu, Z. (2020) Post-lockdown SARS-CoV-2 nucleic acid screening in nearly ten million residents of Wuhan, China. Nat. Commun. 11:5917
17. Moghadas, S.M.; Fitzpatrick, M.C.; Sah, P.; Pandey, A.; Shoukat, A.; Singer, B.H. and Galvani, A.P. (2020) The implications of silent transmission for the control of COVID-19 outbreaks. Proc. Natl. Acad. Sci. U. S. A. 117:17513–17515
18. Johansson, M.A.; Quandelacy, T.M.; Kada, S.; Prasad, P.V.; Steele, M.; Brooks, J.T.; Slayton, R.B.; Biggerstaff, M. and Butler, J.C. (2021) SARS-CoV-2 Transmission From People Without COVID-19 Symptoms. JAMA network open 4:e2035057
19. Yeadon, M. (2020). What SAGE got wrong. Lockdown Skeptics.
20. Ioannidis, J.P.A. (2020) Global perspective of COVID‐19 epidemiology for a full‐cycle pandemic. Eur. J. Clin. Invest. 50:x-x
21. Ioannidis, J.P.A. (2021) Reconciling estimates of global spread and infection fatality rates of COVID‐19: An overview of systematic evaluations. Eur. J. Clin. Invest. -:x-x
22. CDC, (2020) Science Brief: Community Use of Cloth Masks to Control the Spread of SARS-CoV-2.
23. Orient, J.; McCullough, P. and Vliet, E. (2020) A Guide to Home-Based COVID Treatment.
24. McCullough, P.A.; Alexander, P.E.; Armstrong, R.; Arvinte, C.; Bain, A.F.; Bartlett, R.P.; Berkowitz, R.L.; Berry, A.C.; Borody, T.J.; Brewer, J.H.; Brufsky, A.M.; Clarke, T.; Derwand, R.; Eck, A.; Eck, J.; Eisner, R.A.; Fareed, G.C.; Farella, A.; Fonseca, S.N.S.; Geyer, C.E.; Gonnering, R.S.; Graves, K.E.; Gross, K.B.V.; Hazan, S.; Held, K.S.; Hight, H.T.; Immanuel, S.; Jacobs, M.M.; Ladapo, J.A.; Lee, L.H.; Littell, J.; Lozano, I.; Mangat, H.S.; Marble, B.; McKinnon, J.E.; Merritt, L.D.; Orient, J.M.; Oskoui, R.; Pompan, D.C.; Procter, B.C.; Prodromos, C.; Rajter, J.C.; Rajter, J.; Ram, C.V.S.; Rios, S.S.; Risch, H.A.; Robb, M.J.A.; Rutherford, M.; Scholz, M.; Singleton, M.M.; Tumlin, J.A.; Tyson, B.M.; Urso, R.G.; Victory, K.; Vliet, E.L.; Wax, C.M.; Wolkoff, A.G.; Wooll, V. and Zelenko, V. (2020) Multifaceted highly targeted sequential multidrug treatment of early ambulatory high-risk SARS-CoV-2 infection (COVID-19). Reviews in cardiovascular medicine 21:517–530
25. Procter, {.B.C.; {APRN}, {.C.R.{.; {PA}-C, {.V.P.; {PA}-C, {.E.S.; {PA}-C, {.C.H. and McCullough, {.{.P.A. (2021) Early Ambulatory Multidrug Therapy Reduces Hospitalization and Death in High-Risk Patients with SARS-CoV-2 (COVID-19). International journal of innovative research in medical science 6:219–221
26. McCullough, P.A.; Kelly, R.J.; Ruocco, G.; Lerma, E.; Tumlin, J.; Wheelan, K.R.; Katz, N.; Lepor, N.E.; Vijay, K.; Carter, H.; Singh, B.; McCullough, S.P.; Bhambi, B.K.; Palazzuoli, A.; De Ferrari, G.M.; Milligan, G.P.; Safder, T.; Tecson, K.M.; Wang, D.D.; McKinnon, J.E.; O’Neill, W.W.; Zervos, M. and Risch, H.A. (2021) Pathophysiological Basis and Rationale for Early Outpatient Treatment of SARS-CoV-2 (COVID-19) Infection. Am. J. Med. 134:16–22
27. Anonymous, (2020) Real-time database and meta analysis of 588 COVID-19 studies.
28. Hirschhorn, J.S. (2021) COVID scandal: Feds ignored 2016 law requiring use of real world evidence.
29. Anonymous, (1998) Emergency Use of an Investigational Drug or Biologic: Guidance for Institutional Review Boards and Clinical Investigators.
30. Anonymous, (2021) EMA assessment report: Comirnaty.
31. Anonymous, (2020) FDA briefing document: Pfizer-BioNTech COVID-19 Vaccine.
32. Giurgea, L.T. and Memoli, M.J. (2020) Navigating the Quagmire: Comparison and Interpretation of COVID-19 Vaccine Phase 1/2 Clinical Trials. Vaccines 8:746
33. Bhakdi, S.; Chiesa, M.; Frost, S.; Griesz-Brisson, M.; Haditsch, M.; Hockertz, S.; Johnson, L.; Kämmerer, U.; Palmer, M.; Reiss, K.; Sönnichsen, A.; Wodarg, W. and Yeadon, M. (2021) Urgent Open Letter from Doctors and Scientists to the European Medicines Agency regarding COVID-19 Vaccine Safety Concerns.
34. Bhakdi, S. (2021) Rebuttal letter to European Medicines Agency from Doctors for Covid Ethics, April 1, 2021.
35. Ulm, J.W. (2020) Rapid response to: Will covid-19 vaccines save lives? Current trials aren’t designed to tell us.
36. Reimann, N. (2021) Covid Spiking In Over A Dozen States — Most With High Vaccination Rates.
37. Meredith, S. (2021) Chile has one of the world’s best vaccination rates. Covid is surging there anyway.
38. Bhuyan, A. (2021) Covid-19: India sees new spike in cases despite vaccine rollout. BMJ 372:n854
39. Morrissey, K. (2021) Open letter to Dr. Karina Butler.
40. Anonymous, (2021) Open Letter from the UK Medical Freedom Alliance: Urgent warning re Covid-19 vaccine-related deaths in the elderly and Care Homes.
41. Furer, V.; Zisman, D.; Kibari, A.; Rimar, D.; Paran, Y. and Elkayam, O. (2021) Herpes zoster following BNT162b2 mRNA Covid-19 vaccination in patients with autoimmune inflammatory rheumatic diseases: a case series. Rheumatology -:x-x
42. Anonymous, (2021) Covid-19 vaccines: ethical, legal and practical considerations.
43. Tseng, C.; Sbrana, E.; Iwata-Yoshikawa, N.; Newman, P.C.; Garron, T.; Atmar, R.L.; Peters, C.J. and Couch, R.B. (2012) Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS One 7:e35421
44. Bolles, M.; Deming, D.; Long, K.; Agnihothram, S.; Whitmore, A.; Ferris, M.; Funkhouser, W.; Gralinski, L.; Totura, A.; Heise, M. and Baric, R.S. (2011) A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge. J. Virol. 85:12201–15
45. Weingartl, H.; Czub, M.; Czub, S.; Neufeld, J.; Marszal, P.; Gren, J.; Smith, G.; Jones, S.; Proulx, R.; Deschambault, Y.; Grudeski, E.; Andonov, A.; He, R.; Li, Y.; Copps, J.; Grolla, A.; Dick, D.; Berry, J.; Ganske, S.; Manning, L. and Cao, J. (2004) Immunization with modified vaccinia virus Ankara-based recombinant vaccine against severe acute respiratory syndrome is associated with enhanced hepatitis in ferrets. J. Virol. 78:12672–6
46. Czub, M.; Weingartl, H.; Czub, S.; He, R. and Cao, J. (2005) Evaluation of modified vaccinia virus Ankara based recombinant SARS vaccine in ferrets. Vaccine 23:2273–9
47. Tinari, S. (2021) The EMA covid-19 data leak, and what it tells us about mRNA instability. BMJ 372:n627
48. Anonymous, (2021) Interview with Dr. Vanessa Schmidt-Krüger.
More from Doctors for Covid Ethics
We are doctors and scientists from 30 countries, seeking to uphold medical ethics, patient safety and human rights in response to COVID-19. t: @Drs4CovidEthics


















https://rapt-plusalpha.com/international/post-8935/
現在、インドでは毎日30万人以上のコロナ感染者が出ており、累計感染者数は1900万人以上に上るとのことです。
過去の記事でも、インドが創価学会によるコロナ茶番に加担してコロナ感染者数を改竄し、パンデミックを演出していることについて述べました。
○【創価・BRICS】インド、新規コロナ感染者が3日で100万人を上回る
この改竄報道はますます加熱し、「実際の感染者数は5億人を超えている可能性がある」とまで報道されています。
しかも、コロナによる死亡者が続出し、火葬場が足りない状況に陥っているとまで報道されています。
これまで歴史的なパンデミックが起こったときには必ず「ユダヤ人が井戸などの水源に毒を混ぜた」という目撃証言が残されています。