PMDA 体外診断用医薬品
「体外診断用医薬品の製造販売承認申請について」
PDF形式平成17年2月16日 薬食発第0216004 号通知
「体外診断用医薬品の製造販売承認申請に際し留意すべき事項について」
PDF形式平成17年2月16日 薬食機発第0216005号通知【H19.2.21薬食機発第0221001号通知にて一部改正】
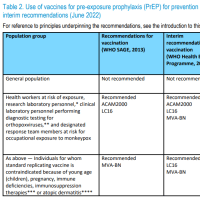
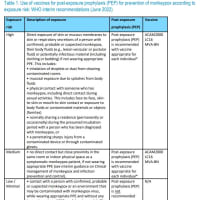
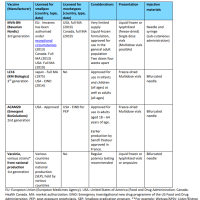
ト) 臨床試験の試験成績に関する資料
1) 臨床性能試験成績に関する資料
・「臨床性能試験の試験成績に関する資料」とは、体外診断用医薬品のうち人の身体に
直接使用されないものに関しての臨床試験の試験成績に関する資料であること。
・施設及び検体数は、原則として2施設以上150検体(正常範囲の検体も含む。)以上と
する。なお、検体数については、統計学的に解析が可能で臨床的に充分評価できるも
のであれば、この限りではない。
・資料の作成に当たっては、対象疾患又は病態、疾患との関連における有病正診率及び
無病正診率、異常検体(溶血、乳び、黄疸等)及び薬物投与による影響に留意するこ
と。
・外国で実施された臨床性能試験成績を活用することは原則可能であるが、日本人と外
国人の人種的な差並びに日本と外国の環境因子及び医療実態の差等が当該体外診断用
医薬品の性能、臨床的意義に与える影響を考慮し判断すること。
・新規項目以外の場合には、原則、臨床性能試験成績に関する資料の添付は要さない。
ただし、新たな臨床的意義が生じた場合にはこの限りではない。