WER 18 July 2014, vol. 89, 29 (pp. 321–336) Global Advisory Committee on Vaccine Safety, 11–12 June 2014
新規のロタウイルス弱毒化生ワクチンの安全性について
Rotavacは2014年1月にインドで承認されたワクチンであり、2015年にはWHOの事前資格審査を受けて国際機関に1米ドルで供給される見込み。
ワクチン抗原は1988年にインドの研究所で無症候性の幼児から分離された、ウシのsegment (G9P) を含む自然に弱毒化されたヒトの新生児のウイルス株に由来する。
ウイルス株はインドと米国の研究者によって精査され、安全性の研究が米国のシンシナティで成人と子供に実施された。
2000年には、ウイルス株はBharat Biotech Internationalにライセンス化され、その後、インドにおいて第1-3層の臨床試験が実施された。
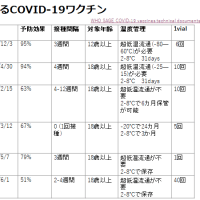
現行のワクチン製剤はマイナス20℃で保管する必要があるが、この製品は2-8℃で最大6か月保管できる。
他にもいくつかの異なる点があるが、最も大きな違いは1バイアルに5回分の含まれていることがあげられる(開封から8時間以内に使用する必要がある)。
Bharat Biotechによると3億回分のRotavacを生産する体制が確立しているとのこと。
第3層無作為二重盲検試験が実施され、監視のもと4532例の乳児のうち2267例がプラセボ薬を投与された。
研究は定期接種と並行して実施され、研究参加者は2歳まで経過観察された。
Rotavacとプラセボ接種群間に死亡症例や腸重積を含む有害事象に関して差異を認めなかった。
11例の腸重積例が認められたが、予防接種から直近に発生は認められず、最も早期の発症においても3回目のプラセボ接種から36日後と3回目のRotavac接種から112日後の発症であった。
多くのロタウイルスワクチン接種後の腸重積は接種から1週間以内に発生するとされることから、Rotavacと腸重積との因果関係は時間的な関連性の欠如から否定される。
観察された腸重積の発生頻度はワクチン接種群での10万人年当たり94例(95%CI 41-185)で、プラセボ接種群の頻度71(95%CI 15-206)との差は認めず、予防接種を実施していない状態においての調査で認められる頻度と同等であった。
安全性のデータにより、予防接種によりさらなる検討を行うことが支持され、市販後調査では少なくとも4万5千人の接種者で検討が実施される予定である。
しかしながら、これまでのワクチンと同様に、追加情報を継続的に収集することにより、腸重積のリスクを評価するだけでなく、他に生じうる稀な有害事象を同定することも重要となる。
これまでのロタウイルスワクチンの経験から、インドに既存の定点調査の基盤が、新たなロタウイルスワクチンの安全性をより明らかにするための継続的な腸重積の調査のために活用されるべきである。