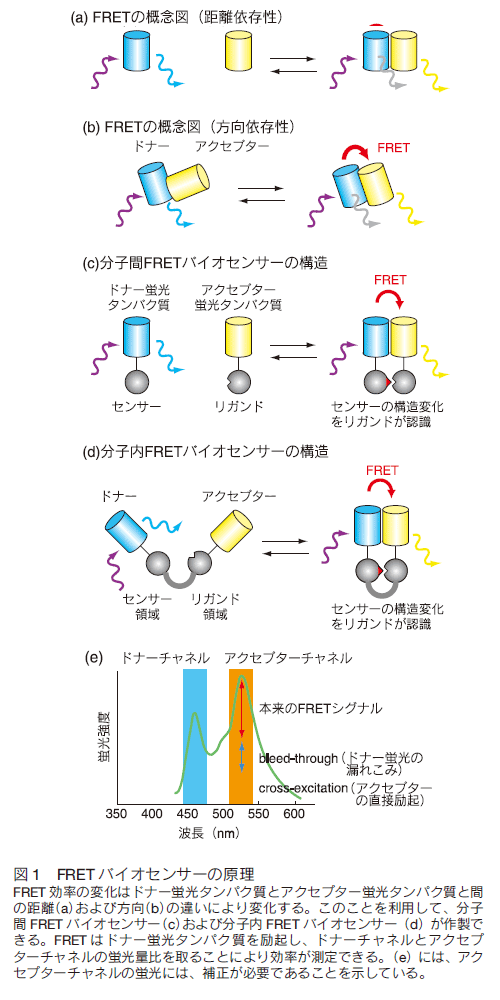
このサイトにもあるように、ImageJで等高線表示(Contour plot)をするには、
1)Image->Adjust->Threshold
2)Plugins->Contour->Yawi2D
3)Plugins->Contour->Contour Plotter
4)Plugins->Contour->IsoPhotContour
の4つの方法があるらしいが、一番有名なものはContour Plotterというもの。
このインストールは非常に簡単で、ソースのJarファイルをダウンロードして、ImageJのフォルダの中にあるPluginsフォルダにいれ、ImageJを立ち上げなおすと、Pluginツールバーの中にContour Plotterメニューがでてくる。
これは手軽に等高線表示できるのだが、問題はその画像をどうやってもセーブできないこと。
セーブするには、IsoPhotContour(グレースケール)もしくはIsoPhotContour2(マルチカラー)というPluginsを使うと便利である。
ダウンロードはG.Landiniさんのサイトから行う。例えばIsoPhotContour2はこのZIPファイルをダウンロード、解凍して中身をImageJのフォルダの中にあるPluginsフォルダに入れるとインストールができる。
ちなみに以前使った徳島大学のオープンキャンパスのサンプルCT画像を等高線表示し見ると、
(元画像)
(等高線のオーバーレイ)
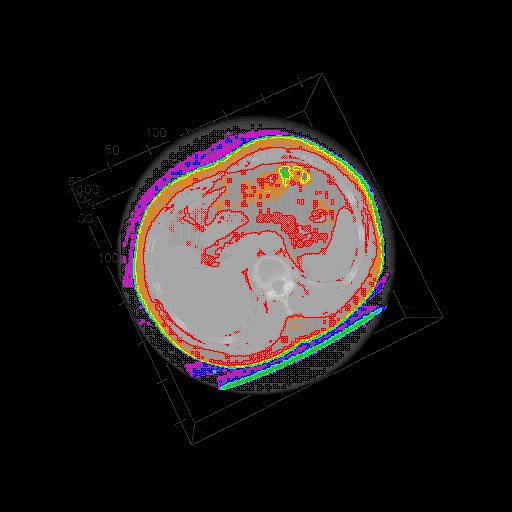
となる。あまりわかりよい図でないので恐縮ですが。。
お試しあれ。
1)Image->Adjust->Threshold
2)Plugins->Contour->Yawi2D
3)Plugins->Contour->Contour Plotter
4)Plugins->Contour->IsoPhotContour
の4つの方法があるらしいが、一番有名なものはContour Plotterというもの。
このインストールは非常に簡単で、ソースのJarファイルをダウンロードして、ImageJのフォルダの中にあるPluginsフォルダにいれ、ImageJを立ち上げなおすと、Pluginツールバーの中にContour Plotterメニューがでてくる。
これは手軽に等高線表示できるのだが、問題はその画像をどうやってもセーブできないこと。
セーブするには、IsoPhotContour(グレースケール)もしくはIsoPhotContour2(マルチカラー)というPluginsを使うと便利である。
ダウンロードはG.Landiniさんのサイトから行う。例えばIsoPhotContour2はこのZIPファイルをダウンロード、解凍して中身をImageJのフォルダの中にあるPluginsフォルダに入れるとインストールができる。
ちなみに以前使った徳島大学のオープンキャンパスのサンプルCT画像を等高線表示し見ると、
(元画像)

(等高線のオーバーレイ)

となる。あまりわかりよい図でないので恐縮ですが。。
お試しあれ。