フェンフルラミン(商品名:フィンテプラ Fintepla)が米国FDAで承認されました。
FDA Approves New Therapy for Dravet Syndrome
下記は、日本語記事が医療従事者用で登録が必要であるため、内容を転載。
薬物分類のスケジュールⅣ(麻薬指定)に区分され、リスク評価およびリスク軽減戦略(REMS)が適用される。
発作の頻度が大幅に低下
ドラベ症候群は1歳までに発症することが多いまれで重篤なてんかんの形態で、治療を行っても重度の痙攣発作を繰り返す。1歳を過ぎると他のてんかん発作を合併することもある。多くの場合、てんかん治療薬の効果は十分ではない。
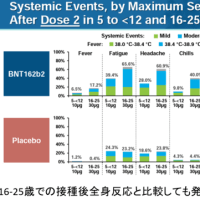
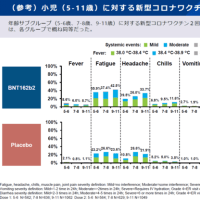
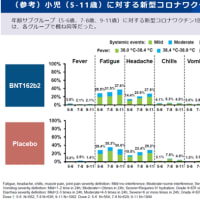
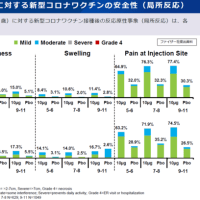
ドラベ症候群に対するフェンフルラミンの効果は、202例(2〜18歳)を対象に痙攣発作頻度のベースラインからの変化を調べた2件の臨床試験で実証された。いずれの試験でもプラセボ群と比べフェンフルラミン群で発作頻度が大幅に低下した。発作頻度の低下はベースラインから3〜4週間以内に見られ、その効果は14〜15週間の治療期間を通じておおむね一定であった。一般的な有害事象は主に食欲低下であった。
フェンフルラミンは心臓弁膜症(VHD)および肺高血圧(PAH)リスクと関連するため、同薬のラベルには黒枠警告が表示される。これらのリスクのため、患者は治療前、治療中6カ月ごと、治療後3〜6カ月に1回、心エコーにより心臓モニタリングを行う必要がある。心エコーでVHD、PAHまたはその他の心臓異常の徴候が見られたには、継続治療のベネフィット・リスクを考慮する必要がある。
REMSプログラム下でのみ使用可能
VHDおよびPAHのリスクがあるため、fenfluramineの使用は制限されており、REMSプログラムの下でのみ使用が可能となる。また、REMS要件の一部として処方者と患者は同薬の処方のために必要な心エコー検査を遵守する必要がある。
FDA医薬品評価研究センター(CDER)神経科学部門部長のBilly Dunn氏は「ドラベ症候群は消耗性疾患で、患者と家族の双方に大きな社会的影響を与える。フェンフルラミンは同症候群に関連する発作に対する効果的な治療オプションになりうる」と述べている。
尚、毎年6月23日は世界各国で「ドラベ症候群の日」とされている。日本でもドラベ症候群患者家族会が制定し、2017年に日本記念日協会の認定を受けている。
関連記事