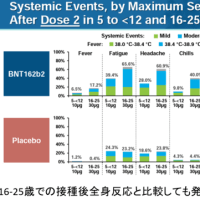
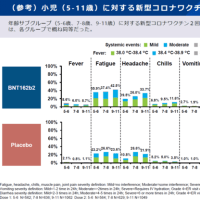
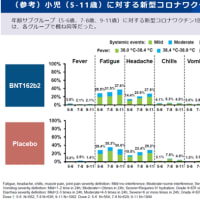
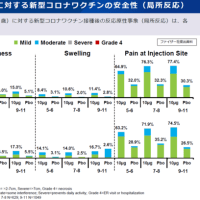
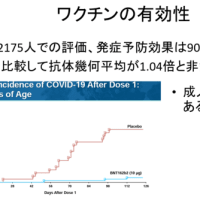
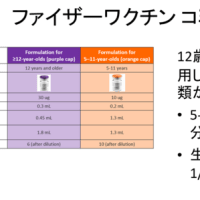
国内でもドラベ症候群の新薬である低用量塩酸フェンフルラミンの臨床第三相治験を実施中
独占販売権の契約で支払額は約2000万ドル、既に米国のFDA及び欧州のEMAに承認申請を提出済みであり、EMAの審査は2020年第1四半期に結果を得られる見込み。
Zogenix Enters Exclusive Distribution Agreement with Nippon Shinyaku for FINTEPLA® in Japan
日本新薬は3月19日、米Zogenix社が日本で難治性てんかんを対象に開発している「ZX008」の国内独占販売契約を締結としたと発表した。予定する適応症はドラベ症候群、レノックス・ガストー症候群で、いずれも指定難病。治療法が限られる中、新たな治療薬の提供を目指す。日本新薬によると、日本ではZogenix社がフェーズ3を始めたばかりで、これから被験者登録を進める。
いずれの疾患も乳幼児期から発症することが知られている。治験では2歳以上の患者を対象に実施しており、小児から成人まで使える治療薬として開発が進められているという。経口の液剤。日本での承認申請のめどは未定。日本新薬は、開発中のデュシェンヌ型筋ジストロフィ治療薬に続き、注力する神経・筋疾患領域への取り組みの一環で導入した。
Zogenix 社は。ドラベ症候群に伴う発作の治療薬として欧米で承認申請中。レノックス・ガストー症候群に対しては国際フェーズ3を実施中で、日本では両疾患を対象に治験を進めていた。Zogenix 社の社長兼CEOのスティーブン・ファー氏は「希少疾病治療領域における日本新薬の専門性と取り組みを考慮し、日本における本剤の戦略的販売パートナーとしてふさわしいと考えた」としている。
関連ブログ内記事: