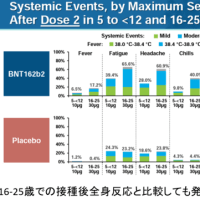
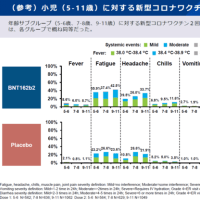
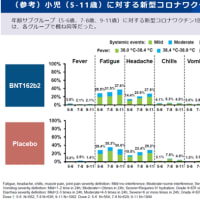
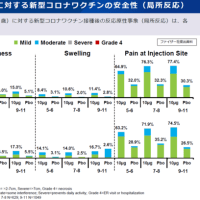
フェンフルラミンが日本で承認申請されたので記事内容を紹介します。
米ゾジェニックス ドラベ症候群に伴うてんかん発作治療薬フェンフルラミン、日本で承認申請
希少疾患治療薬の開発・商業化を行う米国ゾジェニックス社は12月22日、ドラベ症候群に伴うてんかん発作の治療薬フェンフルラミン(一般名、開発コード:ZX008)について、日本で承認申請したと発表した。同剤は、今回申請した適応症で、厚労省から希少疾病用医薬品に指定されている。
ドラベ症候群は、生涯継続する重度の希少てんかんの一種。一般的には乳幼児期に発症し、頻発する治療抵抗性の発作、頻回の入院や救急医療の必要性、重大な発達障害、運動障害、行動障害、てんかんにおける予期せぬ突然死のリスク上昇という特徴がある。ほとんどの患者は認知障害、運動障害、行動障害を伴う発達遅滞の経過をたどり、成人期まで持続する。国内推定患者数は約3000人。
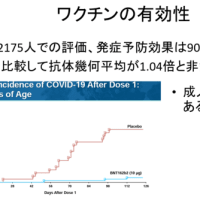
今回の申請は、既存の抗てんかん薬では発作が十分にコントロールできないドラベ症候群の小児および若年成人患者143人を対象とした、日本を含む国際共同無作為化二重盲検プラセボ対照第3相臨床試験の結果に基づく。同試験では、フェンフルラミン0.7mg/kg/日群はプラセボ群と比較して、けいれん発作頻度が月平均で64.8%の減少(p<0.0001)が認められ、主要評価項目を達成した。安全性については、忍容性は「概ね良好」で、既知の安全性プロファイルと同様だったとしている。
ゾジェニックスのステファンJ・ファー社長兼CEOは、「ドラベ症候群の治療環境は、実質的に効果のある治療ニーズが世界的に依然として満たされていない状況で、日本も例外ではない」との認識を示した。そして、「患者さんは難治性の発作が続き、彼らの生活の質に著しい負担と悪影響をもたらしている」とし、「私たちは、この希少かつ乳幼児期に発症する難治性の高いてんかんを抱える日本の患者さんに本剤を有望な治療選択肢として推進し、使用できるように尽力していく」とコメントしている。
◎承認取得後 日本新薬が商業化
同社は2019年3月に、日本新薬との間で、ドラベ症候群とレノックス・ガストー症候群を対象疾患に日本国内の独占的販売契約を締結している。同剤の承認取得後は、日本新薬が日本で商業化する。
フェンフルラミンはセロトニン作動薬として5-HT1D、5-HT2A、5-HT2C受容体に対するアゴニスト活性を示すセロトニンを強力に放出し、また、Sigma1受容体のポジティブモジュレーターとして作用し発作を抑制する二重活性を有する。ドラベ症候群に伴う発作の治療薬として米国、欧州で承認されている。
ドラベ症候群は、生涯継続する重度の希少てんかんの一種。一般的には乳幼児期に発症し、頻発する治療抵抗性の発作、頻回の入院や救急医療の必要性、重大な発達障害、運動障害、行動障害、てんかんにおける予期せぬ突然死のリスク上昇という特徴がある。ほとんどの患者は認知障害、運動障害、行動障害を伴う発達遅滞の経過をたどり、成人期まで持続する。国内推定患者数は約3000人。
今回の申請は、既存の抗てんかん薬では発作が十分にコントロールできないドラベ症候群の小児および若年成人患者143人を対象とした、日本を含む国際共同無作為化二重盲検プラセボ対照第3相臨床試験の結果に基づく。同試験では、フェンフルラミン0.7mg/kg/日群はプラセボ群と比較して、けいれん発作頻度が月平均で64.8%の減少(p<0.0001)が認められ、主要評価項目を達成した。安全性については、忍容性は「概ね良好」で、既知の安全性プロファイルと同様だったとしている。
ゾジェニックスのステファンJ・ファー社長兼CEOは、「ドラベ症候群の治療環境は、実質的に効果のある治療ニーズが世界的に依然として満たされていない状況で、日本も例外ではない」との認識を示した。そして、「患者さんは難治性の発作が続き、彼らの生活の質に著しい負担と悪影響をもたらしている」とし、「私たちは、この希少かつ乳幼児期に発症する難治性の高いてんかんを抱える日本の患者さんに本剤を有望な治療選択肢として推進し、使用できるように尽力していく」とコメントしている。
◎承認取得後 日本新薬が商業化
同社は2019年3月に、日本新薬との間で、ドラベ症候群とレノックス・ガストー症候群を対象疾患に日本国内の独占的販売契約を締結している。同剤の承認取得後は、日本新薬が日本で商業化する。
フェンフルラミンはセロトニン作動薬として5-HT1D、5-HT2A、5-HT2C受容体に対するアゴニスト活性を示すセロトニンを強力に放出し、また、Sigma1受容体のポジティブモジュレーターとして作用し発作を抑制する二重活性を有する。ドラベ症候群に伴う発作の治療薬として米国、欧州で承認されている。
関連記事