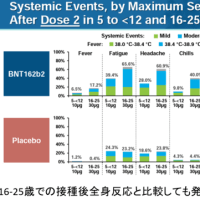
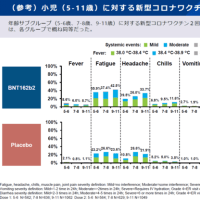
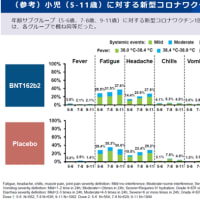
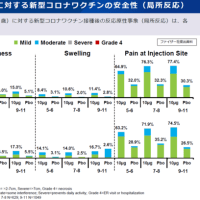
セレニカR 顆粒40%のインタビューフォームより抜粋
一般名
和名:バルプロ酸ナトリウム
洋名:Sodium Valproate
製造販売承認年月日:2005 年9 月15 日(販売名変更に伴う再承認)
薬価基準収載年月日:2005 年12 月16 日(変更銘柄名での収載日)
発売年月日:1991 年12 月6 日(興和発売日)1999 年7 月14 日(田辺三菱製薬発売日)
製造販売元:興和株式会社
販売:田辺三菱製薬株式会社
プロモーション提携:吉富薬品株式会社
開発の経緯
バルプロ酸ナトリウムは,1963 年にH.Meunierによって抗痙攣作用が確認され,各種てんかん発作に広範な抑制作用を有する薬剤として本邦においても古くから製剤化されている。
バルプロ酸の有効血中濃度は,個体差があるものの一般に40 ~ 120mg/mL とされているが,経口投与による生物学的半減期は,他の抗てんかん薬と比較すると短い。
また,疾病の性質上,抗てんかん薬は長期投与が必要となり,就学中の患者又は有職患者にとっては,昼の服薬は精神的負担が大きく,結果的にてんかん患者のコンプライアンス(服薬履行)は,必ずしもよくないといわれている。
以上の問題を考慮し,小児から高齢者注1)までの広範囲の患者に服薬しやすく,1日1 回投与で有効血中濃度を維持可能とした膜制御拡散型徐放性顆粒剤「セレニカR 顆粒40%注」が開発され,1991 年9 月に承認を得た。
また,小学校就学児童から高齢者までの患者の服用を想定して1 日1 回投与で,可能な限り小さい錠剤の開発に着手し,2004 年2 月に膜制御型徐放性錠剤「セレニカR 錠200mg」の承認を得た。
さらに,1 錠中に含有する有効成分量を増やすことにより服薬錠数を減らすことは,20 歳以上の患者にとって大きな長所になると考えた。そして,セレニカR 錠200mg と生物学的に同等の溶出性を示す錠剤の開発に着手し,2006 年2月に1 錠中にバルプロ酸ナトリウムを400mg 含有する「セレニカR 錠400mg」の承認を得た。
一方,バルプロ酸は,米国,英国,仏国等諸外国において双極性障害の躁状態治療の第一選択薬としてリチウムとともに使用され,欧米各国(フランス1977 年,米国1995 年,英国2000 年ほか)で認可された。
同様に,バルプロ酸は,欧米において片頭痛の予防の標準薬の一つに位置づけられており,米国では1996 年に認可された。
そのため本邦においても,1999 年2 月1 日付厚生省通知「適応外使用に係る医療用医薬品の取扱いについて(研第4 号・医薬審第104 号)」に基づいて,「躁病および躁うつ病の躁状態の治療」の効能・効果が2002 年9 月に,「片頭痛発作の発症抑制」の効能・効果が公知申請により2011 年6 月にそれぞれ追加承認された。
製品の治療学的・製剤学的特性
(1)セレニカR 顆粒40%及びセレニカR 錠200mg・400mg はバルプロ酸ナトリウムの徐放性製剤(二重コーティングによる膜制御型)であり,1 日1 回投与で有効血中濃度(40~ 120mg/mL)の維持が期待できる。
1)セレニカR 顆粒40%は世界初のバルプロ酸ナトリウム徐放性顆粒であり,年齢,体重,症状にあわせた投与量の細かい調整が可能で,TDM に適している。
2)セレニカR 錠200mg は服用感を考慮したコンパクトな徐放性錠剤である。
3)セレニカR 錠400mg は国内初のバルプロ酸ナトリウム400mg 含有徐放性錠剤である。
(2)セレニカR 顆粒40%及びセレニカR 錠200mg は各種てんかん※患者を対象とした臨床試験により有効性が示されている。
※ 効能・効果(抜粋):各種てんかん(小発作・焦点発作・精神運動発作ならびに混合発作)およびてんかんに伴う性格行動障害(不機嫌・易怒性等)の治療。
1)セレニカR 顆粒40%は各種てんかん患者76 例を対象とした臨床試験において,発作改善度,行動ならびに精神症状改善度,EEG(脳波)改善度を勘案した全般改善度74.5%を示した。
2)セレニカR 錠200mg と顆粒40%は各種てんかん患者49 例を対象とした無作為化クロスオーバー比較臨床試験により,有効性,安全性に有意差はなく同等の有用性が示された。
(3)セレニカR 顆粒40%及びセレニカR 錠200mg・400mg は「躁病および躁うつ病の躁状態」,「片頭痛発作の発症抑制」にも効能・効果を有する。
1999 年2 月1 日付厚生省通知「適応外使用に係る医療用医薬品の取扱いについて(研第4 号・医薬審第104 号)」に基づいて「躁病および躁うつ病の躁状態の治療」及び「片頭痛発作の発症抑制」の効能・効果が追加承認された。
(4)副作用発現状況については以下のとおりである。
○ 各種てんかんおよびてんかんに伴う性格行動障害セレニカR 顆粒40%:承認時の臨床試験及び市販後の使用成績調査により報告された症例5,366 例中,320 例(5.96%)に414 件の副作用が認められている。その主なものは高アンモニア血症75 件(1.40%),AST(GOT)上昇・ALT(GPT)上昇等の肝臓胆管系障害78 件(1.45%),眠気47 件(0.88%),血小板減少39 件(0.73%),Al-P 上昇19 件(0.35%),白血球減少17 件(0.32%)等であった。(再審査終了時)
セレニカR 錠200mg:セレニカR 錠200mg の承認時の臨床試験により報告された症例66 例中,2 例(3.0%)に4 件の副作用が認められ,アンモニア増加1 件(1.5%),傾眠1 件(1.5%),無為1 件(1.5%),振戦1 件(1.5%)であった。
○ 躁病および躁うつ病の躁状態,片頭痛発作の発症抑制
本剤の躁病および躁うつ病の躁状態,片頭痛発作の発症抑制に対する使用においては,厚生省「適応外使用に係る医療用医薬品の取扱いについて(研第4 号・医薬審第104 号)」通知に該当する医療用医薬品として承認されたため,副作用発現頻度が明確となる国内での調査を実施していない。
○ 重大な副作用
重大な副作用として劇症肝炎等の重篤な肝障害(発症までの期間は6 ヵ月以内が多い),黄疸,脂肪肝等,高アンモニア血症を伴う意識障害,溶血性貧血,赤芽球癆,汎血球減少,重篤な血小板減少,顆粒球減少,急性膵炎,間質性腎炎,ファンコニー症候群,中毒性表皮壊死融解症(Toxic EpidermalNecrolysis:TEN),皮膚粘膜眼症候群(Stevens-Johnson 症候群),過敏症症候群,脳の萎縮,認知症様症状(健忘,見当識障害,言語障害,寡動,知能低下,感情鈍麻等),パーキンソン様症状(静止時振戦,硬直,姿勢・歩行異常等),横紋筋融解症,抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがある。(皮膚粘膜眼症候群は0.1%未満,他は頻度不明)
製剤の各種条件下における安定性
セレニカR 顆粒40%:長期安定性,加速試験において変化は認められなかった。しかし,未包装品の40℃,75%RH の条件下では1 日で変化がみられており,高温多湿期においては,吸湿しやすくなることが予想されるので,保存には注意が必要である。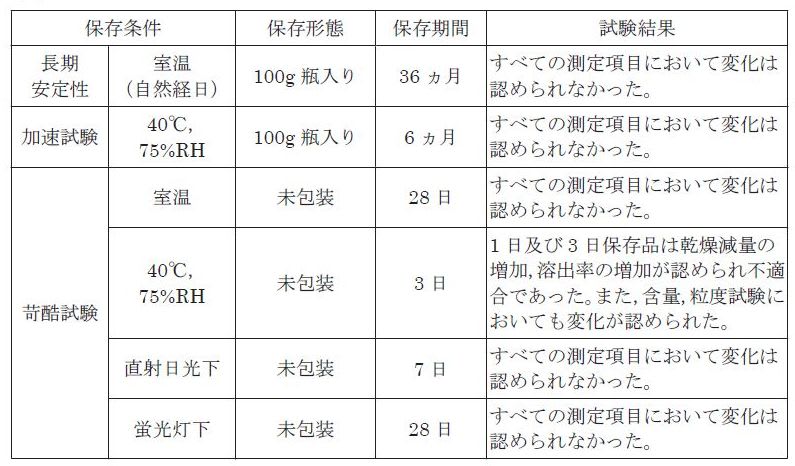
血中濃度の推移・測定法
(1)治療上有効な血中濃度:40 ~ 120mg/mL
各種てんかんおよびてんかんに伴う性格行動障害,躁病および躁うつ病の躁状態に対する有効血中濃度に関しては各種の報告があるが,その下限は50mg/mL を示唆する報告もあり,上限は150mg/mL とする報告もある。
躁病および躁うつ病の躁状態に対する本剤の使用に際しては,急性期治療を目的としているため,原則的に血中濃度モニタリングの実施は必須ではないが,本剤の用量増減時に臨床状態の変化があった場合や,予期した治療効果が得られない場合等には,必要に応じ血中濃度のモニタリングを行い,用量調整することが望ましい。
片頭痛発作に対する本剤の使用に際しては,有効血中濃度が明確になっていないため,原則的に血中濃度モニタリングの実施は必須ではないが,本剤の用量増減時に臨床状態の悪化があった場合等には,必要に応じ血中濃度のモニタリングを行い,用量調整することが望ましい。
(2)最高血中濃度到達時間:
セレニカR 顆粒40% 8 ~ 10 時間(単回投与時)
セレニカR 錠200mg・400mg15 ~ 18 時間(単回投与時)
(3)臨床試験で確認された血中濃度:
1)単回投与:セレニカR 錠200mg とセレニカR 顆粒40%の比較
健康成人男子10 名にセレニカR 錠200mg×2 錠及びセレニカR 顆粒40% 1g(バルプロ酸ナトリウムとして400mg)をクロスオーバー法にて単回経口投与した場合の血漿中薬物濃度推移及び薬物動態パラメータを評価した。セレニカR 顆粒40%と比べてセレニカR 錠200mg ではTmax の遅延が認められたものの,両製剤は類似した血漿中薬物濃度推移を示した。血漿中濃度‐時間曲線下面積(AUC72hr)及び最高血漿中濃度(Cmax)の対数変換値を用いた平均値の差の90% 信頼区間は,log(AUC72hr)83.1 ~ 99.1%,log(Cmax)97.6 ~ 111.3%であり,いずれも同等性の判定基準(80 ~ 125%)を満たしており,両製剤は生物学的に同等であると判断された。
2)連続投与
セレニカR 顆粒40% 3g(バルプロ酸ナトリウム 1200mg)を単回経口投与したときの薬物動態パラメータを元に,バルプロ酸ナトリウムとして1000mg を1 日1 回,6 日間連続経口投与した場合をシミュレーションした。その結果,投与開始後6 ~ 7 日間で定常状態に達すると判断された。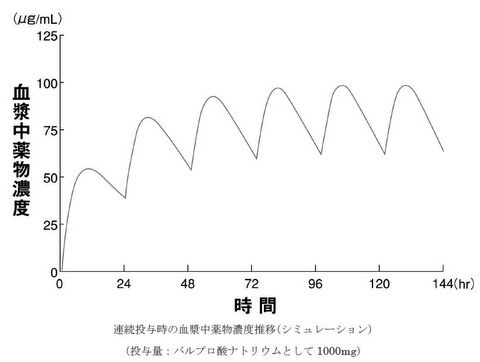
(4)中毒域:
該当資料なし(個人差があり,はっきりしていないが,150 ないし200mg/mL 以上との報告がある。いらいら,不穏,興奮などの精神症状や振戦が発現する。意識障害や嗜眠状態に陥ることもある。)
(5)食事・併用薬の影響:
セレニカR 顆粒40%
健康成人男子12 名に,セレニカR顆粒40% 3g(バルプロ酸ナトリウム 1200mg)をクロスオーバー法にて絶食時及び食後に単回経口投与した場合のAUC80hr,Cmax,Tmax 及びT1/2 は,それぞれ次表の通りであった。AUC80hr 及びCmax の平均値の差はAUC80hr3.4% ,Cmax24.8%であり,Cmax が生物学的同等性の基準(±20%以内)外であり僅かではあるが食事の影響が認められた。なお,算出した薬物動態パラメータに基づいて1 日1 回1000mg 6 日間連続投与をシミュレーションした結果,絶食投与時及び食後投与時において定常状態におけるCmax はほぼ同じ値を示し,Cmin は各63.2mg/mL 及び52.1mg/mL と違いがみられたが,いずれもほぼ有効血中濃度の範囲内であった。

吸収
胃から大腸までの消化管で吸収される。<参考>動物(ラット)における吸収ラット消化管のループからのバルプロ酸ナトリウムの吸収を次表に示す。薬物の吸収部位として知られている小腸上部での吸収が最も良好であり,その他はほぼ同じくらいの吸収率を示した。胃においても高い吸収率を示したのは,0.1mol/L 塩酸中ではバルプロ酸ナトリウムのそのほとんどが脂溶性の高いバルプロ酸となっており,良好な吸収を示したものと思われる。この結果バルプロ酸ナトリウムは溶出速度を律速とした徐放性製剤としてもバイオアベイラビリティの低下はないものと思われる。
分布
(1)血液-脳関門通過性:脳内濃度は血漿中濃度の6.8 ~ 27.9%との報告がある。
(2)血液-胎盤関門通過性:臍帯血/母胎血漿の濃度比が1.71±0.23(mean±S.E.)との報告がある。
(3)乳汁への移行性:乳汁中への濃度は血漿中濃度の3 ~ 6%との報告がある。
(4)髄液への移行性:髄液中の濃度は血清中濃度の12%との報告がある。
(5)その他の組織への移行性:該当資料なし
代謝
(1)代謝部位及び代謝経路:バルプロ酸の大半は肝臓で代謝され,主にグルクロン酸抱合,b-酸化,ω,ω1 及びω2-酸化を受けることが報告されている。
(2)代謝に関与する酵素(CYP450 等)の分子種:
関与する代謝酵素の割合はCYP(チトロクロームP-450)が10%,UGT(グルクロン酸転移酵素)が40%,b-酸化が30 ~ 35%程度であることが報告されている。また,4-en 体の生成には主にCYP2A6,2B6,2C9 分子種が,バルプロ酸のグルクロン酸抱合体の生成にはUGT2B7 分子種が関与することが報告されている。
(3)初回通過効果の有無及びその割合:該当資料なし
(4)代謝物の活性の有無及び比率:活性代謝物としては特にE-2-en 及び4-en 体がバルプロ酸と比較して0.84 及び0.87 倍の抗けいれん作用を有するとの報告がある。また,4-en 体は肝毒性及び胎児毒性(催奇形性)に関与するものと考えられている。
(5)活性代謝物の速度論的パラメータ:該当資料なし
排泄
(1)排泄部位及び経路:主に腎臓,少量は糞便中及び呼気中に排泄されると報告されている。
(2)排泄率:健康成人男子6 名にセレニカR 顆粒40%,3g(バルプロ酸ナトリウム1200 mg)を単回投与した場合の血中及び尿中代謝物は,血中では主に3-keto 体(AUC0-∞328.15±94.73mg・hr/mL)が検出され,尿中でも主に3-keto 体(投与後56 時間までの排泄率34.05±2.57%)が排泄され,以下VPA,3-OH 体,4-OH 体,PGA,5-OH 体,4-keto 体,Z-2-en 体,E-2-en 体の順であった。また,尿中の総排泄率は投与後56 時間までで61.20±5.59%であった。
<参考>バルプロ酸ナトリウムとしての外国人のデータ
尿中排泄率:1 ~ 3%(未変化体)
透析等による除去率
該当資料なし
禁忌内容とその理由
禁忌(次の患者には投与しないこと)
(1)重篤な肝障害のある患者〔肝障害が強くあらわれ致死的になるおそれがある。〕
・バルプロ酸製剤による死亡例を含めた肝障害の増悪が報告されているために禁忌とした。
(2)本剤投与中はカルバペネム系抗生物質(パニペネム・ベタミプロン,メロペネム水和物,イミペネム水和物・シラスタチン,ビアペネム,ドリペネム水和物,テビペネム ピボキシル)を併用しないこと。
・カルバペネム系抗生物質の投与中にバルプロ酸製剤の血中濃度が低下し,痙攣を誘発した症例報告に基づきカルバペネム系抗生物質と本剤の併用を禁忌とした。
(3)尿素サイクル異常症の患者〔重篤な高アンモニア血症があらわれることがある。〕
・バルプロ酸製剤による高アンモニア血症の発現が報告されている事より尿素サイクルに異常のある患者では高アンモニア血症発現リスクが高まり,重篤な症状につながることが考えられる為,尿素サイクル異常症の患者への本剤の投与は禁忌とした。
原則禁忌(次の患者には投与しないことを原則とするが,特に必要とする場合には慎重に投与すること)
妊婦又は,妊娠している可能性のある婦人
慎重投与内容とその理由
(1)肝機能障害又はその既往歴のある患者〔肝機能障害が強くあらわれるおそれがある。〕
・バルプロ酸製剤服用時に肝障害が生じることが死亡例を含めて多く報告されている。そのため肝機能障害やその既往歴のある患者には慎重に投与を行う必要がある。
(2)薬物過敏症の既往歴のある患者
・薬物に過敏な患者では薬剤投与により過敏症を引き起こす可能性がある為に慎重投与とした。
(3)自殺企図の既往及び自殺念慮のある躁病及び躁うつ病の躁状態の患者〔症状が悪化するおそれがある。〕
・「躁病および躁うつ病の躁状態の治療」への投与に関する適応を取得した際に米国の添付文書の記載事項を参考に記載した。自殺念慮はある種の精神症状の発現である事が多く,それは精神症状の軽減が認められるまで継続すると考えられている。そこで自殺の危険性を有する患者には慎重に投与を行う必要がある。
(4)以下のような尿素サイクル異常症が疑われる患者〔重篤な高アンモニア血症があらわれるおそれがある。〕
1)原因不明の脳症若しくは原因不明の昏睡の既往のある患者
2)尿素サイクル異常症又は原因不明の乳児死亡の家族歴のある患者
・尿素サイクルに異常のある患者では高アンモニア血症発現リスクが高まり,重篤な症状につながることが考えられるため,尿素サイクル異常症の患者への本剤の投与は禁忌であり,その疑いがある患者には慎重に投与を行う必要がある。
重要な基本的注意とその理由及び処置方法
(1)本剤で催奇形性が認められているため,妊娠する可能性のある婦人に使用する場合には,本剤による催奇形性について十分に説明し,本剤の使用が適切であるか慎重に判断すること。
・「片頭痛発作の発症抑制」の「効能・効果」及び「用法・用量」の追加承認に伴い,妊娠する可能性のある婦人に対する本剤の使用機会が増加すると考えられるため,さらに注意喚起を促すことを目的として「妊婦,産婦,授乳婦等への投与」の項に加え,本項にも記載した。
(2)てんかん患者においては,連用中における投与量の急激な減少ないし投与の中止によ り,てんかん重積状態があらわれることがあるので,投与を中止する場合には,徐々に減量するなど慎重に行うこと。なお,高齢者,虚弱者の場合には特に注意すること。
・「片頭痛発作の発症抑制」の「効能・効果」及び「用法・用量」の追加承認に伴い,従来「用法・用量に関連する使用上の注意」に記載していた内容を本項に記載した。
(3)片頭痛患者においては,本剤は発現した頭痛発作を緩解する薬剤ではないので,本剤投与中に頭痛発作が発現した場合には必要に応じて頭痛発作治療薬を頓用させること。投与前にこのことを患者に十分に説明しておくこと。
・「片頭痛発作の発症抑制」の「効能・効果」及び「用法・用量」の追加承認に伴い改訂した。
(4)片頭痛患者においては,本剤投与中は症状の経過を十分に観察し,頭痛発作発現の消失・軽減により患者の日常生活への支障がなくなったら一旦本剤の投与を中止し,投与継続の必要性について検討すること。なお,症状の改善が認められない場合には, 漫然と投与を継続しないこと。
(5)重篤な肝障害(投与初期6 ヵ月以内に多い。)があらわれることがあるので,投与初期6 ヵ月間は定期的に肝機能検査を行うなど,患者の状態を十分に観察すること。その後も連用中は定期的に肝機能検査を行うことが望ましい。また,肝障害とともに急激な意識障害があらわれることがあるので,このような症状があらわれた場合には,直ちに適切な処置を行うこと。
・バルプロ酸の投与により死亡例を含む重篤な肝障害の症例が報告されている。致死的肝障害は投与開始後6 ヵ月以内に発生している例が多いので,投初期6 ヵ月以内は特に定期的な肝機能のモニター等十分な注意が必要である。
(6)連用中は定期的に腎機能検査,血液検査を行うことが望ましい。
・本剤を含め抗てんかん剤は,長期投与される薬剤であるため,安全性に対しては十分な注意が必要である。したがって,連用中は前述の肝機能検査(AST(GOT),ALT(GPT),Al-P 等)を含め,定期的に腎機能検査(BUN,血清クレアチニン等),血液検査(赤血球,白血球,血小板等)を実施して,十分な観察のもとに投与することが望ましい。
(7)尿素サイクル異常症が疑われる患者においては,本剤投与前にアミノ酸分析等の検査を考慮すること。なお,このような患者では本剤投与中は,アンモニア値の変動に注意し,十分な観察を行うこと。
・尿素サイクル異常症は,尿素サイクルに関与する酵素の活性が低下しているため,アンモニアの代謝能力が低下している。また,バルプロ酸も高アンモニア血症を起こすことが知られている。従って,投与により重篤な高アンモニア血症があらわれるおそれがある。
(8)眠気,注意力・集中力・反射運動能力等の低下が起こることがあるので,本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
・中枢抑制に基づく副作用発現を懸念した注意事項である。
(9)本剤は製剤学的にバルプロ酸ナトリウムの溶出を制御して徐放化させたものであり,服用後一定時間消化管内に滞留する必要がある。従って重篤な下痢のある患者では血中濃度が十分に上昇しない可能性があるので注意すること。
・本剤が膜制御型徐放性製剤であることによる留意事項である。
(10)他のバルプロ酸ナトリウム製剤を使用中の患者において使用薬剤を本剤に切り替える場合,血中濃度が変動することがあるので注意すること。
・本剤が膜制御型徐放性製剤であることによる留意事項である。
相互作用
(1)併用禁忌とその理由
併用注意とその理由: 

副作用
副作用の概要:
セレニカR 顆粒40%
○ 各種てんかんおよびてんかんに伴う性格行動障害
承認時の臨床試験及び市販後の使用成績調査により報告された症例5,366 例中,320 例(5.96%)に414 件の副作用が認められている。その主なものは高アンモニア血症75 件(1.40%),AST(GOT)上昇・ALT(GPT)上昇等の肝臓胆管系障害78 件(1.45% ),眠気47 件(0.88%),血小板減少39 件(0.73%),Al-P 上昇19 件(0.35%),白血
球減少17 件(0.32%)等であった。(再審査終了時)
○ 躁病および躁うつ病の躁状態,片頭痛発作の発症抑制
本剤の躁病および躁うつ病の躁状態,片頭痛発作の発症抑制に対する使用においては,厚生省「適応外使用に係る医療用医薬品の取扱いについて(研第4 号・医薬審第104 号)」通知に該当する医療用医薬品として承認されたため,副作用発現頻度が明確となる国内での調査を実施していない。
重大な副作用と初期症状:
1)劇症肝炎等の重篤な肝障害(発症までの期間は6 ヵ月以内が多い。),黄疸,脂肪肝等(頻度不明)を起こすことがあるので,定期的に検査を行うなど観察を十分に行い,異常が認められた場合には,投与を中止し,適切な処置を行うこと。
2)高アンモニア血症を伴う意識障害(頻度不明)があらわれることがあるので,定期的にアンモニア値を測定するなど観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
3)溶血性貧血,赤芽球癆,汎血球減少,重篤な血小板減少,顆粒球減少(頻度不明)があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止するなど適切な処置を行うこと。
4)急性膵炎(頻度不明)があらわれることがあるので,激しい腹痛,発熱,嘔気,嘔吐等の症状があらわれたり,膵酵素値の上昇が認められた場合には,投与を中止し,適切な処置を行うこと。
5)間質性腎炎,ファンコニー症候群(頻度不明)があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止するなど適切な処置を行うこと。
6)中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明),皮膚粘膜眼症候群(Stevens-Johnson 症候群)(0.1%未満)があらわれることがあるので,観察を十分に行い,異常が認められた場合には,投与を中止し,適切な処置を行うこと。
7)過敏症症候群(頻度不明)があらわれることがあるので,観察を十分に行い,初期症状として発疹,発熱がみられ,さらにリンパ節腫脹,肝機能障害,白血球増加,好酸球増多,異型リンパ球出現等の症状があらわれた場合には投与を中止し,適切な処置を行うこと。なお,発疹,発熱,肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
8)脳の萎縮,認知症様症状(健忘,見当識障害,言語障害,寡動,知能低下,感情鈍麻等),パーキンソン様症状(静止時振戦,硬直,姿勢・歩行異常等)(頻度不明)があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。なお,これらの症状が発現した例では中止により,ほとんどが1 ~ 2ヵ月で回復している。
9)横紋筋融解症(頻度不明)があらわれることがあるので,観察を十分に行い,筋肉痛,脱力感,CK(CPK)上昇,血中及び尿中ミオグロビンの上昇等が認められた場合には投与を中止し,適切な処置を行うこと。
10)抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)があらわれることがあるので,観察を十分に行い,低ナトリウム血症,低浸透圧血症,尿中ナトリウム量の増加,高張尿等があらわれた場合には水分摂取の制限等の適切な処置を行うこと。
その他の副作用:
妊婦,産婦,授乳婦等への投与
(1)妊婦又は妊娠している可能性のある婦人には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔二分脊椎児を出産した母親の中に,本剤の成分を妊娠初期に投与された例が対照群より多いとの疫学的調査報告があり,また,本剤の成分を投与された母親に,心室中隔欠損等の心奇形や多指症,口蓋裂,尿道下裂等の外表奇形,その他の奇形を有する児を出産したとの報告がある。また,特有の顔貌(前頭部突出,両眼離開,鼻根偏平,浅く長い人中溝,薄い口唇等)を有する児を出産したとする報告がみられる。〕
(2)妊娠中にやむを得ず本剤を投与する場合には,可能な限り単独投与することが望ましい。〔他の抗てんかん剤(特にカルバマゼピン)と併用して投与された患者の中に,奇形を有する児を出産した例が本剤単独投与群と比較して多いとの疫学的調査報告がある。〕
(3)妊娠中の投与により,新生児に呼吸障害,肝障害,低フィブリノーゲン血症等があらわれることがある。
(4)妊娠中の投与により,新生児に低血糖,退薬症候(神経過敏,過緊張,痙攣,嘔吐)があらわれるとの報告がある。
(5)動物実験(マウス)で,本剤が葉酸代謝を阻害し,新生児の先天性奇形に関与する可能性があるとの報告がある。
(6)授乳婦に投与する場合には授乳を避けさせること。〔ヒト母乳中へ移行することがある。〕
小児等への投与
(1)低出生体重児,新生児に対する安全性は確立していない。(使用経験が少ない。)
(2)片頭痛発作の発症抑制に対する,小児における安全性及び有効性については,現在までの国内外の臨床試験で明確なエビデンスが得られていない。
過量投与
(1)症状:誤飲や自殺企図による過量服用により意識障害(傾眠,昏睡),痙攣,呼吸抑制,高アンモニア血症,脳水腫を起こした例が報告されている。外国では死亡例が報告されている。本剤は徐放性製剤であるため,症状が遅れてあらわれることがある。
(2)処置:意識の低下,嚥下反応の消失がなければ早期に胃洗浄を行う。下剤,活性炭投与を行い,尿排泄を促進し,一般的な支持・対症療法を行う。また必要に応じて直接血液灌流,血液透析を行う。ナロキソンの投与が有効であったとする報告がある。
適用上の注意
セレニカR 顆粒40%
(1)保存時:本剤は徐放性製剤であり,製剤の吸湿により溶出が加速されることがあるので,吸湿しないように保存させること。
(2)服用時:
1)本剤は徐放性製剤であり,製剤をかみ砕くことにより溶出が加速されることがあるので,薬剤をかみ砕かないで服用させること。
2)本剤投与後に白色の粒子が糞便中に排泄されるが,これは賦形剤の一部である。