Ⅰ. 概要に関する項目
1. 開発の経緯
クロバザムは1966年にイタリアのMaestretti研究所で合成された抗てんかん薬である。ジアゼパムに代表される既存のベンゾジアゼピン系薬剤が複素環1,4位に窒素原子を有するのに対し、クロバザムは1,5位に窒素原子を有する初めてのベンゾジアゼピン系薬剤である。海外においてヘキスト社(ドイツ)及びルセル社(フランス)により、先ず抗不安薬として、その後、1978年、Gastautにより難治性てんかん患者に対するクロバザムの有用性が報告されて以来、てんかんを対象とした数多くの臨床的検討が行われ、現在90ヵ国以上でてんかんを適応症として広く使用されている。
海外でのクロバザムの優れた臨床効果の報告に、国内の臨床医からも強く興味が示され、本邦においては、1990年より抗てんかん薬としての開発が着手された。
既存の抗てんかん薬で発作の軽減が認められない症例への併用投与で、すべての部分発作とほとんどの全般発作にわたり有効であり、難治性てんかんに対し有用性の高い抗てんかん薬であることが認められ、2000年3月に承認され、2000年5月から販売している。
なお、マイスタン細粒は、医療事故防止対策の一環として、2003年にマイスタン細粒1%に名称変更している。
2. 製品の治療学的・製剤学的特性
・1日1~3回投与が可能で、併用されている抗てんかん薬の1日投与回数に合わせることができる。
Ⅱ. 名称に関する項目
1. 販売名
(1)和名:マイスタン錠5mg、マイスタン錠10mg、マイスタン細粒1%
(2)洋名:MYSTAN
(3)名称の由来:大部分の(マイスト:ドイツ語meist)発作に有効な抗てんかん薬
2. 一般名
(1)和名(命名法):クロバザム(JAN)
(2)洋名(命名法):Clobazam(JAN、INN)
略号:CLB
Ⅴ. 治療に関する項目
1. 効能又は効果
■効能・効果
他の抗てんかん薬で十分な効果が認められないてんかんの下記発作型における抗てんかん薬との併用
部分発作(単純部分発作,複雑部分発作,二次性全般化強直間代発作)
全般発作(強直間代発作,強直発作,非定型欠神発作,ミオクロニー発作,脱力発作)
2. 用法及び用量
■用法・用量
通常,成人にはクロバザムとして1日10mgの経口投与より開始し,症状に応じて徐々に増量する.維持量は1日10~30mgを1~3回に分割経口投与する.
なお,症状により適宜増減する(最高1日量は40mgまでとする).
小児に対しては,通常クロバザムとして1日0.2mg/kgの経口投与より開始し,症状に応じて徐々に増量する.維持量は1日0.2~0.8mg/kgを1~3回に分割経口投与する.
なお,症状により適宜増減する(最高1日量は1.0mg/kgまでとする).
【用法・用量に関連する使用上の注意】
本剤は他の抗てんかん薬と併用して使用すること.〔本剤単独での使用経験が少ない.〕
承認時までに実施された臨床試験では、ほとんどの症例が他の抗てんかん薬との併用(add-on)で用いられており、本剤単独での使用例は2例のみであった。
(5)検証的試験
1)無作為化並行用量反応試験
②小児てんかん
後期第 II 相試験は、既存の抗てんかん薬を投与しても発作の軽減が認められない小児てんかん患者を対象に、多施設共同オープン試験が実施された 3)。用量は 1 日 0.1~0.2 mg/kg から開始し、発作の軽減がみられない場合は最高 1.0mg/kg まで増量され、12 週間投与による至適用量の検討が行われた。用法は分 1~3 投与とされた。
改善率は 0.20mg/kg 未満の群で 40.0%(4/10)、0.20~0.40mg/kg 群で 61.5%(24/39)、0.41~0.60mg/kg群で 45.8%(11/24)、0.61~0.80mg/kg 群で 57.1%(4/7)、0.81~1.0 mg/kg 群で 44.4%(4/9)であった。副作用は 49.5%(45/91)に認められたが、臨床検査成績も含めて安全性で特に問題となるようなものはなかった。
2)比較試験
既存の抗てんかん薬を投与しても発作の軽減が認められない主として部分てんかん患者を対象に、多施設共同二重盲検比較試験(対照薬:プラセボ)が実施された。
改善率はプラセボ群の14.9%(7/47)に対して、クロバザム群で64.2%(34/53)と有意に高かった(p<0.0001)。副作用の発現率はクロバザム群35.8%(19/53)、プラセボ群25.0%(13/52)と両群間に有意差は認められなかった。主な副作用として、両群ともに眠気、めまいなどがみられたが、臨床検査成績も含めて安全性で特に問題となるようなものはなかった。
これらの成績から、本剤(1日量10~30mg、分1~3)の有効性はプラセボよりも有意に優れ、有用性が確認された。
また、既存の抗てんかん薬を投与しても発作の軽減が認められない全般てんかん患者を対象とした多施設共同無作為化比較試験6) においても、本剤の有用性が確認された。
4)八木和一, ほか : 医学のあゆみ, 174 : 229, 1995
5)大日本住友製薬資料:成人てんかんを対象とした第
3)安全性試験
②小児てんかん
後期第 II 相試験において 12 週間投与が終了した時点で有用性が認められた小児てんかん患者 68 例について、長期投与試験(12 ヵ月投与)が実施された 8)。用法・用量は後期第 II 相試験終了時の維持用量が継続投与された。
改善率は 61.7%(29/47)であり、長期投与により発作は良好にコントロールされた。副作用は 23.5%(16/68)に認められたが、臨床検査成績も含めて安全性で特に問題となるようなものはなかった。
これらの成績から、本剤は小児てんかんに対して有効性及び安全性の点から長期投与が可能な薬剤であると考えられた。
7)扇谷明, ほか : 臨床医薬, 11 : 2455, 1995
8)山磨康子, ほか : 臨床医薬, 13 : 2665, 1997
Ⅵ. 薬効薬理に関する項目
2. 薬理作用
(1)作用部位・作用機序
クロバザムは、ガンマアミノ酪酸 A (GABAA)-ベンゾジアゼピン受容体-Cl-チャネル複合体上のベンゾジアゼピン受容体に結合し、大脳辺縁系において GABA ニューロンの働きを増強することにより抗けいれん作用を示すと考えられている。
(2)薬効を裏付ける試験成績
8)代謝物N-脱メチルクロバザムの薬効薬理作用(マウス)
クロバザムの代謝物であるN-脱メチルクロバザムは、クロバザムと同様、ベンゾジアゼピン受容体に選択的な結合を示し、その親和性はクロバザムの約1/2の強さであった。また、経口投与による薬物誘発ならびに最大電撃けいれん抑制作用の強さは1/2~1/15であった。反復投与した場合、クロバザムと同様に最大電撃けいれん抑制作用の減弱が認められた。
Ⅶ. 薬物動態に関する項目
1. 血中濃度の推移・測定法
(2)最高血中濃度到達時間
健康成人 5 例にクロバザム 5mg 及び 10mg を空腹時 1 回投与したときの最高血漿中濃度到達時間は、それぞれ 1.4 時間、1.7 時間であった 16)。
(3)臨床試験で確認された血中濃度

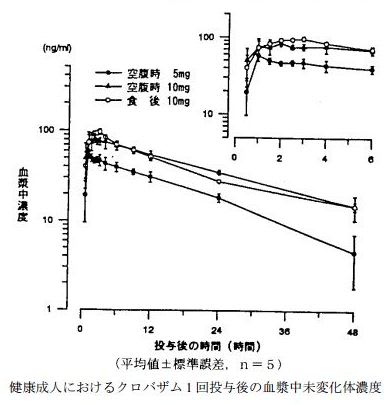

Cmax 及び AUC0-48 は投与量とほぼ比例関係にあり、Tmax、t1/2α 及び t1/2β は投与量によらずほぼ一定であり、クロバザムの体内動態は線形と考えられる。
また、クロバザム 10mg を食後投与後の血漿中濃度は空腹時投与後とほぼ同様の推移を示し、薬物速度論的パラメータにも両群間に有意な差は認められなかった
なお、代謝物 N-脱メチルクロバザム(M-9)の平均血漿中濃度は、クロバザム 5mg 及び 10mg 空腹時 1回投与後 48 時間にそれぞれ 20.5ng/mL、29.6ng/mL のピークに達し、以後緩徐に消失した。
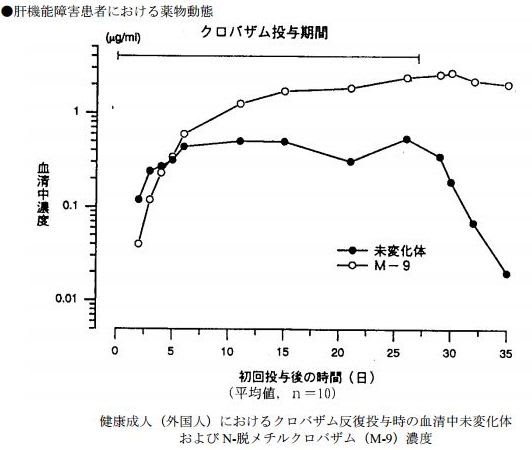
健康成人(外国人)10 例にクロバザム 10mg を 1 日 2 回 28 日間反復経口投与時、各投与前の血清中未変化体濃度(Cmin)は 7 日以内に定常状態に達した 17)。一方、血清中 N-脱メチルクロバザム(M-9)濃度は投与期間中徐々に増加し、最終投与日の濃度は 2811ng/mL と、未変化体の約 8 倍であった。最終投与 3 日後から徐々に低下し、7 日後に 2031ng/mL となった。
(5)食事・併用薬の影響
クロバザム10mgを食後投与後の血漿中濃度は空腹時投与後とほぼ同様の推移を示し、薬物速度論的パラメータにも両群間に有意な差は認められなかった。
3. 吸収
ラット及びイヌにおけるクロバザムの消化管からの吸収率は87~100%であると推定される。
クロバザムは投与量の約68%が胆汁中に排泄され、その約82%が再吸収され、腸肝循環を受けた。再吸収されるのはラット胆汁中に抱合体として存在する代謝物と推定される。
4. 分布
(1)血液―脳関門通過性
血漿中代謝物組成と大脳内代謝物組成との比較より、未変化体及びN-脱メチルクロバザム(M-9)の脳移行性が他の代謝物より良好であることが示唆される。
5. 代謝
(1)代謝部位及び代謝経路
主として肝臓で、N-脱メチル化、5-フェニル基の3',4'位の水酸化、水酸基のメチル化、水酸基及びN位の抱合化等によって代謝される21,22)。主な代謝物は、N-脱メチルクロバザム(M-9)、4'-水酸化-N-脱メチルクロバザム(M-5)及び4'-水酸化クロバザム(M-7)等であった。
(4)代謝物の活性の有無及び比率
N-脱メチルクロバザム(M-9)は活性を有する。
(5)活性代謝物の速度論的パラメータ
健康成人6例、空腹時30mg1回投与
クロバザム:Tmax=1.7±0.4h、Cmax=622±60ng/mL、t1/2β=31±5h
N-脱メチルクロバザム:Tmax=47.0±8.5h、Cmax=143±19ng/mL、t1/2β=70±15h
6. 排泄
(1)排泄部位及び経路
主として尿中、糞便中
ラットに[14C]クロバザム0.1mg/kgを単回静脈内あるいは4mg/kgを単回経口投与後168時間までに投与放射能の35.9~42.7%が尿中に、53.3~62.7%が糞中に排泄され、投与経路差は認められなかった。また、イヌに[14C]クロバザム0.1mg/kgを単回静脈内あるいは2mg/kgを単回経口投与後では、168時間までに尿中に62.9~66.8%、糞中に32.6~36.5%排泄され、イヌでは尿中排泄が主であった。
(2)排泄率
投与後168時間までの尿中排泄率は、未変化体として0.97~2.72%、M-5(4'-水酸化-N-脱メチルクロバザム)として3.54~14.29%、M-7(4'-水酸化クロバザム)として6.24~11.22%、M-9(N-脱メチルクロバザム)として3.61~6.79%であった。これらは投与量の18.93~30.03%であった。〔健康成人5例、5mg(空腹時)及び10mg(空腹時及び食後)1回投与〕
Ⅷ. 安全性(使用上の注意等)に関する項目
5. 慎重投与内容とその理由
(1)心障害のある患者
本剤と類似のベンゾジアゼピン系薬剤であるジアゼパムの注射剤では、血圧低下の副作用が報告されている。本剤の動物実験では、軽度の血圧下降が認められたが、心拍数や心電図には影響は認められていない。
したがって、本剤の経口投与による循環器系への影響は少ないものと考えられるが、他のベンゾジアゼピン系薬剤と同様に、心障害のある患者に投与するときは慎重に行うこととした。
(2a)肝障害のある患者
本剤を含むベンゾジアゼピン系薬剤は主として肝臓において代謝されるため、肝障害のある患者では、血中濃度が持続するおそれがある。
また、ベンゾジアゼピン系薬剤であるジアゼパム、クロルジアゼポキシドによる急性肝壊死の報告があり、既に肝障害を有する患者に投与する場合は肝障害の悪化の可能性も考えられるので、肝機能検査を定期的に行いつつ慎重に投与することが必要である。
(2b)腎障害のある患者
本剤を含むベンゾジアゼピン系薬剤は腎を経て尿中に排泄されるので、腎に障害のある患者では排泄が遅延され、効果が強くあらわれすぎたり、予期せぬ副作用等が発現したりする可能性があるため、このような患者には慎重に投与することが必要である。
(3)脳に器質的障害のある患者
脳に器質的障害が存在すると向精神薬の作用が強くあらわれ、副作用症状(意識障害や奇異的精神症状あるいは錐体外路症状等)が出現しやすくなることが経験的に知られているため、脳に器質的障害のある患者には慎重に投与することが必要である。
(4)高齢者
(5)衰弱患者
一般的に衰弱患者ではベンゾジアゼピン系薬剤の作用が強くあらわれるとされており、副作用が発現する可能性も高いと考えられるので、慎重投与としている。
(6)呼吸機能の低下している患者
ベンゾジアゼピン系薬剤は呼吸抑制作用を有することが知られており、本剤の動物実験でも、軽度の呼吸抑制が認められている。また、本剤による呼吸抑制の症例の中には、もともと呼吸機能が低下していた患者が含まれている。
6. 重要な基本的注意とその理由及び処置方法
(1)投与初期の眠気、ふらつき等
本剤の承認時までの臨床試験において、投与初期に眠気、ふらつき等の副作用が認められたので、少量から開始し、慎重に漸増することとしている。
(2)てんかん重積状態
一般に服用中の抗てんかん薬を急激に減量あるいは中止すると、本来の発作よりさらに強い発作が起こり、しばしばてんかん重積状態があらわれることがある。
てんかん重積状態は、「発作がある程度の長さ以上に続くか、又は短い発作でも反復してその間の意識の回復がない状態」と定義され、いずれの場合でも発熱、呼吸循環障害等の重篤な全身症状を示し、生命の危険にさらされることがある。
投薬を中止する場合には徐々に減量するなど慎重に行う必要がある。
(3)発作の悪化又は誘発
抗てんかん薬の投与により発作が悪化又は誘発されることが知られている。本剤は難治性のてんかん患者に投与されることが多いため、発作の悪化や誘発が副作用かどうかの判断は困難であるが、本剤の投与を契機に、既存の発作の悪化又は他の発作型の誘発がみられた症例が報告されている。クロナゼパム等では悪化又は誘発される発作型の種類がよく知られているが、本剤では一定の傾向は認められなかった。
(4)耐性
承認時までの臨床試験で、投与4週後において改善以上の効果がみられ、かつその後12週までの経過観察が可能であったクロバザム群の13例、クロナゼパム群の11例について、発作の転帰及び投与量を耐性発現の指標として比較した。その結果、6週後でクロナゼパム群の改善率はクロバザム群よりも有意に低下し、その差は投与期間が長くなるほど大きくなった。一方、12週後の平均投与量は4週後に比較してクロバザム群で32%増加したのに対し、クロナゼパム群では39%増加した。
このように、評価例数は少ないものの、クロバザム群においても耐性の発現が認められたが、その程度はクロナゼパムよりも若干弱いものと考えられた。
(5)相互作用
本剤は他の抗てんかん薬と併用されるため、相互作用に注意する必要がある。
「Ⅷ-7.相互作用」の項参照
(6)定期的な肝・腎機能、血液検査について
本剤投与により、白血球減少、血小板減少、肝機能検査値の異常等が報告されている。これらの異常を含め、本剤服用中に生ずる副作用を防止するためには、肝・腎機能、血液検査を定期的に行う必要がある。なお、本剤は肝・腎障害のある患者には慎重投与としている。
本剤を含め、抗てんかん薬は長期間投与される性格の薬剤であるため、安全性に対しては十分な注意が必要であり、連用中には患者の全身状態を把握し、肝機能検査〔AST(GOT)、ALT(GPT)、γ-GTP、ALP、ビリルビン等〕、腎機能検査(BUN、クレアチニン等)、血液検査(赤血球、白血球、血小板等)を実施して、十分な観察のもとに投与することが望ましいとされている。
(7)危険を伴う機械の操作について
一般に、抗てんかん薬は中枢神経抑制作用、運動機能抑制作用等を有するため、その投与により、眠気、注意力・集中力・反射運動能力等の低下があらわれることがある。したがって、本剤投与中の患者には自動車の運転など危険を伴う機械の操作に従事させないように注意する必要がある。
(8)肺炎、気管支炎
本剤による喘鳴、喀痰等の分泌物増加が、肺炎・気管支炎の発症や増悪に影響したと考えられる症例が報告されている。
クロナゼパムでも小児で喀痰増加、気道分泌過多、唾液分泌過多があらわれやすいことが知られている。
本剤では、ほとんどの症例が15歳以下の小児であり、また高齢者での発症例は報告されていないが、高齢者では喀痰等の排出機能や嚥下機能が低下していることから小児と同様に肺炎・気管支炎を起こしやすい可能性が考えられる。
7. 相互作用
本剤は,主として薬物代謝酵素CYP3A4で代謝される.また,本剤の代謝物N-脱メチルクロバザムは主としてCYP2C19で代謝される.
(1)中枢抑制薬
海外における本剤の「使用上の注意」及び国内の同種同効品の「使用上の注意」に基づいて記載した。
(2)アルコール
外国の臨床試験において、アルコールにより本剤の血中濃度が上昇したとの報告37) がある。
<文献37)の概要>
8例の健康成人を対象にアルコールとクロバザムとの薬物相互作用を検討した。クロバザム20mg単回経口投与後の血清中未変化体のCmax及びAUCは、単独投与時でそれぞれ243.8ng/mL及び63.5μg・min/mLであったのに対し、アルコール摂取時ではそれぞれ388.8ng/mL及び98.2μg・min/mLであり、ともに併用により約1.6倍有意(P<0.05)に上昇した。また、有意差は認められないものの、アルコールによる認識力や運動性低下の程度が、クロバザムの併用で大きくなる傾向がみられた。
(3)フェニトイン、フェノバルビタール、カルバマゼピン、バルプロ酸
これらの抗てんかん薬との併用により、クロバザムの血中濃度が低下したという報告38) がある。
クロバザムの代謝には主としてCYP3A4が関与しており26)、カルバマゼピン、フェノバルビタール、フェニトインの併用によりCYP3A4酵素が誘導されたため、クロバザムの代謝が促進したものと考えられる。
バルプロ酸との相互作用については、クロバザムの血漿蛋白結合率が90~91%と比較的高く20)、バルプロ酸の血漿蛋白結合率も約93%と高いことから、併用によりクロバザムの蛋白結合率が低下したことによると推測される。
<文献38)の概要>
クロバザムを単独、あるいはフェニトイン、フェノバルビタール、カルバマゼピン、バルプロ酸と併用投与時の血漿中クロバザム濃度を測定した。その結果、クロバザム単独投与群の血漿中濃度は446±250ng/mL(n=9)であったのに対し、カルバマゼピン、フェノバルビタール、フェニトイン、バルプロ酸の併用群ではそれぞれ201±117ng/mL(n=17)、172±111ng/mL(n=17)、224±65ng/mL(n=5)、267±166ng/mL(n=15)と低下していた。
一方、これらの抗てんかん薬の血中濃度が上昇したという報告1,39,40) もあるが、機序は不明である。
<文献39)の概要>
フェニトイン投与中の患者3例にクロバザムを追加投与したところ、それまで18~23μg/mLであったフェニトイン血漿中濃度が29~33μg/mLに上昇し、眠気、運動失調等の中毒症状を呈した。フェニトインの減量により回復した。
<文献1)の概要>
他の抗てんかん薬を投与中のてんかん患者にクロバザムを追加投与後の血漿中濃度を測定した。カルバマゼピンは8.8±2.2μg/mLから9.3±2.6μg/mL(n=15)と有意(P<0.05)に上昇し、バルプロ酸も75.4±29.5μg/mLから87.9±26.1μg/mL(n=11)と有意(P<0.05)に上昇した。フェニトイン、フェノバルビタール、ゾニサミド、プリミドンとの相互作用は認められなかった。
(4)スチリペントール
本剤はCYP3A4で代謝されること26)、本剤の代謝物N-脱メチルクロバザムはCYP2C19で代謝されること、スチリペントールはその両方を阻害することからから記載した。両剤の併用により本剤及びN-脱メチルクロバザムの血中濃度の上昇が臨床的に認められている41)。
<文献41)の概要>
クロバザム及びバルプロ酸を投与中の37例の小児重症ミオクロニーてんかん患者にスチリペントールを追加投与した後の血漿中濃度を測定した。定常状態におけるの血漿中トラフ濃度はスチリペントール投与前と比較して、クロバザムでは0.39から0.84(mg/L)/(mg/kg)に、N-脱メチルクロバザムでは3.6から11.6(mg/L)/(mg/kg)に上昇した。
(5)シメチジン
本剤はCYP3A4によって代謝されること26)、シメチジンはCYP3A4を阻害すること42)、両剤の併用により本剤のAUC増加及びt1/2の延長が臨床的に認められている42) ため記載した。
<文献42)の概要>
9例の健康成人にシメチジンを1日1000mg反復投与後、クロバザム30mgを単回投与した。クロバザム単独投与時のAUCは13.9μg・h/mLであるのに対し、シメチジン併用時には16.2μg・h/mLと有意に増加した。t1/2も22.7時間から25.1時間に有意に延長した。
相互作用の機序としては、シメチジンによる肝薬物代謝阻害によると推測される。
(6)CYP3A4を阻害する薬剤、CYP3A4により代謝される薬剤
本剤はCYP3A4により代謝されることがin vitroで示されており26)、これらの薬剤との相互作用が予測されるため記載した。実際に臨床での相互作用の報告はない。
CYP2C19を阻害する薬剤
本剤の代謝物N-脱メチルクロバザムはCYP2C19で代謝される27,28)ため記載した。CYP2C19の阻害作用を有するオメプラゾールとの併用により、本剤の代謝物の血中濃度の上昇が認められているが、臨床的に意味のある変化ではなかった36)。
CYP2D6により代謝される薬剤
本剤とCYP2D6により代謝されるデキストロメトルファンとの併用によりデキストロメトルファン血中濃度が上昇するとの報告36)があるため記載した。<文献36)の概要>
18例の健康成人にクロバザム40mgを15日間投与後、デキストロメトルファン30mgを含む4種の薬剤を単回投与した。クロバザムとの併用によりデキストロメトルファンのAUC0-∞、Cmaxはそれぞれ95%、59%上昇した。
8. 副作用
(1)副作用の概要
承認時までの臨床試験では350例中,副作用発現例数は171例(48.9%),のべ287 件であった.主な副作用は,眠気135 件(38.6%),ふらつき・めまい38 件(10.9%),唾液増加9件(2.6%),複視8件(2.3%),食欲不振7件(2.0%)等であった.(承認時)
市販後の使用成績調査・特別調査では2,060例中,副作用発現例数は378例(18.3%)であった.主な副作用は,眠気・傾眠167件(8.1%),AST (GOT)・ALT (GPT)・γ-GTP・ALPの上昇等の肝機能検査値異常70件(3.4%),ふらつき・めまい64件(3.1%),唾液分泌過多15件(0.7%)等であった.(再審査終了時)
(2)重大な副作用と初期症状
1)依存性
ベンゾジアゼピン系薬剤では大量投与や長期間投与により依存性が出現する可能性があることが知られている。また、本剤の中断により、ヒトで易刺激性、不安、集中困難等の症状が出現したとの報告がある。
アカゲザルを用いた交差身体依存性試験(バルビタール型)、身体依存形成試験及び精神依存性試験の結果44) から、クロバザムはジアゼパム等の標準的ベンゾジアゼピン系薬物と同程度の身体依存性及び精神依存性を有するものと考えられた。
2)呼吸抑制
ベンゾジアゼピン系薬剤は呼吸抑制作用を有することが知られているが、本剤では呼吸抑制、無呼吸、呼吸困難、多呼吸(過呼吸)がみられた症例が報告されている。また、これらの症例の中には、もともと呼吸機能が低下した患者があった。
「Ⅷ-5.慎重投与内容とその理由」の項参照
なお、本剤の投与を中止する場合には、徐々に減量するなど注意が必要である。
3)中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)
中毒性表皮壊死融解症(TEN)は、全身が広範囲にわたり赤くなり、全身の10%以上にやけどのような水ぶくれ、皮膚のはがれ、ただれなどが認められ、高熱(38℃以上)、皮膚や口にできるぶつぶつ、目が赤くなるなどの症状を伴う疾患である。また、皮膚粘膜眼症候群(SJS)は、高熱(38℃以上)を伴って、発疹・発赤、やけどのような水ぶくれなどの激しい症状が、比較的短期間に全身の皮膚、口、目の粘膜にあらわれる疾患である。SJS とTEN は一連の病態と考えられ、TEN の症例の多くがSJS の進展型と考えられている。いずれも死に至ることもある重篤な皮膚疾患であり、早期発見、早期対応が重要となる。
多くは薬剤が原因で発症する重症な薬疹であるため、まず原因と考えられる薬剤を中止し、粘膜の局所処置、補液・栄養管理、感染防止、厳重な眼科的管理が重要である。
一般的に、SJS/TEN の発現時期は原因医薬品の服用後2 週間以内に多いことが知られており、投与開始初期には特に注意が必要である。
対処法としては、原因と考えられる薬剤を中止し、全身症状が良好な症例では副腎皮質ホルモン外
用剤を塗布する。重症な症例では副腎皮質ホルモン剤の内服あるいは点滴が必要となることもある。
(3)その他の副作用

11.小児等への投与
小児等への投与
(1)新生児,乳児への投与に対する安全性は確立していない.〔使用経験が少ない.〕
承認時までに実施された臨床試験では、1歳未満の新生児、乳児への投与は1例のみであることから、本記載を行っている。なお、1歳以上の幼児、小児では、安全性について特に問題はなかった。
(2)小児等では,喘鳴,喀痰増加,気道分泌過多,唾液分泌過多,嚥下障害があらわれ,肺炎,気管支炎に至ることがあるので,観察を十分に行い,このような症状があらわれた場合には,適切な処置を行うこと.〔「重要な基本的注意」の項参照〕
本剤による喘鳴、喀痰等の分泌物増加が、肺炎・気管支炎の発症や増悪に影響したと考えられる症例が報告されている。本剤では、ほとんどの症例が15歳以下の小児であった。
13.過量投与
(1)症状 嗜眠,錯乱,失調,呼吸抑制,血圧低下,昏睡等があらわれることがある.
処置 呼吸,脈拍,血圧等を監視しながら,胃洗浄,補液投与等の適切な処置を行うこと.強制利尿または血液透析は無効である.
(2)本剤の過量投与が明白または疑われた場合の処置としてフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与する場合には,使用前にフルマゼニルの使用上の注意(禁忌,慎重投与,相互作用等)を必ず読むこと.
(3)他のベンゾジアゼピン系薬剤(クロナゼパム)を長期間投与されているてんかん患者に,フルマゼニルを投与してけいれん発作を誘発したとの報告がある.
15.その他の注意
(1)本剤による治療中,原因不明の突然死が報告されている.
(2)他のベンゾジアゼピン系薬剤(クロナゼパム)で混合発作のある患者に投与すると,強直間代発作の誘発や回数を増加することが,また,レンノックス症候群の患者に投与するとinduced microseizures(睡眠中の多呼吸発作等)を誘発することが報告されているので,観察を十分に行い,このような症状があらわれた場合には適切な処置を行うこと.
(3)他のベンゾジアゼピン系薬剤(クロナゼパム)で精神障害を合併している患者に投与すると,逆に刺激興奮,錯乱等があらわれることが報告されている.
(4)ラットに本剤を24カ月間投与したがん原性試験において,雄100mg/kg/日投与で甲状腺濾胞細胞腺腫の発生増加が認められたとの報告がある.
(5)海外で実施された複数の抗てんかん薬における,てんかん,精神疾患等を対象とした199のプラセボ対照臨床試験の検討結果において,自殺念慮および自殺企図の発現のリスクが,抗てんかん薬の服用群でプラセボ群と比較して約2倍高く(抗てんかん薬服用群:0.43%,プラセボ群:0.24%),抗てんかん薬の服用群では,プラセボ群と比べ1,000人あたり1.9人多いと計算された(95%信頼区間:0.6~3.9).また,てんかん患者のサブグループでは,プラセボ群と比べ1,000人あたり2.4人多いと計算されている.
Ⅸ. 非臨床試験に関する項目
(4)その他の薬理試験
2)代謝物N-脱メチルクロバザムの一般薬理作用
代謝物N-脱メチルクロバザムはクロバザムと同様の睡眠時間延長作用を示したが、その活性はクロバザムの1/6であった。その他の中枢神経系に対する作用もクロバザムより弱かった。呼吸及び循環器系に対する作用はクロバザムより弱く血圧低下作用も認められなかった。体性神経系、自律神経系及び消化管に対しても、影響しないか、クロバザムより弱い作用しか示さなかった。
N-デスメチルクロバザムについて
<再掲>8)代謝物N-脱メチルクロバザムの薬効薬理作用(マウス)
クロバザムの代謝物であるN-脱メチルクロバザムは、クロバザムと同様、ベンゾジアゼピン受容体に選択的な結合を示し、その親和性はクロバザムの約1/2の強さであった。また、経口投与による薬物誘発ならびに最大電撃けいれん抑制作用の強さは1/2~1/15であった。反復投与した場合、クロバザムと同様に最大電撃けいれん抑制作用の減弱が認められた。
<再掲>代謝物 N-脱メチルクロバザム(M-9)の平均血漿中濃度は、クロバザム 5mg 及び 10mg 空腹時 1回投与後 48 時間にそれぞれ 20.5ng/mL、29.6ng/mL のピークに達し、以後緩徐に消失した。
<再掲>血清中 N-脱メチルクロバザム(M-9)濃度は投与期間中徐々に増加し、最終投与日の濃度は 2811ng/mL と、未変化体の約 8 倍であった。最終投与 3 日後から徐々に低下し、7 日後に 2031ng/mL となった。
<再掲>4. 分布
(1)血液―脳関門通過性
血漿中代謝物組成と大脳内代謝物組成との比較より、未変化体及びN-脱メチルクロバザム(M-9)の脳移行性が他の代謝物より良好であることが示唆される。
<再掲>5. 代謝
(1)代謝部位及び代謝経路
主として肝臓で、N-脱メチル化、5-フェニル基の3',4'位の水酸化、水酸基のメチル化、水酸基及びN位の抱合化等によって代謝される21,22)。主な代謝物は、N-脱メチルクロバザム(M-9)、4'-水酸化-N-脱メチルクロバザム(M-5)及び4'-水酸化クロバザム(M-7)等であった。
<再掲>(4)代謝物の活性の有無及び比率
N-脱メチルクロバザム(M-9)は活性を有する。
<再掲>(5)活性代謝物の速度論的パラメータ
健康成人6例、空腹時30mg1回投与
N-脱メチルクロバザム:Tmax=47.0±8.5h、Cmax=143±19ng/mL、t1/2β=70±15h
<再掲>(4)スチリペントール
本剤はCYP3A4で代謝されること26)、本剤の代謝物N-脱メチルクロバザムはCYP2C19で代謝されること、スチリペントールはその両方を阻害することからから記載した。両剤の併用により本剤及びN-脱メチルクロバザムの血中濃度の上昇が臨床的に認められている41)。
<文献41)の概要>
クロバザム及びバルプロ酸を投与中の37例の小児重症ミオクロニーてんかん患者にスチリペントールを追加投与した後の血漿中濃度を測定した。定常状態におけるの血漿中トラフ濃度はスチリペントール投与前と比較して、クロバザムでは0.39から0.84(mg/L)/(mg/kg)に、N-脱メチルクロバザムでは3.6から11.6(mg/L)/(mg/kg)に上昇した。
<再掲>2)代謝物N-脱メチルクロバザムの一般薬理作用
代謝物N-脱メチルクロバザムはクロバザムと同様の睡眠時間延長作用を示したが、その活性はクロバザムの1/6であった。その他の中枢神経系に対する作用もクロバザムより弱かった。呼吸及び循環器系に対する作用はクロバザムより弱く血圧低下作用も認められなかった。体性神経系、自律神経系及び消化管に対しても、影響しないか、クロバザムより弱い作用しか示さなかった。
一般社団法人 日本神経学会 てんかん治療ガイドライン2010 第12章 薬物濃度モニター

クロバザムの代謝物N-デスメチルクロバザム(N-DMCLB)の場合、N-DMCLBもクロバザムの約1/4の抗けいれん作用あり。CLB:N-DMCLB濃度比は約1:2-3、1:10、1:50-100の3群に分かれ、CLB:N-DMCLBの濃度比が大きいと眠気が出やすい。CBZ, PHT, PBとの併用ではN-DMCLBの割合が大きくなる。N-DMCLBは徐々に上昇、成人では半年後も上昇する。
食後服用のピーク時間。VPA徐放剤の剤型で異なり細粒5-10時間、錠剤13-16時間、空腹時服用では1.3倍遅くなる。
クロバザム(CLB)は,肝臓にてチトクローム-P450(CYP)3A4により活性代謝物であるN-デスメチルクロバザム(N-CLB)に代謝され、N-CLBはCYP2C19により不活化される。
このCYP2C19は日本人の約20%で 遺伝的に欠損しており,欠損者(PM)では有意にN-CLBの血中濃度と血中濃度/投与量比(C/D比)が上昇し(図1a),CLB治療を中止した患者の 割合はPMが最も低かった(図1b).(瀬尾享志他.Pharmacogenomics 9:527, 2008)

CLB/N-CLBの比が抗てんかん作用に影響を及ぼす可能性がある(TDM研究 2008. 成人難治性てんかん患者におけるクロバザムおよび活性代謝物の体内動態に関する解析)
CYP2C19遺伝子多型においてホモ変異型の場合、野生型の場合と比べ、CLB投与量は約半分、N-CLB血中濃度は約2倍、N-CLB/CLB血中濃度比は約3倍と遺伝子型により大きく異なった。また、野生型を有する患者の発作消失が0名だったのに対し、ホモ変異型を有する患者では発作消失が4名と有意な発作の抑制効果がみられたことから、ホモ変異型を有する場合、低用量で有効な治療効果を得られることが示された。
以上の結果より、成人難治性てんかん患者においてCYP2C19遺伝子多型が低用量CLB治療におけるN-CLB血中濃度および有効性と関連していることを明らかとした。
現在、CLB導入前の患者を対象に遺伝子解析を行い、低用量で効果の期待できる患者にCLB治療を選択するといった個別化医療への応用へむけた前方視的な検討を行っている。
(クロバザム及び活性代謝物の薬物動態/臨床効果とCYP2C19遺伝子多型の関連)