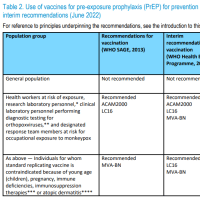
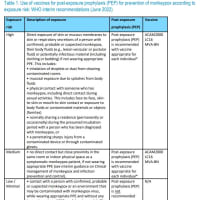
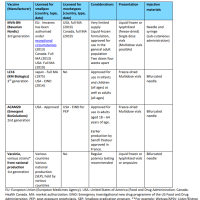
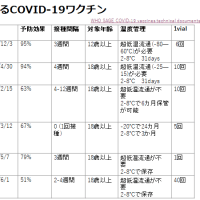
承認ワクチン(日本の特例承認対象国)
1. BioNTech / Fosun Pharma / Pfizer (Germany / Shanghai / USA) 2020/4/20 / 2020/4/29 <3 LNP-mRNAs Vaccine>
2020/12/2 英国承認、2020/12/7バーレーン承認、2020/12/10カナダ承認、2020/12/13米国承認、等
開発ワクチン
2020/12/16時点で、56のワクチンに関する臨床試験が開始済み、166のワクチンが前臨床研究段階
<開発状況>
臨床第三相試験
- Sinovac (China) 2020/7-2021/09 <Inactivated + alum Vaccine>
- Wuhan Institute of Biological Products / Sinopharm (China) approved on 2020/7/8 <Inactivated Vaccine>
- Beijing Institute of Biological Products / Sinopharm (China) approved on 2020/7/8 <Inactivated Vaccine>
- University Oxford (UK) / AstraZeneca (UK-Sweden) Assigned on 2020/6/11 <Non-replicating Viral Vector - ChAdOx1 Vaccine>
- CanSino Biological Inc. / Beijing Institute of Biotechnology (China) 2020/9/15 <Non-replicating Viral Vector - Adenovirus Type 5 Vector Vaccine>
- Gamaleya Research Institute (Russia) <Non-Replicating Viral Vector- Adeno based Vaccine> started on 2020/9/7
- Janssen Pharmaceutical Companies (US) <Non-Replicating viral Vector vaccine (Ad26COVS1) > Study started 2020/9/5
- Novavax (USA) 2020/9/23 < Full length recombinant SARS CoV-2 glycoprotein nanoparticle vaccine adjuvanted with Matrix M>
- Moderna/NIAID (USA) estimated study start date: 2020/7/27 <LNP-encapsulated mRNA>
- Anhui Zhifei Longcom Biopharmaceutical (China) / Institute of Microbiology, Chinese Academy of Sciences <Protein subunit vaccine> approved date; 2020/11/4
- Bharat Biotech (India)<Inactivated> started on 2020/11/11
臨床第二b/三相試験
- BioNTech / Fosun Pharma / Pfizer (Germany / Shanghai / USA) 2020/4/20 / 2020/4/29 <3 LNP-mRNAs Vaccine>
- Inovio Pharmaceuticals (USA)/International Vaccine Institute <DNA plasmid vaccine with electroporation>, 2 dose, 0, 28 days, ID, start date 2020/11/30
- Medicago Inc (Canada) <VLP> start date: 2020/11/19
臨床第二相試験
- Curevac (Germany) <mRNA> started on 2020/9/28
- Shenzhen Kangtai Biological Products Co.,Ltd. (China), Inactivated virus vaccine
- West China Hospital / Sichuan University (China), Protein subunit vaccine
- Jiangsu Provincial Center for Disease Prevention and Control (China), Viral vector (replicating) vaccine
臨床第一/二相試験
- Institute of Medical Biology, Chinese Academy of Medical Sciences (China) <Inactivated vaccine> started on 2020/7/10
- Research Institute for Biological Safety Problems, Rep of Kazakhstan (Kazakhstan) <Inactivated Vaccine> Estimated study start in 2020/9/1
- Osaka University / AnGes / Takara Bio (Japan) <DNA plsmid vaccine + Adjuvant> started on 2020//6/29
- Cadila Healthcare Limited (India) <DNA plasmid vaccine> started on 2020/7/13
- Genexine Consortium (Korea) <DNA Vaccine GX-19> started on 2020/6/17
- Kentucky Bioprocessig Inc (US) <Protein Subunit vaccine> Estimated study start on 2020/7/25
- Sanofi Pasteur (France) / GSK (UK) <S protein (baculovirus production) vaccine> Study star in 2020/9/3
- Arcturus Therapeutics (US) /Duke-NUS <RNA vaccine> Estimated study start in July 2020
- Serum Institute of India (India) / Accelagen Pty (Australia), Virus like particle vaccine
- Instituto Finlay de Vacunas Cuba (Cuba) <Protein Subunit Vaccine>
- Federal Budgetary Research Institution State Research Center of Virology and Biotechnology Vector (Russia), Protein subunit vaccine
- Institute Pasteur(France)/Themis(Austria)/Univ. of Pittsburg CVR (US)/Merck Sharp & Dohme(US) <Replicating Viral Vector (Measles-vector based) vaccine>, 1 or 2 doses, 0, 28 days, IM, Actual Start date: 2020/8/10
- Shenzhen Geno-Immune Medical Institute (China), Viral vector (Non-replicating) +APC vaccine
- Aivita Biomedical, Inc. (Canada), Viral vector (Replicating) +APC vaccine
- Center for Genetic Engineering and Biotechnology (Italy), Protein subunit vaccine
臨床前段階のワクチン候補は100種類以上
主な大手製薬会社等による開発は
- Sanofi/GSK (2020/4/14)
- J&J (2020/3/30)
- GSK / Vir Biotechnology (2020/4/6)
- Sanofi / Translate Bio (2020/3/27)
日本で利用可能となる可能性のあるワクチン
- University Oxford (UK) Assigned が開発するワクチン(ChAdOx1 Vaccine)
英国・スウェーデンのアストラゼネカ社とオックスフォード大学が開発中のワクチンは、ChAdOx1と呼ばれるチンパンジーのアデノウイルスをベースにしている。イギリスとインドで第II/III相試験が、ブラジルと南アフリカで第III相試験を実施中。
早ければ、2020年10月までに緊急使用用のワクチンを供給できる可能性も。ワクチンの総製造能力は20億本で、インドの血清研究所(SII)で、既に数百万回分のワクチンを製造し、臨床試験に用いられている。
(2020/3/19)
日本など複数の国や財団等が出資する「感染症流行対策イノベーション連合」(CEPI)が、英オックスフォード大学とパートナーシップを結ぶ
(2020/5/15)
6匹のサルの研究で肺でのウイルス増殖を抑え肺炎を予防する有効性を示す
(2020/5/21)
日本など複数の国や財団等が出資する「感染症流行対策イノベーション連合」(CEPI)が、英オックスフォード大学とパートナーシップを結ぶ
(2020/5/15)
6匹のサルの研究で肺でのウイルス増殖を抑え肺炎を予防する有効性を示す
(2020/5/21)
米国がワクチン開発のプロジェクトに12億ドルを支援
(2020/6/4)
生産計画を20億本に倍増、米国が3億本、英国が1億本を確保
(2020/6/13)
(2020/6/13)
欧州に最大4億回分供給することで、独仏伊蘭で形成するワクチン同盟と合意
(2020/6/20)
マウスとブタへの接種で免疫原性及びブースター効果が確認された
(2020/6/20)
マウスとブタへの接種で免疫原性及びブースター効果が確認された
(2020/7/20)
英国での第1/2相試験結果、1回接種で抗体は28日目までにピークを迎え、56日目まで高値を維持、SARS-CoV-2に対する中和抗体が90%以上に検出された
(2020/7/30)
アカゲザルに液性/細胞性免疫応答を誘導を確認し、感染チャレンジ試験ではBAL液および下気道組織において、対照動物と比較して有意にウイルス量が減少していることが確認された
英国での第1/2相試験結果、1回接種で抗体は28日目までにピークを迎え、56日目まで高値を維持、SARS-CoV-2に対する中和抗体が90%以上に検出された
(2020/7/30)
アカゲザルに液性/細胞性免疫応答を誘導を確認し、感染チャレンジ試験ではBAL液および下気道組織において、対照動物と比較して有意にウイルス量が減少していることが確認された
(2020/8/7)
厚生労働省は英国アストラゼネカ社が新型コロナウイルスワクチン開発に成功した場合、来年初頭から1億2000万回分(6000万人分)のワクチンの供給(そのうち 3000万回分については第一四半期中に供給)を受けることについて基本合意
厚生労働省は英国アストラゼネカ社が新型コロナウイルスワクチン開発に成功した場合、来年初頭から1億2000万回分(6000万人分)のワクチンの供給(そのうち 3000万回分については第一四半期中に供給)を受けることについて基本合意
- BioNTech / Fosun Pharma / Pfizer (Germany / Shanghai / USA) の開発するmRNAワクチン
ドイツのBioNTech社は、ニューヨークに本社を置くPfizer社、中国の医薬品メーカーであるFosun社と共同でmRNAワクチンを開発に着手。SARS-CoV-2完全長スパイク糖タンパク質をコードするヌクレオシド修飾mRNA(modRNA)ワクチンBNT162b2、30μgの抗原量を2回接種する第2/3相試験を実施中。
(2020/7/1)
7月には、米国とドイツで実施した第I/II相試験の予備的な結果を発表。その結果、ボランティアがSARS-CoV-2に対する抗体や、ウイルスに反応するT細胞と呼ばれる免疫細胞を産生を確認。睡眠障害や腕の痛みなどの中等度の有害事象の報告有。
(2020/7/13)
米国FDAから優先審査の指定を受ける
米国FDAから優先審査の指定を受ける
米国がファイザーが開発するSARS-CoV-2ワクチンを1億本、19.5億米ドルで購入する契約を締結
米国をはじめ、アルゼンチン、ブラジル、ドイツなどの国の120施設で3万人のボランティアを対象とした第2/3相試験を開始すると発表。臨床試験結果次第で、早ければ2020年10月に米国で薬事承認審査を申請し、薬事承認が得られれば、2020年末までに最大1億本、2021年末までに約13億本のワクチンを供給する計画
(2020/7/31)
日本と1億2000万本(6000万人分)のワクチン供給基本合意
日本と1億2000万本(6000万人分)のワクチン供給基本合意
- Novavaxの開発するNVX-CoV2373
COVID-19の遺伝子配列から設計された当社の組換えナノ粒子技術を用いて、コロナウイルススパイクタンパク質に由来する抗原を生成し、Matrix-M™アジュバントと組み合わせることで、効果を高める。現在、臨床第I/II相試験を実施中。
(2020/8/4)
第1相臨床試験では、18~59歳の健康な成人131名を対象に、ノバックス社のCOVID-19ワクチン2回分の投与量(5μgと25μg)を評価。
安全性プロファイルに問題なく、100%に中和力価を誘導。
5μg と 25μg のアジュバント投与では、いずれも 1:3,300 を超えるピークGMT
Matrix-M™アジュバントによる強固な多機能CD4+ T細胞応答の誘導を確認
第1相臨床試験では、18~59歳の健康な成人131名を対象に、ノバックス社のCOVID-19ワクチン2回分の投与量(5μgと25μg)を評価。
安全性プロファイルに問題なく、100%に中和力価を誘導。
5μg と 25μg のアジュバント投与では、いずれも 1:3,300 を超えるピークGMT
Matrix-M™アジュバントによる強固な多機能CD4+ T細胞応答の誘導を確認
(2020/8/7)
製薬大手の武田薬品工業と連携し、日本国内向けに新型コロナウイルスのワクチンの開発や製造を計画。武田製薬は厚生労働省から301億円の助成金を受け、光工場で年間で2億5000万回分の生産能力整備を進める
日本企業によるワクチン開発
- Osaka University / BIKEN / NIBIOHNによるInactivated Vaccine (2020/3/18)
- Osaka University / AngGes / Takara BioによるDNA plasmid Vaccine等 (2020/3/24)
(2020/8/7)
アンジェスは、厚生労働省公募の「令和 2 年度ワクチン生産体制等緊急整備事業」に採択され、国内における新型コロナウイルスワクチンの実生産(大規模生産)体制の早期構築に93億8030万円を受ける。
- アイロムグループによる遺伝子組み換えワクチン(2020/3/23)
- 塩野義製薬による組み換え蛋白ワクチン(2020/4/27)
- 田辺三菱(カナダのメディカゴ社)による植物由来ウイルス粒子を用いたワクチン(2020/3/12)
CEPIによるCOVID-19に対するワクチン開発資金提供
- CureVacによる核酸ワクチンに対して4230万ドル
- Inovio Pharmaceuticalsによる核酸ワクチンに対して6500万ドル
- Moderna, Incによる核酸ワクチンに対して
- University of Queenslandによる遺伝子組み換え蛋白ワクチンに対して1060万ドル
- University of OxfordによるChAOx1ワクチンに対して
- Novavax, Incによる遺伝子組み換え蛋白 nanoparticle techunologyワクチンに対して3億8400万ドル
- The University of Hong Kongによる弱毒生ワクチンに対して60万ドル
- Institut Pasteur, Themis Bioscience, University of Pittsburghによる麻疹ベクターワクチンに対して490万ドル
- Clover BiopharmaceuticalsによるS-Trimer vaccineの開発に対して350万ドル
2020/6/7時点で臨床試験中のワクチン (Lancet, A Mullard)

mRNAワクチン:
ワクチンを製造するのにウイルスを必要としない方法。
mRNAは、SARS-CoV-2ウイルスの表面にあって、ウイルスが細胞に感染するために重要なタンパク質であるスパイク蛋白質を作成するための指示を伝達する。この指示分子を含むワクチンを注入することで免疫細胞に到達し、スパイク蛋白質のコピーを作成するように指示し、細胞がコロナウイルスに感染したかのように反応する。その後、他の免疫細胞が反応して予防のための免疫が誘導される。
ワクチンを製造するのにウイルスを必要としない方法。
mRNAは、SARS-CoV-2ウイルスの表面にあって、ウイルスが細胞に感染するために重要なタンパク質であるスパイク蛋白質を作成するための指示を伝達する。この指示分子を含むワクチンを注入することで免疫細胞に到達し、スパイク蛋白質のコピーを作成するように指示し、細胞がコロナウイルスに感染したかのように反応する。その後、他の免疫細胞が反応して予防のための免疫が誘導される。
DNAワクチンと比較して、抗原の発現時間が短く、宿主遺伝子に組み込まれる可能性もないが、免疫原性が低い、調査mRNAは安定性が低く、大量生産が難しい等の欠点も。
Self-amplifying (sa) RNAワクチンは、自己複製型一本鎖RNAウイルスに由来するレプリコンを遺伝子工学的に操作したものであり、mRNAワクチンの反応が抗原量に依存する欠点を補ったワクチン
saRNAをウイルス粒子にパッケージ化したウイルスレプリコン粒子(VRP)は、最初の感染に続く感染性ウイルス粒子を形成する能力を欠き、RNAのみが更なる増幅能力を有する。
VRPはポジティブセンスとネガティブセンスの両方のRNAウイルスに由来する可能性があるが、後者の方がより複雑。
saRNAワクチンの設計に一般的に使用されてきたポジティブセンスアルファウイルスゲノムには、ベネズエラ馬脳炎ウイルス(VEE)、シンドビスウイルス(SINV)、およびセムリキ森林ウイルス(SFV)等がある。
saRNAにnsP1-4レプリコン配列が含まれているため、製剤化に重要な従来の対応部分よりもはるかに長くなっていることも課題。
DNAワクチン:
mRNAワクチンと同様に抗原蛋白質コーディングのDNA(プラスミド)の断片を直接、細胞内に取り込むことで抗原蛋白を生成
RNAワクチンと比較して、宿主の細胞ゲノムに組み込まれるリスク、抗DNA抗体が産生されるリスクがある
mRNAワクチンと同様に抗原蛋白質コーディングのDNA(プラスミド)の断片を直接、細胞内に取り込むことで抗原蛋白を生成
RNAワクチンと比較して、宿主の細胞ゲノムに組み込まれるリスク、抗DNA抗体が産生されるリスクがある
オックスフォードとアストラゼネカが開発中のアデノウイルスワクチン:
チンパンジーから採取した弱毒の風邪ウイルスであるアデノウイルスの遺伝子を改変して自己複製をできなくした上で、スパイク蛋白の遺伝子と組み合わせることで免疫細胞の標的として免疫を誘導する。
チンパンジーから採取した弱毒の風邪ウイルスであるアデノウイルスの遺伝子を改変して自己複製をできなくした上で、スパイク蛋白の遺伝子と組み合わせることで免疫細胞の標的として免疫を誘導する。
<展望>
開発までに最短で9カ月、最長で2年程度となる可能性(GatesNotes)
<課題>
世界全体に公平な方針と最良の対策となる分配(BMGF)
ウイルスの取り扱いが厳格で動物モデルがない
不適切な免疫原性により、ウイルスに結合した抗体のFc部分を宿主細胞のFc受容体または補体が認識して、ウイルスを細胞内に引き入れるのを助長する現象、抗体依存性感染増強(ADE: Antibody-dependent enhancement)が生じるリスク(エボラワクチンの開発でも認められた)
開発後の実用化(費用、生産量、生産時間、移送、優先順位等)
流行状況、国家間のワクチンの分配
反ワクチン運動の活発化
不適切な免疫原性により、ウイルスに結合した抗体のFc部分を宿主細胞のFc受容体または補体が認識して、ウイルスを細胞内に引き入れるのを助長する現象、抗体依存性感染増強(ADE: Antibody-dependent enhancement)が生じるリスク(エボラワクチンの開発でも認められた)
開発後の実用化(費用、生産量、生産時間、移送、優先順位等)
流行状況、国家間のワクチンの分配
反ワクチン運動の活発化