獲得免疫の液性免疫応答の主役はB細胞です。B細胞は造血幹細胞からリンパ系幹細胞に分化したものです。その後B細胞の免疫グロブリン(H鎖とL鎖)において遺伝子組換え(
VDJ組換え)が起こり、それぞれの免疫グロブリンの構造が変化して、無限と思えるほどの種類の抗原受容体ができます。ただし、その受容体の中でも自己抗原に反応してしまう(自己免疫反応を起こす)ものは除去されます。当初その受容体はIgMとしてB細胞膜上に発現して、骨髄から末梢へ移行していきます。
病原体などの抗原が侵入すると、樹状細胞など
がその抗原(タンパク質)を取り込み分解して、ヘルパーT細胞に抗原提示(
MHCクラスⅡタンパク質ー抗原複合体に結合)します。すると抗原提示を受けたヘルパーT細胞は
サイトカインを分泌し、自らの細胞を増殖してクローン集団を形成します。またTOLL様受容体が識別する病原体の核酸や脂質の内容もヘルパーT細胞に伝えられ、ヘルパーT細胞の性質(
1型ヘルパーT細胞(細胞性免疫反応)と
2型ヘルパーT細胞(液性免疫やアレルギー反応など)の違い)が決まります。
次に、抗原がB細胞のIgM受容体に結合すると取り込まれて分解されて、ヘルパーT細胞に抗原提示します。ヘルパーT細胞はサイトカインを分泌してそのB細胞の増殖を促進させます。その抗原に特異的なB細胞が増殖されクローン集団を形成し、抗体を産出する形質細胞(エフェクターB細胞)と少数の記憶細胞(ゆっくり分裂を継続してクローンを維持する)となります。
B細胞が形質細胞になるときには、定常部が変化(クラススイッチ)します。なお可変部(抗原を認識する部分)は変わりません。ウイルスや細菌の場合には抗体の定常部はIgMから
IgG(主に血液中に存在)に変化し、またダニや花粉などの場合には
IgE(主に上皮組織に存在)に変化します。IgG抗体はウイルスや細菌を直接攻撃(不活化や複合体形成)できますが、IgE抗体はマスト細胞に結合して、マスト細胞が
ヒスタミンや
ロイコトリエンなどを放出させることによってアレルギー反応を起こさせます。
「液性免疫応答
液性免疫応答では、血液、リンパ、組織液中で抗体が病原体の抗原決定基に結合する。動物はその生涯にわたって遭遇しうるほとんどすべての抗原に対して結合可能な驚くほど多種の抗体を産生することができる。
抗体分子には、水溶性で血液やリンパを自由に流れていくものと、B細胞の膜タンパク質として存在するものがある。ある抗原が体内に最初に侵入してくると、その抗原と結合しうる抗体を細胞表面に備えたB細胞がその抗原を認識して結合する。このようにある抗原が特異的にあるB細胞に結合すると、B細胞は活性化され、その細胞膜抗体と同じ特異性を持つ水溶性抗体を大量に分泌し始める。
…毎日、何十億というB細胞(自己を認識する細胞はクローン除去によってすでに除去されている)が骨髄から血液中に動員されている。B細胞は液性免疫応答の根幹である。
B細胞は状況によって形質細胞となる
…B細胞はその細胞表面に受容体タンパク質として発現しているのと同じ抗体を産生する。…B細胞は、受容体に抗原が結合して活性化されると、メモリー細胞と形質細胞(プラズマ細胞)となる。形質細胞はクローンとして増殖し、それらが産生する抗体は血中に分泌される。
多くの場合、B細胞が抗体を分泌する形質細胞になるためには、同じ特異性を持つヘルパーT細胞(TH細胞)も同じ抗原に結合する必要がある。したがって、B細胞は…抗原提示細胞としても機能することなる。B細胞の細胞分裂と増殖はTH細胞から化学情報を受容することにより促進される。
形質細胞になる過程で、細胞質のリボソームと粗面小胞体は著しく増加していく。これらの増加によって、大量に抗体を合成して分泌することが可能になる。1秒間に2000分子ともいわれている。ある1個のB細胞に由来するクローン集団の形質細胞からは、同じ抗体分子、つまり元のB細胞に結合したのと同じ抗原決定基のみに結合する抗体が産生される。したがって、B細胞がクローン的に増殖する場合には抗体の特異性は確保されるのである。
抗体分子の抗原結合特異性は多様であるが、基本構造は共通である
抗体は免疫グロブリンというグループに属するタンパク質である。免疫ブログリンは数種類存在するが、4本のポリペプチド鎖からなるテトラマー(四量体)構造が基本である。この4個のポリペプチド鎖の2本ずつは同じで、それぞれH鎖(重鎖、長い)、L鎖(軽鎖、短い)と呼ばれている。それぞれのポリペプチド鎖には、抗体分子間でほとんど変化のない「定常部」と、抗原に応じて変化する「可変部」が存在する。
■定常部のアミノ酸配列はそれぞれの免疫グロブリンに特異的となる。アミノ酸配列の違いにより、抗原結合部位の三次元構造が異なり、特定の抗原のみに特異的に結合する。
■可変部のアミノ酸配列はそれぞれの免疫ブログリンに特異的となる。アミノ酸配列の違いにより、抗原結合部位の三次元構造が異なり、特定の抗原のみに特異的に結合する。
各抗体分子の2カ所の抗原抗体結合部位は同一である。したがって、抗体と抗原の結合能は二価ということになる。1つの分子に同時に2個の抗原分子が結合できるために、抗体と抗原がお互いに手を繋ぐように数珠繋ぎになり強大な凝集体を形成する。このような巨大抗原ー抗体複合体は目立ちやすくなり、貪食細胞や補体によって効率よく破壊される。
抗体のクラス
可変部はそれぞれの抗原に特異的に結合するために変化する領域であるが、H鎖の定常部は大まかに5種類存在し、それによって抗体分子は5種のクラスに分類される。各クラスで構造や機能が異なり、例えば膜受容体として機能するもの、血中に豊富に存在するもの、外分泌されるもの、アレルギーの原因になるものなどに分類される。
MHCタンパク質は免疫系に抗原を提示する
動物の免疫システムは自己細胞を細胞表面のタンパク質で識別している。この過程には数種類のタンパク質が関与しているが、特に大切なのは主要組織適合抗原遺伝子複合体(MHC)と呼ばれる遺伝子群である。MHCは液性免疫、細胞免疫、そして免疫寛容に重要な役割を担っている。
MHCがコードするタンパク質は細胞膜糖タンパク質である。
…MHCクラスⅡタンパク質はB細胞、マクロファージ、その他の抗原提示細胞の細胞表面のみ存在する。抗原提示細胞がウイルスなど非自己抗原を貪食すると、ファゴソーム(異物を分解する細胞内小胞)で分解が行われる。 そうして作られた断片にMHCクラスⅡタンパク質が結合し、複合体として細胞表面に移動し、ヘルパーT細胞に提示される。
ヘルパーT細胞の細胞表面にはMHCクラスⅡタンパク質を認識して結合するCD4というタンパク質が存在する。
液性免疫応答に関与するヘルパーT細胞とMHCクラスⅡタンパク質
ヘルパーT細胞は抗原提示マクロファージに結合するとサイトカインを分泌し、そのサイトカインによって自分自身が刺激され、その抗原を認識するヘルパーT細胞のクローンが生み出される。この段階が液性免疫応答の活性化段階であり、リンパ組織で行われる。その次のエフェクター(効果)段階では、ヘルパーT細胞は同じ抗原を認識するB細胞を活性化して、その抗原と結合する抗体の産生を開始させる。
B細胞は抗原提示細胞でもある。B細胞は細胞表面の免疫グロブリン受容体に結合した抗原をエンドサイトーシスにより取り込み、分解し、MHCⅡタンパク質と結合させて提示する。ヘルパーT細胞は、B細胞表面に提示されたMHCクラスⅡタンパク質ー抗原複合体に結合すると、サイトカインを分泌してB細胞を増殖させて形質細胞のクローン集団を形成させる。最終的には形質細胞から抗体が分泌され、液性免疫応答のエフェクター段階が完了する。
定常部の変化によるクラススイッチ
…IgMの産生からIgGに切り替えるというように、クラススイッチによって1個のB細胞がある時点から別のクラスの抗体を産生するようになる。
B細胞は初期にはIgMを産生する。IgMはある抗原決定基を認識するための受容体として機能する。この時期には、抗体H鎖の定常部は可変部遺伝子(V、D、J遺伝子)直下のμ遺伝子がコードしている。その後、液性免疫応答によりB細胞が形質細胞に変化すると、その細胞のゲノムDNAに欠落が生じて、可変部近傍のμ遺伝子よりも遠方の定常部遺伝子が組み込まれるようになる。このようなDNA欠損により最終的な抗体分子の定常部は異なったものとなり、その機能も変化する。しかし、可変部は以前のものと同じであり、抗原に対する特異性は変化しない。IgM以外のクラスは、IgA、IgD、IgE、IgGの4種類であり、それぞれ定常部が異なっている。(引用終わり)
」
「獲得免疫系の第一の目的は、無限に存在するかもしれない外来微生物等の抗原を、いかにきちんと認識するのかという基本的な仕組みを確立することである。このためには、抗原受容体の種類がきわめて多種類存在することが必要である。限られた遺伝情報の中から、どうやって何千万、何億もの種類の抗原受容体を生み出すことができるのであろうか。この謎に対する答えとしては、遺伝子の断片の組み合わせによって新たな遺伝子を生み出すという巧妙な方法が、利根川進らによって明らかにされた。
「VDJ組換え」と呼ばれるこの遺伝子組換えの仕組みは、抗体遺伝子(B細胞受容体)とT細胞受容体遺伝子の両方に用いられており、この組換えを行うRAG1とRAG2という酵素もBリンパ球とTリンパ球に共通である。
このような遺伝子組換えが起こる仕組みは、脊椎動物のかなり早い時期に始まったと思われる。しかし、脊椎動物の祖先系と考えられる脊椎動物である
ヤツメウナギやメクラウナギなどには、この仕組みは存在しない。またRAG1とRGA2の遺伝子にはイントロンがなく、遺伝子の組換えを行う仕組みが決まったDNA配列を目印とした断片のつなぎ合わせ様式となっている。これらの特徴が、トランスポゾンと呼ばれる自ら遺伝子改変を行う仕組みときわめて似ていることから、その進化の原点はトランスポゾンが脊椎動物の祖先系に侵入したことに起源があるのではないかと考えられている。つまり、今日地球上に存在する脊椎動物の祖先のどこかで、このようなトランスポゾンの感染が生殖細胞に起こり、今日地球上に存在する脊椎動物はすべてその子孫であるという驚くべき推論であるが、今日それが多くの研究者の支持を受けている。
…抗体を作るBリンパ球の中では、抗原刺激によってAID(活性化誘導性シチジンデアミナーゼ)という分子の発現が誘導される。AIDの発現により、抗体遺伝子に2つの遺伝的な変異が導入される。第一は、抗体の可変部、すなわち抗原認識部位に塩基の置換(体細胞突然変異)が導入され、抗原と結合力の高い抗体を作り出す。先のVDJ組換えによって作り出された抗体レパートリーの中から、抗原を認識した細胞がAIDを発現し、その細胞の抗体遺伝子に、さらに細かい塩基の変異が導入される。
…AIDの発現により第二の変化は、抗体のクラスを変えることである。通常のBリンパ球は免疫ブログリン(Ig)のうちIgMを産生しているが、抗原刺激によってIgG、IgE、IgAなどの抗体を産生する細胞に変わる。この変化は「クラススイッチ」と呼ばれ、この際には遺伝子の大幅な欠失を伴うDNAの組換えが起こる。このようなクラスの変化(クラススイッチ)は、結合した抗原をどのような仕組みで処理するかという、抗体の効果の多様性を生み出す。また体の特定な場所に特化した機能を生み出す。
…AIDの誕生は、RAG1、RAG2より進化の上で古いことが明らかになった。すなわち、脊索動物であるヤツメウナギやメクラウナギにすでにAIDの祖先型が存在している。興味深いことに、これらの生物における抗原受容体は、RAG1、RAG2によって作られる今日型の抗原受容体とまったく異なる構造をし、非常に強い接着性を持ったVLRと呼ばれる分子であることがクーパーらによって明らかにされた。VLRは、AID祖先型分子により遺伝子断片の情報をつなぎ合わせる遺伝子変換と呼ばれる遺伝子再構成を用いながら抗原受容体を作り上げていたのである。
この仕組みは、今日、AID自身の働きにも引き継がれており、体細胞突然変異や遺伝子変換、クラススイッチにおける遺伝子切断などの仕組みは、おそらく基本的に同じものであったと考えられる。
…VLRの消失の理由は、先に述べたRAG1、RAG2を含むトランスポゾンの感染が脊椎動物の初期段階で起こったことにより、新しい免疫受容体の多様化機構が生じたことによると思われる。(引用終わり)」
「…樹状細胞の量を増やすと、抗体をつくるB細胞が大幅に増大したことがわかる。一方、マクロファージの数を増やしても、抗体をつくるB細胞はほとんど増加しなかった。
…稲葉の実験は、T細胞に異物の断片を見せる抗原提示の主役は樹状細胞であることを雄弁に物語っていた。マクロファージに抗原提示の働きがないとまではいわない。しかしマクロファージの働きは弱く、樹状細胞のそれはとても強かったのだ。」
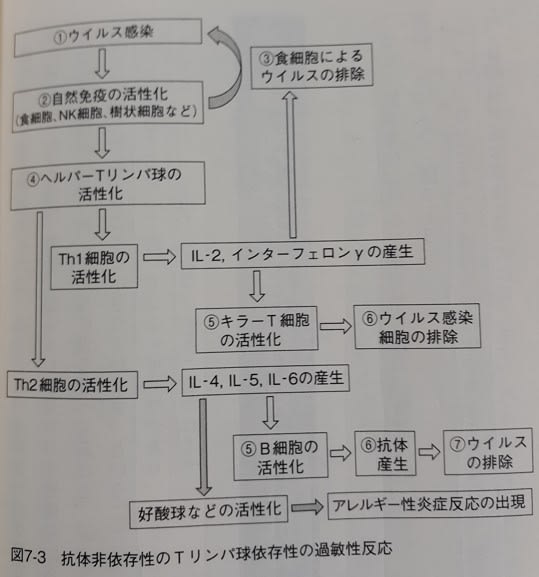
「…ヘルパーT細胞は、刺激を受けると、活性化され、Th1細胞と、Th2細胞などに分化します。
Th1細胞は、インターロイキン2(IL-2)やインターフェロンγなどのサイトカインを作り、自然免疫細胞や…キラーT細胞を刺激します。特に、キラーT細胞に対してはウイルス感染細胞を殺すように促します。
一方、Th2細胞はインターロイキン4、5、6(IL-4、IL5、IL-6)などのサイトカインを作り、B細胞を刺激して抗体を作るように促します。
(引用終わり)」
「…樹状細胞が抗原提示したとき、同時にエンドトキシンなどの細菌やウイルスの成分(アジュバンド)で刺激された場合、つまり細菌感染やウイルス感染の場合は、細菌やウイルスの核酸や脂質成分を認識するTOLL様受容体を介して樹状細胞はインターロイキン12を分泌します。また、その膜構造に変化が生じます。その結果、樹状細胞と接触しているナイーブ細胞はサイトカインとしてインターフェロンγを分泌し始めます。
つまり、TOLL様受容体が認識するのは抗原やアレルゲンなどのタンパク質ではなく、細菌のウイルスに存在する特有の構造を持つ核酸や脂質などのアジュバンドなのです。このアジュバンドの作用により樹状細胞の膜構造などの変化を経て、ナイーブT細胞はインターフェロンγを分泌する1型ヘルパー細胞に変身しながら増殖していきます。
樹状細胞がアレルゲンと遭遇し、アレルゲン構造物をナイーブT細胞に提示したときにプロスタンという物質で同時刺激された場合は、細菌やウイルス由来のアジュバントにTOLL様受容体を刺激されたときとは別な膜構造を持つようになります。その結果、樹状細胞と接触するナイーブ細胞は先ほどのインターフェロンγではなく、今度はインターロイキン4を分泌し始めます。つまり、ナイーブ細胞はインターロイキン4を分泌する2型ヘルパー細胞に変身しながら増殖します。
…1型ヘルパー細胞はB細胞に働き、細菌・ウイルスを効率よく撃退するためにIgG抗体を作らせます。IgG抗体は細菌を破壊したり、ウイルスが細胞に感染しないようにしたりします。このとき活躍した1型ヘルパー細胞とB細胞は増殖して長くリンパ節にとどまるので、二度目の細菌・ウイルスの侵入ではすばやく反応し、大量のIgG抗体が作られます。そのため細菌やウイルスは最初の感染のときよりも迅速に撃退されます。
ダニや花粉などのアレルゲンは細菌やウイルスと違い、通常は粘膜上皮細胞のバリアーを壊して侵入することはありません。しかし、…バリアー機能が低下したときに、ダニや花粉などのアレルゲンを吸い込むと体の中に入り込んでしまうのです。
…細菌やウイルスの成分が混じっていない場合、樹状細胞はその異物が有害でないと判断し、情報を2型ヘルパー細胞に伝えます。…そして、2型ヘルパー細胞からB細胞が情報を受け取り、IgG抗体を作ります。
…IgG抗体が細菌やウイルスを攻撃するとの違って、IgE抗体には直接アレルゲンを攻撃する働きはありません。
…マスト細胞の表面にはIgEと強く結合するIgE受容体が非常に多数(1万から20万)存在していて、アレルゲンが二回目以降に体に侵入するとマスト細胞の表面に結合しているIgE抗体と結合します。すると、IgE受容体が刺激されることにことにより、マスト細胞はヒスタミンやロイコトリエンを含んだ顆粒を放出してアレルギー反応をおこすのです。(引用終わり)」
「1965年、オハイオ州立大学のBruce Glickは孵化したばかりのニワトリのファブリキウス嚢 (Bursa Fabricii) を除去すると抗体の産生が起こらないことを発見した。その後、マックス・クーパーとRobert A. Goodにより鳥類における抗体産生の前駆細胞の分化成熟に必要であることが証明され、器官の頭文字を取ってB細胞と命名された。哺乳動物にはこの器官は存在せず、骨髄 (bone marrow) でつくられることが確認された。偶然にも頭文字が同じであることから、そのままB細胞という名称が定着した。
…抗体は特定の分子にとりつく機能を持った分子で、その働きによって病原体を失活させたり、病原体を直接攻撃する目印になったりする。そのため、抗体を産生するB細胞は免疫系の中では間接攻撃の役割を担っており、その働きは液性免疫とも呼ばれる。
B細胞は細胞ごとに産生する抗体の種類が決まっている。自分の抗体タイプに見合った病原体が出現した場合にのみ活性化して抗体産生を開始することになる。また、いったん病原体が姿を消しても、それに適合したB細胞の一部は記憶細胞として長く残り、次回の侵入の際に素早く抗体産生が開始できるようになる。この働きによっていわゆる「免疫が付く」(免疫記憶)という現象が起きており、予防接種もこれを利用したもの。
哺乳動物においては、B細胞は骨髄に存在する造血幹細胞から分化したのち、脾臓などの二次リンパ組織に移動し、抗原に対する反応に備える。 また一部のB細胞には、消化管上皮、粘膜組織など、外来抗原との接触頻度の高い組織に移動する集団も存在する。
細胞表面の抗原レセプターとして細胞膜結合形の免疫グロブリン(Ig)を発現しており、これによって自分に適合した抗原の出現を察知する。抗原が適合した場合には、それを細胞内に取り込んだ後、抗原提示する。提示された抗原をヘルパーT細胞が認識すると、ヘルパーT細胞からの刺激を受け、形質細胞に分化することになる。形質細胞に分化すると分泌形の免疫グロブリンを抗体として産生するようになる。
細胞表面の抗原レセプターとして細胞膜結合形の免疫グロブリン(Ig)を発現しており、これによって自分に適合した抗原の出現を察知する。抗原が適合した場合には、それを細胞内に取り込んだ後、抗原提示する。提示された抗原をヘルパーT細胞が認識すると、ヘルパーT細胞からの刺激を受け、形質細胞に分化することになる。形質細胞に分化すると分泌形の免疫グロブリンを抗体として産生するようになる。
B細胞を始めとした全ての血球細胞は、骨髄中の造血幹細胞が分化したものである。始めに造血幹細胞はリンパ系幹細胞へ分化する。次いでプロB細胞を経てH鎖の遺伝子再構成が起きる。完成したH鎖とSL鎖(V-preB・lambda5)とともにpre-BCRを形成、大型プレB細胞となる。そこでpre-BCRシグナルにより一度増殖した後に、L鎖の遺伝子再構成が引き起こされ、やがて小型プレB細胞へと分化する。完成したL鎖はH鎖とともにIgMを形成して、細胞膜上に発現する。そしてIgMとともに同じ抗原特異性をもつIgDも発現し、B細胞は骨髄から末梢へと移行し、脾臓において成熟B細胞となる。B細胞は、抗原の存在下で抗体を産生するべく、形質細胞(プラズマ細胞、plasma cell)へと最終的に分化する。
…B細胞の活性化には一般に、B細胞受容体、B細胞補助受容体、およびCD4陽性T細胞からのシグナルの3つが必要である。
成熟ナイーブB細胞は表面にIgMを発現しており、これらが微生物表面の抗原により架橋されることによりB細胞内へシグナルが伝達される。B細胞膜において、IgMはIgαおよびIgβと呼ばれる膜貫通タンパクと会合しており、これらの会合体が機能的なB細胞抗原受容体 (B cell receptor, BCR) である。このIgβの細胞質部分に存在するチロシン残基がリン酸化されることにより、シグナル伝達経路が始動する。
B細胞補助受容体はCD21 (補体受容体2、CR2)、CD19、およびCD81からなる。ある種の病原体表面は補体を分解する特性を持っている。このため、補体断片C3dが沈着することになるが、CD21はこの分子と結合することができる。このようにしてB細胞受容体とB細胞補助受容体が同時に会合すると、Igαに細胞質部分で会合したチロシンキナーゼによってCD19がリン酸化され、シグナル伝達経路が始動する。
さらに、胸腺非依存性抗原を除く抗原による活性化においてはCD4陽性T細胞の分泌するサイトカインが必要である。B細胞はB細胞抗原受容体により受容体介在性エンドサイトーシスにより抗原を取り込むことができる。取り込んだ抗原を提示したMHC IIとCD4陽性T細胞が相互作用すると、B細胞表面のCD40とT細胞表面のCD40Lの結合、およびT細胞から産生されるサイトカインの刺激によりB細胞が活性化される。」