1.IgG4とは
IgGとはB細胞が産出する免疫ブログリン(抗体)の一つで、主に血液中に存在しています。その他にIgE(上皮組織に存在し、花粉症などアレルギー引き起こす)などがあります。
IgGの中にもまた種類があり、IgG4はその中では比率が一番少なく(通常4%ほど)、免疫活性化は弱いようです。IgG4は抗原の刺激により、主にアレルギー反応に関係するTh2タイプのサイトカインであるIL4、IL-13によって産生誘導されるよです。Th2が優位な状態で、さらにregulatory T細胞(IL-10を産生する)が活性化さされると、IgG4が産生誘導されると考えられています。Th2サイトカインは、IgEや好酸球浸潤を誘導し、またregulatory T細胞はTGFβを産生して線維化を促進します。これらのサイトカインがIgG4関連疾患で見られるIgE高値、好酸球浸潤、病変の線維化に関与すると考えられています。
「ヒトには 4 つの IgG サブクラス (IgG1、2、3、および 4) があり、血清中の存在量の多い順に名前が付けられています (IgG1 が最も豊富です)。

IgG サブクラスの相反する特性 (補体を固定するものと固定しないもの、FcR に結合するものと結合しないもの)、およびほとんどの抗原に対する免疫応答には 4 つのサブクラスすべての混合が含まれるという事実を考慮すると、IgG がどのように機能するかを理解することは困難でした。サブクラスは連携して防御免疫を提供できます。2013 年に、ヒト IgE および IgG 機能の時間モデルが提案されました。このモデルは、IgG3 (および IgE) が応答の初期に現れることを示唆しています。IgG3 は親和性が比較的低いですが、外来抗原を除去する際に IgG を介した防御が IgM を介した防御に加わることを可能にします。続いて、より親和性の高い IgG1 および IgG2 が生成されます。形成される免疫複合体におけるこれらのサブクラスの相対的なバランスは、その後の炎症プロセスの強さを決定するのに役立ちます。最後に、抗原が存続すると、高親和性 IgG4 が生成され、FcR 介在プロセスの抑制を助けることで炎症を抑えます。」
2.IgG4関連疾患
このIgG4ですが、原因不明の全身性・慢性炎症性疾患によりその数値が上昇(IgG4を産生する「IgG4陽性形質細胞」の増加)することから、「IgG4関連疾患」と呼ばれているようです。
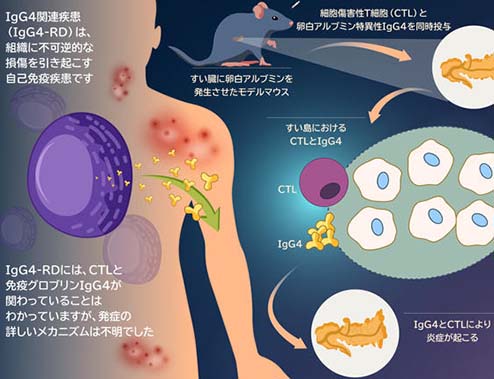
東京理科大学の久保教授らのグループは、マウスを使った実験で、血中にIgG4抗体が存在すると、免疫系の細胞の一つで異物を破壊する能力を持つ「細胞傷害性T細胞」の組織傷害の程度が大きくなり、組織の炎症が増悪することを発見されました。血中にIgG4抗体が存在すると、T細胞と同じく免疫系の細胞の一つであり、体内に侵入した異物の特徴を他の細胞に提示する「樹状細胞」の働きが促進され、そのことによって細胞傷害性T細胞が活性化しやすくなっているとのことです。
「IgG4関連疾患(-かんれんしっかん、英:IgG4-related disease)とは、免疫グロブリンGのサブクラスIgG4が関係する血清IgG4高値と罹患臓器への著明なIgG4陽性形質細胞浸潤を特徴とする原因不明の全身性、慢性炎症性疾患である。日本から世界に発信している新しい疾患概念で、血清IgG4上昇を認めることからIgG4疾患とも呼ばれる。
…IgG4関連疾患は、自己免疫性膵炎やキャッスルマン病を代表とする多彩な臓器疾患を包括する疾病概念で、高IgG4血症(血清IgG4高値)と共に、全身臓器に腫大や結節・肥厚性病変を認め、且つリンパ球、IgG4陽性形質細胞の著しい浸潤と線維化が生じる疾患と定義される。涙腺、唾液腺、膵臓、後腹膜、腎臓、前立腺、リンパ節などに病変を認めることが多い。患者数は増加傾向にあるが患者そのもののが増加したのでは無く、診断技術・能力の向上により従来は他疾患や診断不能であった患者が、IgG4関連疾患と診断された為である。」
「IgG4は、健常人では全IgGの5%以下で、IgG1~G3と比べると最も少ない。その濃度は、1-140mg/dlと個人差がある。IgG4のFc領域は、補体(C1q)やFcγ受容体への結合が弱く、免疫活性化における役割は少ないと考えられている。興味深いことにIgG4は、形質細胞より分泌された後、他のIgGと異なり、Fab領域が他のFabと交換され、1分子で異なった2つの抗原を認識(bispecific Ab)できるようになることである。こうしたできたBispecific抗体は抗原を架橋せず、免疫複合体形成能の低下によって抗炎症作用を示すと考えられている。
IgG4産生は、抗原刺激下で、主にアレルギー反応に関与するTh2タイプのサイトカインであるIL4、IL-13によって産生誘導される。IgEもTh2タイプのサイトカインで産生誘導を受けるが、IL-10、IL-12、IL-21が存在すると、産生はIgEよりIgG4の方に傾く。Th2優位な状態において、さらにregulatory T細胞(IL-10を産生する)が活性化された状況のときに、IgG4が産生誘導されると考えられている。Th2サイトカインは、IgEや好酸球浸潤を誘導し、またregulatory T細胞はTGFβを産生して線維化を促進する。これらのサイトカインがIgG4関連疾患で見られるIgE高値、好酸球浸潤、病変の線維化に関与すると考えられる。
IgG4関連疾患において産生されるIgG4の役割についてはよく解っていない。自己免疫として組織障害をおこす自己抗体として産生される、あるいは、炎症性の刺激に反応して産生される、との2つの考えがある。確かに、尋常性天疱瘡や落葉状天疱瘡での抗デスモグレイン抗体、血栓性血小板減少性紫斑病での抗ADAMTS13抗体として、IgG4クラスの自己抗体が報告されている。一方、上記したようなIgG4関連疾患では、確立した自己抗体が見つかっていないことや、IgG4は抗炎症作用を持つとの考えから、炎症性の刺激に対する反応として、IgG4が産生されるとの考えがある。」
「…IgG4は、細菌やウイルスなどの病原体に対して身体が抵抗するためのシステム「免疫」に関わるタンパク質です。身体に侵入した病原体や、病原体に既に侵された細胞などと結合し、病原体を無力化したり、白血球などの免疫細胞が病原体を攻撃する際の目印として働いたりする物質をまとめて抗体と呼びますが、IgG4もこの抗体の一つです。
IgG4関連疾患の患者では、臓器に腫れがみられるほか、血中のIgG4の濃度が正常値と比べて高くなっており、IgG4を産生する「IgG4陽性形質細胞」が異常に増えて臓器に浸潤しています。逆に言えば、この三つを除いて患者同士で共通する特徴はあまりありません。炎症が起こる臓器は患者によってまちまちで、起きた臓器や炎症の程度によって自覚症状も異なります。ステロイド剤など免疫を抑える薬で症状が改善する場合が多いことから、自己免疫疾患であると考えられていますが、疾患の発生、進行などのメカニズムには不明な点が多く、治療法の開発のためにもメカニズムの解明が待たれていました。
久保教授らのグループでは、マウスを使った実験で、血中にIgG4抗体が存在すると、免疫系の細胞の一つで異物を破壊する能力を持つ「細胞傷害性T細胞」による、組織傷害の程度が大きくなり、組織の炎症が増悪することを発見しました。血中にIgG4抗体が存在すると、T細胞と同じく免疫系の細胞の一つであり、体内に侵入した異物の特徴を他の細胞に提示する「樹状細胞」の働きが促進され、そのことによって細胞傷害性T細胞が活性化しやすくなっていました。これらのことから、IgG4関連疾患に特徴的な強い炎症はIgG4抗体と細胞傷害性T細胞の相乗効果によるものである可能性が示唆されました。」
3.IgG4増加とmRNAワクチン
最近の調査でmRNAワクチンを2回以上接種した人のIgG4濃度が異常に高くなっていることが分かってきました。
IgG4抗体の増加の重要な要因は、過剰な抗原濃度、反復接種、使用したワクチンの種類の3つであると言われています。
mRNAワクチンの反復接種後のIgG4の増加は、保護メカニズムになるのではなく、むしろ天然の抗ウイルス応答を抑制することにより、SARS-CoV2の感染と複製を阻止できないスパイクタンパク質に対する免疫寛容のメカニズムになってしまうとのことです。また高抗原濃度のmRNAワクチン接種を繰り返すことにより、IgG4合成が増加して、自己免疫疾患の原因となり、感受性の高い人においては、がんの増殖や自己免疫性心筋炎を促進する可能性もあるとのことです。
「概要:コロナウイルスSARS-CoV-2の世界的な出現から1年も経たないうちに、mRNA技術に基づく新しいワクチンプラットフォームが市場に導入されました。世界では、多様なプラットフォームのCOVID-19ワクチン約133億8000万回分が投与されました。現在までに、全人口の72.3%が少なくとも一度はCOVID-19ワクチンを接種しています。これらのワクチンによる免疫力が急速に低下し、合併症を持つ人の入院や重症化を予防する能力が最近疑問視されています。また、他の多くのワクチンと同様に、滅菌免疫が得られず、再感染が頻繁に起こることが示されつつあります。また、最近の調査では、mRNAワクチンを2回以上接種した人のIgG4濃度が異常に高いことが判明しています。
HIV、マラリア、百日咳の各ワクチンも、通常よりも高いIgG4合成を誘導することが報告されています。全体として、IgG4抗体へのクラス転換を決定する重要な要因は、過剰な抗原濃度、反復接種、使用したワクチンの種類、の3つであるとされています。IgG4レベルの増加は、IgE誘導作用を抑制することにより、アレルゲン特異的免疫療法の成功時に起こるのと同様に、免疫の過剰活性化を防ぐことで保護する役割を持つ可能性が示唆されている。しかし、mRNAワクチンの反復接種後に検出されたIgG4レベルの増加は、保護メカニズムではなく、むしろ、天然の抗ウイルス応答を抑制することにより、SARS-CoV2の感染と複製を阻止できないスパイクタンパク質に対する免疫寛容メカニズムである可能性を示す証拠が登場しています。また、高抗原濃度のmRNAワクチン接種の繰り返しによるIgG4合成の増加は、自己免疫疾患の原因となり、感受性の高い人においては、がんの増殖や自己免疫性心筋炎を促進する可能性があります。」