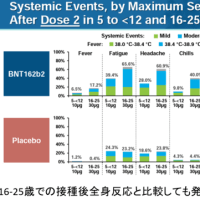
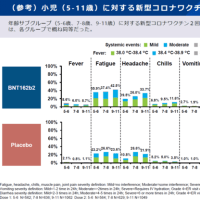
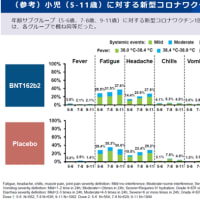
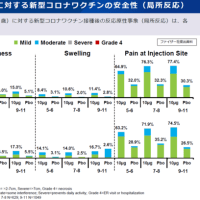
ディアコミットのインタビューフォームより抜粋(詳細はディアコミットの添付文書・インタビューフォームを参照)
開発の経緯
ディアコミット ドライシロップ分包250mg / 500mg・同カプセル250mg(一般名:スチリペントール)は、フランスのBIOCODEX社により1978年に創製された芳香族アリルアルコール構造を有する新規の経口抗てんかん薬である。
非臨床試験では、薬物誘発痙攣、遺伝性てんかんモデルにおける痙攣等、各種てんかん動物モデルに対して有効性が認められ、1980年代からBIOCODEX社によ
り主に難治性のてんかんを対象に臨床検討されてきた。
海外では、生後1年以内に発病し、小児てんかんの中でも薬剤抵抗性で極めて治療困難な希少疾病である「乳児重症ミオクロニーてんかん」(Severe Myoclonic Epilepsy in Infancy: SMEI、Dravet症候群)患者を対象として、クロバザム(CLB)及びバルプロ酸ナトリウム(VPA)との併用投与による2つのプラセボ対照比較試験がフランス及びイタリアにおいて実施された。
その結果をもとに、「クロバザム(CLB)及びバルプロ酸(VPA)で十分な効果が認められないSMEI(Dravet 症候群)患者の難治性の全般性強直間代発作に対するCLB
及びVPAとの併用療法」を効能・効果として2007年1月に欧州で承認された。現在フランスやドイツを含む欧州10箇国において、DIACOMITの商品名で販売されている。
本剤の作用機序の詳細は明確ではないが、主なメカニズムとして、1)脳の主要な抑制性神経伝達物質であるGABAシグナル伝達の増強作用〔①神経終末より放出されたGABA取り込み阻害作用、②GABA分解酵素であるGABAトランスアミナーゼ活性阻害作用による脳組織中のGABA濃度の増加作用、③GABAA受容体のシグナル伝達における促進性アロステリック調節作用(GABAA受容体の開口時間を延長させ、GABAA受容体による神経伝達を増強)〕、2)チトクロームP450アイソザイムの阻害作用に基づく他の併用薬の効果増強作用等の関与が考えられている。
本邦では、2007年7月に開催された第13回未承認薬使用問題検討会議において、早期に臨床試験を実施すべきとの結論が出されたのを受け、Meiji Seikaファルマ株式会社(当時 明治製菓株式会社)が、2010年4月よりDravet症候群患者を対象とした一般臨床試験を開始した。その結果、欧州のプラセボ対照比較試験結果を支持する有効性、安全性及び薬物動態の成績が得られ、2012年9月本剤はCLB及びVPAで効果が不十分なDravet症候群患者に対する新たな治療選択肢として、以下の効能・効果について承認された。
2.製品の治療学的・製剤学的特性
(1) Dravet症候群に対する適応注)を有する本邦初の抗てんかん薬である。
(2) Dravet症候群患者に対して優れたてんかん発作抑制作用を示す。
国内臨床試験において、12週間投与による1~18歳の被験者のResponder rate(投与前の発作回数が
50%以上減少した患者の割合)は65.0%であった。欧州で実施された2つのプラセボ対照比較試験におけるResponder rateと同程度の結果であり、2試験を併合解析したプラセボ群のResponder rate(6.5%)を上回っていた。また、長期投与試験において、効果の持続性が確認された。
(3) 主な作用機序として、1)抑制性神経伝達物質GABAのシグナル伝達の増強作用 2)チトクロームP450アイソザイムの阻害作用に基づく、併用抗てんかん薬の効果増強作用等の関与が考えられている。
(4) 1歳から30歳までのDravet症候群患者を対象とした国内臨床試験において、安全性解析対象例24例中、22例(91.7%)に副作用が認められた(承認時)。
重大な副作用として好中球減少症、血小板減少症(頻度不明)があらわれることがある。
用法及び用量
通常、1 歳以上の患者には、スチリペントールとして1 日50 mg/kg を1 日2~3 回に分割して食事中又は食直後に経口投与する。投与は1 日20 mg/kg から開始し、1 週間以上の間隔をあけ10 mg/kg ずつ増量する。ただし、体重50 kg 以上の患者には、スチリペントールとして1 日1000 mg から投与を開始し、1 週間以上の間隔をあけ500 mg ずつ増量する。なお、1 日最大投与量は50 mg/kg 又は2500 mg のいずれか低い方を超えないこととする。
(1) Dravet 症候群患者を対象とした本剤単剤での国内外の臨床試験は実施されていない。国内外の臨床試験において、「クロバザム及びバルプロ酸ナトリウムで十分な効果が認められないDravet 症候群患者における間代発作又は強直間代発作に対するクロバザム及びバルプロ酸ナトリウムとの併用療法」においてのみ本剤の有効性が示されているので、本剤単独では投与せず、クロバザム及びバルプロ酸ナトリウムを十分量投与し効果が認められない場合に本剤を併用投与すること。
国内第Ⅲ相試験及び長期投与試験はクロバザム及びバルプロ酸ナトリウムの他に、臭化剤(臭化ナトリウム、臭化カリウム)の併用を可能として実施された。この他の抗てんかん薬を併用した場合の安全性及び有効性については、明確になっていない。
(2) 本剤の開始又は増量により、食欲減退、傾眠、ふらつき等が認められた場合は、血中濃度推移等を確認し、原因と考えられる併用抗てんかん薬の減量を考慮すること。減量が必要と判断された場合には、患者の状態をみながら、原因と考えられた薬剤について、可能な限り1 週間以上の間をあけ、ゆっくりとした減量を検討すること。
【減量方法の目安】
国内第Ⅲ相試験及び長期投与試験では、クロバザムは投与量の25%の割合、バルプロ酸ナトリウムの場合は投与量の20%の割合で減量されていた。
併用抗てんかん薬を減量しても改善しない場合は、本剤を減量すること。国内長期投与試験では、本剤は投与量の約5%から30%の範囲で減量されていた。併用薬同様、患者の状態を観察しながら、可能な限り1 週以上の間をあけ、ゆっくりとした減量を検討すること。
(3) 本剤は必ず食事中又は食直後に服用するよう指導すること。空腹時の服用では血中濃度が十分に上がらない可能性がある。
(4) ドライシロップ剤とカプセル剤の生物学的同等性は示されていない。ドライシロップ剤とカプセル剤の切り換え時には、慎重に患者の状態を観察するとともに、必要に応じて本剤及び併用抗てんかん薬の血中濃度を測定すること。
(5) 肝機能障害又は腎機能障害を有する患者を対象とした国内外の臨床試験は実施されていない。このような患者では、本剤のクリアランスが低下している可能性があり、本剤及び本剤の代謝物の血中濃度が上昇すると考えられ、肝機能障害、腎機能障害を悪化させるおそれがある。肝機能障害患者又は腎機能障害患者に投与する場合には、低用量から開始し、本剤及び併用抗てんかん薬の血中濃度測定を行い、慎重に観察しながら徐々に増量すること。
(6) ドライシロップ剤は用時調製の製剤である。分包を開封して処方しないこと。
臨床効果
国内臨床成績
① 第Ⅲ相試験の臨床成績
② 長期投与試験の臨床成績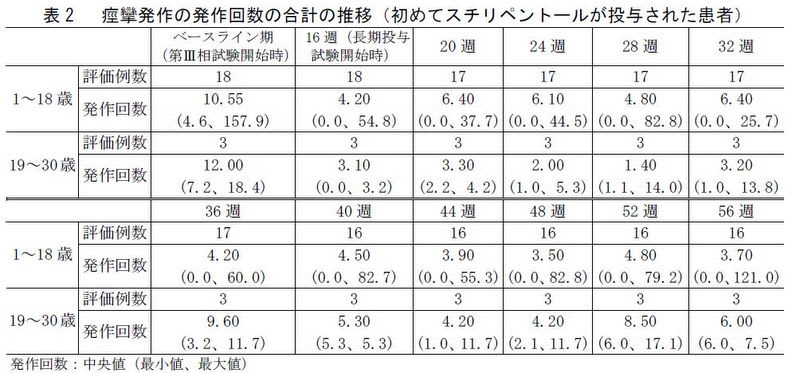
③国内臨床研究2)において本剤が投与された患者による長期投与試験(52 週間)の臨床成績
海外臨床成績 
薬物動態、薬物濃度の推移
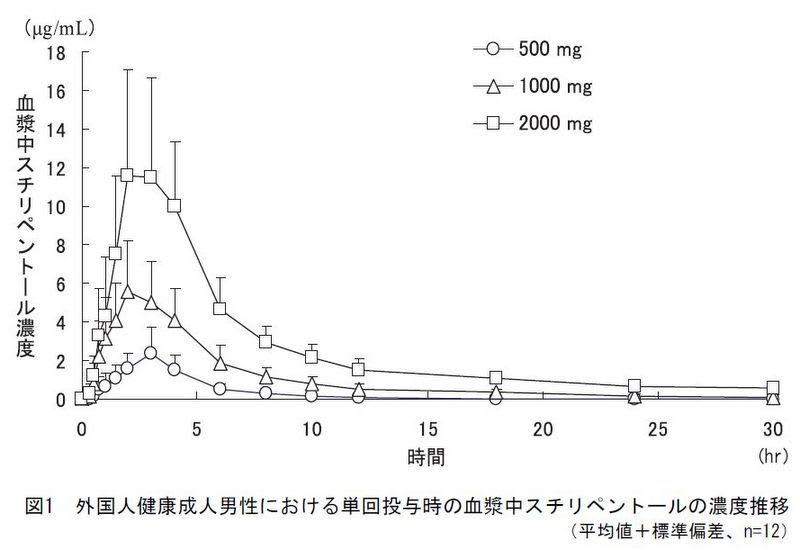
スチリペントール1000mgを内服後、3時間以内に薬物血中濃度は最高値に達し、内服から8時間後に半分の濃度まで低下する。
ドライシロップ製剤はカプセル製剤と比較して薬物血中濃度が高くなる
スチリペントールを空腹時(食前)に内服すると、食後に内服した場合と比較して薬物血中濃度の最高値が約40-50%低下する。
スチリペントールを併用するとクロバザムの薬物血中濃度が併用しない場合と比較して、2-3倍になる。眠気、低血圧、易刺激性等のクロバザムの中毒症状がある場合には、クロバザムを1週間に25%の割合で漸減する。



分布
(1) 血液脳関門通過性:該当資料なし
<参考:ラット24)>非妊娠ラットに[14C]-スチリペントールを200 mg/kg 単回経口投与したとき、脳組織中濃度は投与1 から6 時間において同程度の濃度を維持し、その濃度は、血漿中濃度の約1/3~1/2 であった。
(2) 血液-胎盤関門通過性:該当資料なし
<参考:ラット24)>妊娠ラットに、[14C]-スチリペントールを200 mg/kg 単回経口投与したとき、胎盤を通して胎仔へ移行した放射能は常に血液中濃度よりも低く、スチリペントールの胎仔移行性は低いと考えられた。その濃度は、投与6 時間後の血漿中濃度の1/4 程度であった(表5)。
(3) 乳汁への移行性:該当資料なし
<参考:ヤギ25)>授乳中の雌ヤギにスチリペントール 200 mg/kg を1 日1 回、7 日間反復経口投与し(n=5)、各投与日の投与2 時間前に乳汁を、投与6 時間後に血液と乳汁を採取し、スチリペントール濃度を測定した。スチリペントールの血漿中濃度は投与開始4 日目まで上昇し、その後は一定で10~20μg/mL の範囲内であった。投与終了後、血中及び乳汁中濃度は速やかに減少した。スチリペントールの乳汁中濃度は血漿中濃度と同程度の範囲で推移したことから、スチリペントールは血漿から乳汁中に速やかに移行すると考えられた。
代謝部位及び代謝経路
スチリペントールは、抱合及び酸化反応により広範に代謝され、主に尿中に排泄される。β-グルクロニダーゼ処理後のヒト尿から13種類(未変化体を含む)の代謝物が得られた。ヒトにおけるスチリペントールの主要な代謝経路は複素環の開環であり、代謝物は以下に示す5つの代謝過程から生じ
るものと考えられた。
・メチレンジオキシ環の開環
・グルクロン酸による抱合(Glucuronide)
・カテコール代謝物のO-メチル化
・ t-ブチル基の水酸化
・アリルアルコール側鎖の異性体-3-ペンタノン構造への変換
排泄率(外国人データ)
外国人健康成人男女にスチリペントール600 mg を単回経口投与又は1200 mg を7 日間反復経口投与後、尿中にそれぞれ投与量の73%及び98%に相当する13 種類の代謝物(未変化体を含む)が排泄された(各1 名)。そのうち、未変化体の排泄が最も多く(22%及び30%)、カテコール誘導体及びそのO-メチルエーテルの異性体(代謝物Ⅱ、Ⅲ及びⅣ)も多く排泄された(これらの合計は28%及び38%)。
スチリペントール1200 mg を単回経口投与後の糞中には、未変化体及び微量の2 つの代謝物Ⅲ及びⅣが検出された。8 日間の被験者(3 名)の糞中累積排泄率(経口投与量に対する割合(%))は、投与量の13~24%が未変化体として排出され、大部分が第4 日までに排泄された。
薬剤の慎重投与用
1) 肝機能障害、腎機能障害を有する患者を対象とした国内外の臨床試験は実施されていないので、慎重に投与すること。このような患者では、本剤のクリアランスが低下している可能性があり、本剤及び本剤の代謝物の血中濃度が上昇すると考えられ、肝機能障害、腎機能障害を悪化させるおそれがある。肝機能障害、腎機能障害のある患者に投与する場合には、低用量から開始し、本剤及び併用抗てんかん薬の血中濃度測定を行い、慎重に観察しながら徐々に増量すること。
2) 国内第Ⅲ相試験及び長期投与試験において、血液障害のある患者への投与経験はないので、慎重に投与すること。血液障害を悪化させるおそれがある。
3) 呼吸器疾患を有する患者への投与経験が少ないので、必要に応じて、呼吸器検査を行うなど慎重に投与すること。呼吸機能が抑制されるおそれがある。
4) 心臓への影響を検討するための臨床試験であるThorough QT 試験が国内外で実施されていないので、QT 延長のある患者又はQT 延長を起こすことが知られている薬剤を投与中の患者には慎重に投与すること。QT 間隔を過度に延長させるおそれがある。本剤投与前及び投与中は、定期的に心電図検査を行うなど、患者の状態を慎重に観察すること。
5) 国内第Ⅲ相臨床試験及び長期投与試験において、乳児(1 歳未満)への投与経験はない。海外での投与経験も限られている。乳児(1 歳未満)での有効性及び安全性は確立していないので、慎重に投与すること。
使用上の基本的注意
1) 国内第Ⅲ相試験及び長期投与試験において、重篤な血液障害(好中球減少症、血小板減少症等)及び重篤な肝機能障害の副作用報告はないが、好中球減少2 例、血小板減少2 例、AST(GOT)上昇4 例、γ-GTP 上昇9 例、Al-P 上昇2 例、アンモニア増加1 例の副作用が報告された。本剤投与前及び投与中は、定期的に血液検査、肝機能検査を実施すること。また、血液障害、肝機能障害のある患者では、検査をより頻回に実施するなど、注意深く観察すること。
2) 国内第Ⅲ相試験及び長期投与試験において、重篤な腎機能障害の副作用報告はないが、排尿困難の副作用が1 例報告された。また、非臨床試験(サル)でヒト全身曝露量(AUC)の3.0~6.6 倍に相当する投与量で腎障害による死亡例が認められた。腎機能障害があらわれるおそれがあるので、本剤投与前及び投与中は、定期的に腎機能検査を実施すること。また、腎機能障害のある患者では、検査をより頻回に実施するなど、注意深く観察すること。
3) 心臓への影響を検討するための臨床試験であるThorough QT 試験が国内外で実施されていないことから、本剤投与前及び投与中は、定期的に心電図検査を行うなど、患者の状態を慎重に観察すること。
4) 食欲減退が高頻度に発現する。国内第Ⅲ相試験及び長期投与試験において、安全性解析対象例24例中、食欲減退16 例(66.7%)の副作用が報告された。食欲減退の副作用は投与初期から発現が認められた。食欲減退が続き低栄養状態となった事例、低栄養状態に伴う気管支炎・肺炎の事例も報告された。食欲減退が続いて食事がとれないなどの状態が続く場合には、早めに医師に相談するように指導すること。
5) 国内第Ⅲ相試験及び長期投与試験において、体重減少の副作用が3 例報告された。食欲減退が継続し、体重減少を来すことがあるので、本剤投与中は定期的に体重計測を実施するなど、患者の状態を慎重に観察すること。
6) 国内第Ⅲ相試験及び長期投与試験において、安全性解析対象例24 例中、傾眠19 例(79.2%)、運動失調(ふらつき)14 例(58.3%)、筋緊張低下2 例(8.3%)の副作用が報告された。これらの副作用は投与初期から発現が認められた。ふらつきによる転倒、ふらつきによりストーブに手をついて熱傷を起こした事例も報告された。傾眠や運動失調(ふらつき)が継続する場合は、併用抗てんかん薬を減量するなどの処置が必要となる。傾眠や運動失調(ふらつき)があらわれ、日
常生活に影響が見られる場合には、早めに相談するように指導すること。
7) 連用中の抗てんかん薬を減量又は中止する場合は、離脱症状等に注意して患者の状態を観察しながら慎重に行うこと。なお、国内第Ⅲ相試験及び長期投与試験では、1 箇月から4 箇月かけて徐々に本剤を減量し、中止した。
相互作用
本剤の有効成分であるスチリペントールのヒト代謝に関与する主な肝代謝酵素チトクロームP450 分子種はCYP1A2、CYP2C19、CYP3A4 と考えられる。また、スチリペントールはin vitro において、いくつかのCYP 分子種(CYP2C9、CYP2C19、CYP2D6、CYP3A4)を阻害することが明らかにされている。健康成人に対するスチリペントールの反復投与(平均投与量44 mg/kg/日)後に、CYP1A2 及びCYP3A4の有意な阻害が認められた。
併用注意とその理由

副作用
概要:国内第Ⅲ相試験及び長期投与試験において、初めて本剤が投与された患者の安全性解析対象例24 例中、副作用が22 例(91.7%)に認められた。主な副作用は傾眠19 例(79.2%)、食欲減退16 例(66.7%)、運動失調14 例(58.3%)、γ-GTP 増加9 例(37.5%)、振戦6 例(25.0%)であった。
重大な副作用
国内第Ⅲ相試験及び長期投与試験において、安全性解析対象例24 例中、副作用として、好中球減少2 例(8.3%)、血小板減少2 例(8.3%)が報告された。海外では好中球減少症が報告されており、欧州で販売されているDIACOMIT®のSummary of Product Characteristics(SmPC)で注意喚起されている。血液障害のある患者では、検査をより頻回に実施するなど、注意深く観察すること。また、併用薬を減量する場合は、患者の状態をみながら、原因と考えられた薬剤について、可能な限り1 週間以上の間をあけ、ゆっくりとした減量を検討すること。
その他の副作用
国内第Ⅲ相試験及び長期投与試験において、認められた副作用(臨床検査値異常を含む)を頻度別に記載した。また、国内第Ⅲ相試験及び長期投与試験では認められなかったものの、海外において報告され、特に注意喚起が必要と考えられる副作用を頻度不明の欄に記載した。傾眠、運動失調(ふらつき)、食欲減退の多くは投与初期に発現するため、本剤投与開始時、増量時には、血中濃度推移等を確認し、原因と考えられる併用抗てんかん薬の減量を考慮すること。