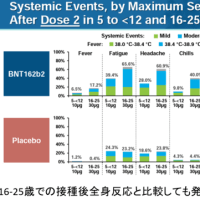
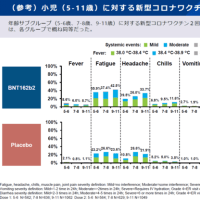
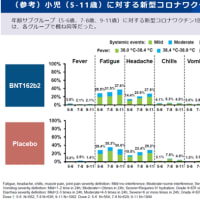
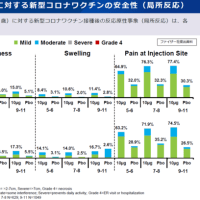
安全性や有効性に問題はないだろうとの判断がされていますが、ドラベ症候群のキードラッグである、昨日からデパケンR錠の自主回収が行われているようなので、情報を共有します。
医薬品回収の概要 クラスII (PMDA) クラスIIとは、その製品の使用等が、一時的な若しくは医学的に治癒可能な健康被害の原因となる可能性がある状況又はその製品の使用等による重篤な健康被害のおそれはまず考えられない状況をいう。
協和キリン デパケンR錠100mgのPTP包装 8000万錠自主回収 溶出規格外で
協和キリンは7月8日、てんかんなどに用いるデパケンR錠100mg(一般名:バルプロ酸ナトリウム徐放錠)のPTP包装品について約8000万錠を自主回収すると発表した。3年の使用期限内に溶出規格外になるおそれがあるため。同社は、仮に規格外の製品の場合「4時間経過時の有効成分の体内への吸収が早まる可能性が考えられるが、12時間経過時の溶出性および含量は規格内であることから、有効性または安全性への影響は極めて低い」としている。現時点で健康被害の報告はないという。回収分類はクラスII。
同社によると、出荷しない試験製造品において4時間後の溶出性が規格(15~45%)の上限値を超えたことを確認。現在流通している製品についても「使用期限内に規格外になる可能性が完全に否定できない」として自主回収に踏み切った。回収対象は2017年4月20日出荷(使用期限19年12月)をはじめとし、最後の出荷は19年2月12日(使用期限21年10月)で、100錠と1000錠のPTP包装。錠数にして約8000万錠という。
-
一般的名称及び販売名
一般的名称: 販売名 : デパケンR錠100mg
-
対象ロット、数量及び出荷時期
包装形態 製造番号 使用期限 出荷数量 出荷時期 100錠PTP 817AFL 2019/12 11,889箱 2017/4/20 100錠PTP 821AFL 2019/12 17,275箱 2017/5/10 100錠PTP 822AFL 2019/12 12,712箱 2017/7/4 100錠PTP 822CFL 2019/12 4,367箱 2017/7/18 1000錠PTP 823AGA 2020/1 1,662箱 2017/7/5 100錠PTP 825AGA 2020/1 17,294箱 2017/7/4 1000錠PTP 826AGC 2020/3 1,736箱 2017/7/18 1000錠PTP 827AGC 2020/3 1,807箱 2017/7/18 100錠PTP 829AGC 2020/3 17,950箱 2017/7/21 100錠PTP 830AGD 2020/4 17,724箱 2017/8/1 100錠PTP 831AGD 2020/4 18,055箱 2017/9/1 100錠PTP 832AGE 2020/5 17,759箱 2017/9/19 100錠PTP 835AGF 2020/6 17,962箱 2017/10/6 1000錠PTP 836AGF 2020/6 1,847箱 2017/10/12 100錠PTP 839AGG 2020/7 18,585箱 2017/10/27 1000錠PTP 838AGG 2020/7 1,738箱 2017/11/7 100錠PTP 840AGG 2020/7 18,782箱 2017/11/17 100錠PTP 841AGG 2020/7 18,649箱 2017/11/17 100錠PTP 842AGG 2020/7 18,571箱 2017/11/17 100錠PTP 843AGH 2020/8 18,228箱 2017/12/6 1000錠PTP 845AGH 2020/8 1,802箱 2018/1/22 100錠PTP 847AGI 2020/9 17,203箱 2018/1/26 100錠PTP 848AGI 2020/9 18,488箱 2018/2/8 1000錠PTP 854AGL 2020/12 1,781箱 2018/4/9 100錠PTP 853AGL 2020/12 18,055箱 2018/4/18 100錠PTP 855AHA 2021/1 17,713箱 2018/5/15 100錠PTP 856AHA 2021/1 17,854箱 2018/5/15 100錠PTP 857AHA 2021/1 17,910箱 2018/5/15 100錠PTP 858AHB 2021/2 18,298箱 2018/6/12 100錠PTP 859AHB 2021/2 18,422箱 2018/6/12 1000錠PTP 861AHB 2021/2 1,781箱 2018/6/12 100錠PTP 864AHC 2021/3 17,949箱 2018/7/10 1000錠PTP 866AHC 2021/3 1,864箱 2018/8/10 1000錠PTP 868AHC 2021/3 1,852箱 2018/8/10 100錠PTP 869AHC 2021/3 18,645箱 2018/8/22 100錠PTP 870AHD 2021/4 18,143箱 2018/8/22 100錠PTP 871AHD 2021/4 18,297箱 2018/9/14 100錠PTP 872AHD 2021/4 18,785箱 2018/9/14 1000錠PTP 873AHD 2021/4 1,874箱 2018/9/26 100錠PTP 876AHH 2021/8 17,895箱 2018/11/27 100錠PTP 878AHH 2021/8 18,517箱 2018/11/27 100錠PTP 879AHH 2021/8 18,578箱 2018/12/3 100錠PTP 880AHI 2021/9 18,375箱 2018/12/11 100錠PTP 881AHI 2021/9 17,894箱 2018/12/18 100錠PTP 883AHI 2021/9 9,000箱 2019/1/4 1000錠PTP 883BHI 2021/9 957箱 2019/1/4 100錠PTP 884AHI 2021/9 18,300箱 2019/1/17 100錠PTP 885AHI 2021/9 18,518箱 2019/1/23 1000錠PTP 888AHJ 2021/10 1,832箱 2019/2/12
-
製造販売業者等名称
製造販売業者の名称 : 協和キリン株式会社 製造販売業者の所在地: 東京都千代田区大手町一丁目9番2号 許可の種類 : 第一種医薬品製造販売業 許可番号 : 13A1X00089
-
回収理由
デパケンR錠100mgPTP包装品において、使用期限である36ヶ月以内に溶出性が規格(4時間後:15~45%)の上限 値を超え、不適合となる製品が認められました。規格外になった製品は出荷しておらず、現在、市場に流通して いる製品に規格外になった製造番号品はありませんが、使用期限内に規格外となる可能性が完全に否定できない ことから、早期に回収を行わせていただくことにしました。 なお、溶出性が規格外となった製品はデパケンR錠100mgPTP包装品であり、デパケンR錠100mgバラ包装品、 デパケンR錠200mgPTP包装品及びバラ包装品では認められておりませんので、自主回収の対象とはいたしません。
-
危惧される具体的な健康被害
溶出性が規格外となった製品は出荷していないため健康被害の可能性はないと考えております。仮に、規格外の 製造品が製品として出荷された場合、4時間経過時の有効成分の体内への吸収が早まる可能性が考えられますが、 12時間経過時の溶出性および含量は規格内であることから、有効性または安全性への影響は極めて低く、それに 伴う重篤な健康被害が発生するおそれはまずないと考えております。 なお、これまでに本件に起因すると考えられる健康被害の報告はございません。
-
回収開始年月日
令和元年7月8日
-
効能・効果又は用途等
1)各種てんかん(小発作・焦点発作・精神運動発作ならびに混合発作)およびてんかんに伴う性格行動障害( 不機嫌・易怒性等)の治療 2)躁病および躁うつ病の躁状態の治療 3)片頭痛発作の発症抑制
-
その他
納入先施設はすべて把握しております。納入先に文書で情報提供のうえ、適切に自主回収を実施いたします。
-
担当者及び連絡先
担当者 : 協和キリン株式会社 連絡先 : 品質保証部 電話番号: 0120-157-189