以前、Buccolam(ブコラム)と薬剤承認の仕組みについての記事紹介した、厚生労働省の未承認薬・適応外薬の承認要望の制度ですが、2015年7月1日から新たに「未承認薬迅速実用化スキーム対象品目」という項目が追加されています。
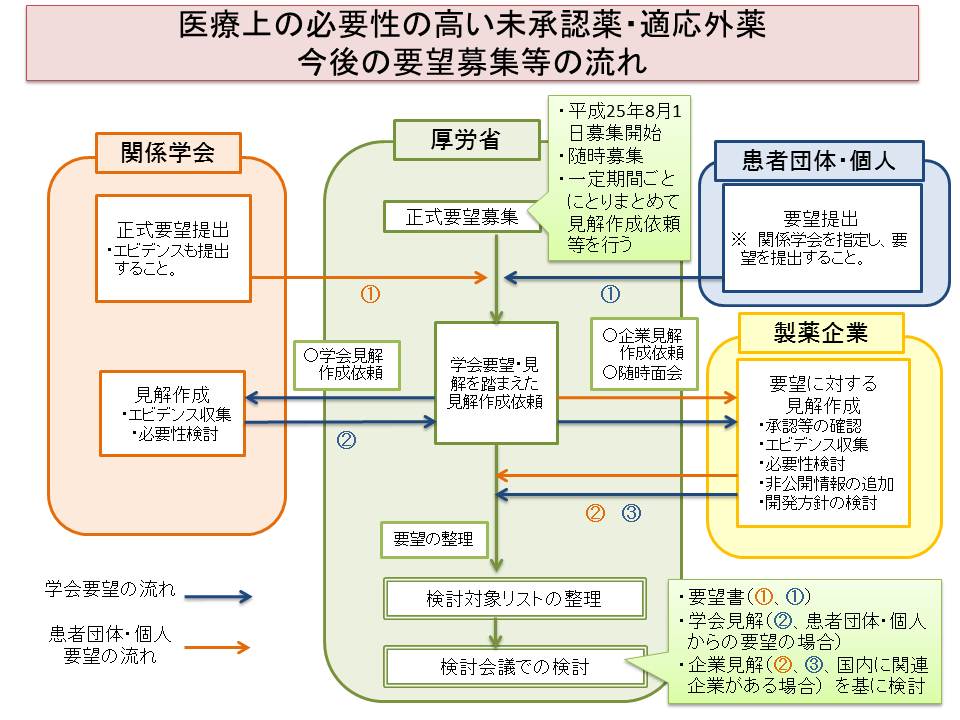
医療上の必要性の高い未承認薬・適応外薬の今後の要望募集について(平成27年7月1日更新)
これまで必要性が高い医薬品であることを満たす条件として、欧米で承認されていることが条件でしたが、一定の条件を満たせば欧米で承認されていない医薬品でも、重篤・致死的疾患治療薬を迅速に実用化するための方法が追加されました。
また下の図では、厚労省が医療上の必要性を認めて開発企業を公募しても、国内の製造販売会社が同様の製剤の開発に着手してもらえない(国内開発企業とのマッチングに時間を要する)場合に、医師主導治験や先進医療を実施して、そのデータを製造販売会社が医薬品の承認申請に活用したり、審査機構(PMDA)に相談ができることで、必要性の高い医薬品の開発(製造販売承認)を後押しする方法が明示されています。
鼻腔投与用ミダゾラムであるブコラムについては、欧州(EMA)での承認が既にあるため、必要性を検討してもらう点では特に問題はないですが、製造販売会社であるShireが日本にないため、検討会議で医療上の必要性が高いと認められた場合でも、厚生労働省がが直接開発を要請する企業がないことが問題となると考えられます。
ブコラムの開発要望の署名も今年の6月末時点で全国の8万人以上の方から集まっているようですし、行政、医療機関、審査機構、企業がうまく連携しながら迅速実用化を実現して欲しいものです。
署名活動については、DravetSyndromeJPのホームページに詳しく記載されています。
ホームページには6月15日以降、締め切りは随時お知らせと記載されていますが、2015年末まで活動が続けられるようです。