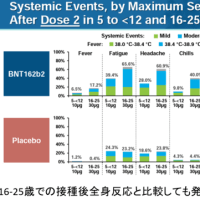
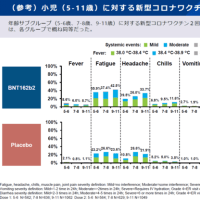
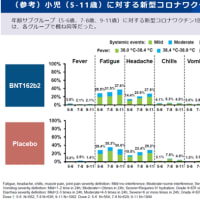
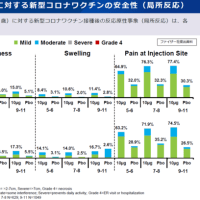
(暫定版であることに注意):作業の時間が取れる時に、適宜情報を更新します、ご意見や追記すべき情報等あればコメント等でご連絡ください。
米国で2018年7月27日に、ドラベ症候群及びレノックス・がストー症候群に対して承認された、大麻の成分であるカンナビジオール(商品名:エピディオレックス)のレビュー
米国の承認状況
Drug Approval Package: Epidiolex (Cannabidiol)
成分名:カンナビジオール
製品名:エピディオレックス
製造販売会社:GWファーマシューティカルズ
効能・効果:2歳以上のレノックス・ガストー症候群またはドラベ症候群の患者における痙攣発作の軽減
用法・用量:
肝機能障害のリスクがあるため、治療開始前に全患者において血清トランスアミナーゼ(ALTおよびAST)および総ビリルビン値を評価する
経口摂取にて投与する。
開始用量は2.5mg / kg の1日2回(5mg / kg /日)。投与開始の1週間後以降に、維持用量として1回5mg / kg、1日2回(10mg / kg /日)まで増量することができる。
1回5mg / kg、1日2回(10mg / kg /日)の用量に耐性を認め、発作の更なる軽減を要する患者は、1週間に1回2.5mg/kg、1日2回(10mg/kg/日)までの増量速度で、最大推奨維持量1回10mg/kg、1日2回(20mg/kg/日)までの範囲において、増量による発作軽減の利益があるかもしれない(20mg / kg /日の維持投与量は、推奨される維持投与量10mg / kg /日よりも発作頻度を幾分か減少させるが、有害事象の増加を伴う)。
投与方法:
摂取する食物はエピディオレックスの血中濃度に影響を与える可能性がある
薬剤の軽量には提供されたメモリ付きのシリンジ(5 mLまたは1 mL経口シリンジのいずれか)を用いて、正確に規定用量を測定して使用することが推奨される(家庭用さじ等は、適切な測定用具ではない)。
開封してから12週間後に残っている未使用の薬剤はすべて廃棄する
投与中止:
エピディオレックスを中止する場合は、徐々に減量する必要がある。全ての抗てんかん薬と同様に、発作頻度の増加およびてんかん重積状態のリスクを最小限に抑えるため、可能であれば突然の中止は避けるべき。
肝機能障害がある場合:
中等度以上の肝機能障害がある場合(Child-Pugh B~C)、投与量を減量し、肝障害がない患者と比較してより慎重な薬剤の調整を行う。肝機能障害が軽度(Child-Pugh A)の場合、用量調整は不要。

容量・性状:
経口用液の含量は100mg/mL、ボトルに無色〜淡黄色の透明な溶液100mLが含まれる。
希少疾病用医薬品の該当性(推定対象患者数、推定方法についても記載する。)
約6,000人以上
<推定方法>
難病情報センターによるとドラベ症候群の患者数は約3,000人、レノックス・ガストー症候群の患者数は、10万人あたり20-30人程度とされている。総務省統計局によると2017年10月時点での15歳未満の推計人口は約1559万人であることから、小児におけるレノックス・ガストー症候群の患者数は3118~4677人と推計される。
欧米等6か国での承認状況
米国:米国で2018年7月27日に承認、販売名(企業名)、効能・効果、用法・容量は上記
カナダ:治療薬として開発中(未承認薬)
欧州(EU):ドラベ症候群やレノックス・がストー症候群等に対して、オーファンドラッグとして流通(未承認薬)
オーストラリア:州により取り扱いは異なるが、国全体での承認なし(未承認薬)。成分、使用目的により輸入は許可される。
欧米等6か国での標準的使用状況
(欧米等6か国で要望内容に関する承認がない適応外薬についてのみ、該当国にチェックし、該当国の標準的使用内容を記載する。)
→ 米国は承認されているので記載の対象外、英国では治験のような形で使用を認めているので、標準的なガイドラインでの記載なし
要望内容に係る国内外の公表文献・成書等について
(1) 無作為化比較試験、薬物動態試験等に係る公表文献としての報告状況
PubMedによる検索でCannabidiol Lennox-Gastaut Syndromeで該当するRCT: 1, 2
PubMedによる検索でCannnadibiol Dravet Syndromeで該当するRCT: 3, 4
-
重度の発達型てんかん性脳症であるレノックス - ガストー症候群の患者における失立発作の抑制効果について、従来の抗てんかん薬のレジメンにカンナビジオールを追加した有効性および安全性の調査を30施設で二重盲検プラセボ対照試験を実施。レノックス - ガストー症候群(年齢範囲、2〜55歳)をベースライン期間として28日間で週に2回以上失立発作を起こした患者を、20mg/kgのカンナビジオール、10mg / kgのカンナビジオール、またはプラセボの3群に無作為に割り付けした。カンナビジオールまたはプラセボ薬は1日2回等分して、14週間投与された。主要転帰は、治療期間中の失立発作の頻度(28日あたりの平均)におけるベースラインからの変化率とした。結果、合計225人の患者が登録され、76名の患者が20mgのカンナビジオール群に、73名が10mgのカンナビジオール群に、76名がプラセボ群に割り当てられた。 28日間のベースライン期間中、失立発作頻度の中央値は全ての試行群を合わせて85であった。治療期間中の落下発作頻度のベースラインからの平均減少率は、カンナビジオール20mg群で41.9%、カンナビジオール10mg群で37.2%、プラセボ群で17.2%であり、カンナビジオール群対プラセボ群と10mgカンナビジオール群対プラセボ群で統計学的有意差を認めた(それぞれP = 0.005、0.002)。カンナビジオール群における患者の最も一般的な有害事象は、傾眠、食欲の低下、および下痢であった。これらの事象は高用量群でより頻繁に発生した。 20mgカンナビジオール群の6人の患者および10 mgカンナビジオール群の1人の患者は、有害事象のために治験薬を中止した。またカンナビジオールを投与された14人(9%)の患者は、肝臓のアミノトランスフェラーゼ濃度の上昇を認めた。治験はGWファーマシューティカル株式会社により実施された。(Devinsky O, et al. N Engl J Med. 2018: Effect of Cannabidiol on Drop Seizures in the Lennox-Gastaut Syndrome.)
-
難治性で治療に抵抗性であるレノックス - ガストー症候群の患者に対して、既存の治療にカンナビジオールを追加することによる有効性および安全性を評価するため、米国、オランダ、ポーランドの24箇所の医療機関で無作為化二重盲検プラセボ対照試験を実施。2〜55歳で脳波における遅い(<3Hz)spike and wave patternの記録、少なくとも6カ月間で2種類以上の全身けいれん発作の記録、 4週間のベースライン期間中に週に少なくとも2回以上の失立発作を起こし、少なくとも2種類以上の抗てんかん薬により治療効果を認めない、レノックス・がストー症候群患者を対象とした。患者は、20mg / kgのカンナビジオールまたはプラセボ薬の2群に無作為に割り付けられ(1:1)、14週間に内服を行った。データを評価している全ての患者、介護者、研究者等は、割り付け群の情報をマスクされた。主要評価項目は、治療期間中の失立発作の月間頻度におけるベースラインからの変化率でとし、少なくとも1回の試験薬物投与を受け、ベースライン後の有効性データを有する全ての患者において分析を実施した。結果、2015年4月28日から2015年10月15日まで、171人の患者にカンナビジオール(n = 86)またはプラセボ(n = 85)を無作為に割り付けられた。ベースラインからの1か月間の失立発作頻度の中央値の減少率は、カンジビジオール群で43.9%(IQR -69.6 -1.9)であり、プラセボ群で21.8%(IQR -45.7-1.7)であった。14週間の治療期間中、治療群間の推定平均差は-17.21(95%CI -30.32〜-4.09; p = 0・0135)であった。有害事象は、カンナビジオール群の86人の患者の74人(86%)およびプラセボグループの85人の患者の59人(69%)に発生したが、ほとんどが軽度または中等度であった。最も一般的な有害事象は、下痢、傾眠、発熱、食欲の低下、および嘔吐であった。カンナビジオール群の患者12名(14%)およびプラセボ群の患者1名(1%)は、有害事象のために研究を中止した。 1人の患者(1%)がカンナビジオール群で死亡したが、これは治療とは無関係と考えられた。治験はGWファーマシューティカル株式会社により実施された。(Thiele EA, et al. Lancet. 2018: Cannabidiol in patients with seizures associated with Lennox-Gastaut syndrome (GWPCARE4): a randomised, double-blind, placebo-controlled phase 3 trial.)
-
二重盲検プラセボ対照試験で、ドラベ症候群で薬剤抵抗性てんかんが認められる小児と若年成人120例を、標準的なてんかん治療にカンナビジオール経口液 20mg/kg/日を追加する群と、プラセボを追加する群に無作為に割り付けた。主要エンドポイントは、14週間の投与期間とベースラインの 4週間とで比較した痙攣性てんかん発作の頻度の変化とした。結果、1月あたりの痙攣性てんかん発作の頻度の中央値は,カンナビジオール群では 12.4 から 5.9に低下したのに対し,プラセボ群では 14.9 から14.1に低下した(中央値の補正後の差 -22.8%,95%CI -41.1~-5.4,P=0.01)。痙攣性てんかん発作の頻度が 50%以上低下した患者の割合は、カンナビジオール群 43%、プラセボ群 27%であった(OR 2.00,95%CI 0.93~4.30,P=0.08)。全身状態が、7 段階の介護者による全般的印象改善度(CGIC)で 1 段階以上改善した患者の割合は、カンナビジオール群では 62%であったのに対し、プラセボ群では 34%であった(P=0.02)。カンナビジオール群では,全てんかん発作の頻度が有意に低下したが(P=0.03)、非痙攣性てんかん発作の頻度は有意には低下しなかった。発作が抑制されていた患者の割合は,カンナビジオール群 5%,プラセボ群 0%であった(P=0.08)。カンナビジオール群でプラセボ群よりも頻度が高かった有害事象は、下痢、嘔吐、疲労、発熱、傾眠、肝機能検査異常などであった。試験中止例はカンナビジオール群のほうが多かった。
結論として、ドラベ症候群患者において、カンナビジオールは、プラセボと比較して痙攣性てんかん発作の頻度を大幅に低下させ、有害事象の発現率が高いことに関連した。(GW Pharmaceuticals 社から研究助成を受けた)(Devinsky O, et al. N Engl J Med. 2017: Trial of Cannabidiol for Drug-Resistant Seizures in the Dravet Syndrome) -
全米11か所にてんかんセンターの拡大アクセスプログラムに登録された、重症、難治性、小児期発症、治療抵抗性のてんかんを有する患者(1〜30歳)を対象とした非盲検試験。患者に1日あたり2〜5 mg / kgの経口カンナビジオールを投与し、最大投与量25 mg / kgまたは50 mg / kg /日まで増量。主要転帰は安全性の評価と12週間での運動発作の1月あたりの頻度減少率。有効性は修正ITT解析で評価され、運動発作の頻度の変化率の比較は、Mann-Whitney U検定で行った。2014年1月15日から2015年1月15日までの間に、214人の患者が登録され、162人(76%)が12週間の安全性評価のための経過観察期間を終了し、137人(64%)が有効性分析結果を得た。安全性評価の対象者のうち、33人(20%)の患者がドラベ症候群であり、31人(19%)の患者がLennox-Gastaut症候群であった。128人(79%)に有害事象が報告された。 10%以上の患者に報告された有害事象は、傾眠(n = 41 [25%])、食欲減退(n = 31 [19%])、下痢(n = 31 [19%])、疲労(n = 21) [13%]、および痙攣(n = 18 [11%])であった。 5人(3%)の患者が有害事象のために治療を中止した。重篤な有害事象が48人(30%)の患者に報告され、1人の死亡(治験薬とは無関係のてんかんによる突然の予期せぬ死亡)があった。 20人(12%)の患者がカンナジビオールと関連すると考えられる重篤な有害事象を認め、最も頻度が高い症状はけいれん重積9人(6%)であった。運動発作の月平均頻度は、ベースラインで30±0(IQR 11・0〜96・0)、12週間の治療期間で15・8(5・6〜57・6)であり、毎月の運動発作の減少の中央値は36・5%であった(IQR 0-64・7)。カンナビジオールが、治療抵抗性の高いてんかんのある小児および若年成人の健康問題を軽減できることが示唆された。(Devinsky O, et al. Lancet Neurol. 2016: Cannabidiol in patients with treatment-resistant epilepsy: an open-label interventional trial.)
- マリファナの植物には数百もの化合物があり、抗てんかん薬や向精神作用が診療に応用されている。カンナビジオール(CBD)は、Δ9 -テトラヒドロカンナビノールの精神活性作用を有する。CBDはカンナビノイド受容体を介して作用せず、その抗てんかん作用機序は不明であるが、小児のてんかん治療に用いられることがある。CBDの使用実績は昨年まで十分ではなかったが、ドラベ症候群およびレノックス-ガストー症候群における、3つの無作為化プラセボ対照二重盲検試験が報告されている。それらによると、プラセボ群で全けいれん発作の減少中央値が13%から19%であったのに対して、CBD使用群では38%から41%の減少率を認めた。同様に、50%以上の痙攣または店頭発作の減少を有効とした際、プラセボ群での有効率14%〜27%と比較して、CBD使用群で39%〜46%の有効率が報告されている。 CBDの忍容性は良好であったが、鎮静、下痢、食欲減退が頻繁に認められた。CBDは他の確立した抗てんかん薬と同等の有効性を示し、ベンゾジアゼピンの慎重な漸減が、CBDによる補助的な治療で鎮静の副作用を最小限に抑えるために重要となる。(Ali S, et al. Dev Med Child Neurol. 2019: Efficacy of cannabinoids in paediatric epilepsy.)
- カンナビジオール(CBD)の抗てんかん発作作用の特性は、カンナビノイド受容体に対する直接作用に関係しないが、イオンチャネルに対するアゴニスト及びアンタゴニスト効果、神経伝達物質輸送体及び複数の膜貫通受容体を含む多数のメカニズムによって媒介される。テトラヒドロカンナビノールとは対照的に、CBDは精神活性を欠き、陶酔性または衝動性の副作用を生じさせず、乱用使用の原因とならないとされる。メタ・アナリシスの技法を用いて、てんかん患者の補助治療としてのCBDの有効性と安全性を評価。コントロール不良のてんかん患者における、経口CBDの無作為化プラセボ対照、一重盲検または二重盲検追加試験が確認された。4件の試験において、Lennox-Gastaut症候群(LGS)とDravet症候群(DS)の患者550人が含まれた。治療期間中の発作頻度の変化に関する平均差は、CBD10mg/kg vs プラセボ群との比較で、19.5% (95%信頼区間8.1-31.0; p=0.001)、CBD20mg/kg vs プラセボ群との比較で19.9% (95%信頼区間11.8-28.1; p<0.001)の減少を認めた。全ての発作の頻度について、50%以上の減少は、CBD 20 mg/kg群で37.2%、プラセボ治療を受けた参加者の21.2%に認めた(リスク比1.76、95%CI 1.07-2.88; p=0.025)。試験期間中の、全ての原因を含む薬剤使用中止例は、CBD群で11.1%、プラセボ群で2.6%に生じた(リスク比3.54、95%CI 1.55-8.12; p = 0.003)。治療中止のプラセボ群と比較したリスク比はCBD10mg/kg群で1.45(95%CI 0.28-7.41; p = 0.657)、20mg/kg群で4.20(95%CI 1.82-9.68; p = 0.001)であった。有害事象による中止率は治療群で8.9%、プラセボ群で1.8%(リスク比5.59、95%CI 1.87-16.73; p = 0.002)であった。副作用による治療中止のプラセボ群と比較したリスク比は10mg/kg使用群で6.89(95%CI 2.28-20.80; p = 0.001)であった。何らかの有害事象は、CBD治療群で87.9%、プラセボ治療群で72.2%に発生した(RR 1.22、95%CI 1.11〜1.33、p <0.001)。 CBDと有意に関連する有害事象は傾眠、食欲減退、下痢、および血清アミノトランスフェラーゼの増加であった。多剤併用療法で症状がコントロールできないLGSまたはDSの患者における補助的なCBD治療は、プラセボと比較して、発作頻度の大幅な減少及び有害事象の発生率増加と関連した。(Lattanzi S, Drugs. 2018: Efficacy and Safety of Cannabidiol in Epilepsy: A Systematic Review and Meta-Analysis.)
- ドラベ症候群(DS)は、しばしば発熱によって発作が引き起こされる難治性のてんかんである。成長とともに、患者は多岐に渡る種類の発作、知的障害、かがみ歩行、その他の合併症(睡眠障害、自律神経障害)をきたす。現存の治療法で発作を完全にコントロールすることはできないため、治療の目標は発作の減少と副作用のバランスを取ることとなる。また、DS患者の生活の質に多大な影響があることから、併存疾患の治療にも注意を払わなければならない。発作は、一般的にナトリウムチャネル製剤で悪化する。許容される第一選択薬には、クロバザムとバルプロ酸が含まれるが、これらにより十分な発作抑制効果が得られることはほとんどない。トピラマート、レベチラセタム、ケトン食および迷走神経刺激の有益性も認められている。現在開発中の薬剤、特にフェンフルラミン及びカンナビジオールは、臨床試験において有効性を示している。てんかん重積はDS患者、特に幼児期に繰り返し生じる問題である。全てのDS患者は、在宅救助療法(通常はベンゾジアゼピン)を処方されるべきであるが、同時に、在宅救助療法にもかかわらず発作が持続する場合に備えて、地元の医療機関とどのように連携して対応するか計画しておくべきである。(Knupp KG, et al. CNS Drugs. 2018: Treatment Strategies for Dravet Syndrome.)
- 治療抵抗性てんかんの補助治療としてのカンナビノイドのエビデンスを評価するため、2017年10月にMedline、EmbaseおよびPsycINFOの系統的検索を実施。効果判定は、50%以上の発作の減少、完全な発作の消失、生活の質の改善、忍容性/安全性は、試験中止、有害事象(AE)および重篤な有害事象(SAE)によって評価されていた。36の研究報告を特定したところ、6件がランダム化比較試験(RCT)、30件が観察研究であった。参加者の平均年齢は16.1歳(範囲0.5〜55歳)。カンナビジオール(CBD)20 mg / kg /日は、発作頻度を50%以上減少させることにおいてプラセボより効果的であった(相対リスク1.74、95%CI 1.24-2.43、2 RCT、患者数291人、GRADE評価で低いグレードの推奨)。 1人の患者で50%以上発作を減少させるためにCBDを使用して治療を行う必要な人数は8(95%CI 6〜17)であった。完全に発作を焼失させることにおいてもプラセボおり効果的であった(相対リスク6.17、95%CI 1.50-25.32、3 RCT、患者数306人、GRADE評価で低いグレードの推奨)。生活の質を改善することにおいて、CBDはプラセボよりも効果的であったが(相対リスク 1.73、95%CI 1.33-2.26)、有害事象(相対リスク1.24、95%CI 1.13-1.36)及び重篤な有害事象(相対リスク2.55、95%CI 1.48-4.38)も増加した。17件の観察研究の対象となった患者の48.5%(95%CI 39.0%〜58.1%)は発作が50%以上減少したと報告した。14件の観察研究において、8.5%(95%CI 3.8-14.5%)で発作の消失が得られた。12件の観察研究では、55.8%で生活の質の改善が報告されていた(95%CI 40.5〜70.6)。一方で、50.6%(95%CI 31.7〜69.4)で有害事象、2.2%(95%CI 0〜7.9)に重篤な有害事象を認めた。小児期発症の難治性てんかんにおける追加治療としての医薬品CBDは、発作頻度を減らす可能性がある。既存のRCTのエビデンスは、重篤なてんかん症候群の小児サンプル数に限定され、他の疾患やカンナビノイドの研究が必要となる。(Stockings E, et al. J Neurol Neurosurg Psychiatry. 2018: Evidence for cannabis and cannabinoids for epilepsy: a systematic review of controlled and observational evidence.)
- 現在、医薬品市場で入手可能な3つのカンナビノイドがある。 ドロナビノールとナビロンはどちらも、FDAが第一選択薬の治験が失敗した後の化学療法誘発性の悪心および嘔吐(CINV)の治療薬として承認されている合成テトラヒドロカンナビノール(THC)である。 両薬剤ともエイズに関連した食欲不振を治療するためにFDAによって承認されている。 最近、FDAは小児患者におけるレノックス・ガストー症候群およびドラベ症候群に関連するけいれん発作の治療のためカンナビジオール(CBD)製品を承認した。しかし、制吐剤としての使用に関してFDAが承認した適応はない。製造されたカンナビジオール抽出物は、しばしば吐き気や嘔吐を含む、FDAに承認されていない多くの適応症のために一般患者で使用されている。嗜好用と医療用の両方の目的でマリファナを合法化した州では、さまざまな割合でカンナビジオールとTHC製剤も制吐作用を目的に使用されている。(Taylor BN, et al. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2018: Cannaboinoid Antiemetic Therapy.)
→ おそらく、国内での臨床試験成績及び臨床使用実態を医学ジャーナルにpublishした報告はない (?)
<要望効能・効果について>
1) 2歳以上のレノックス・ガストー症候群またはドラベ症候群の患者における痙攣発作の軽減
<要望用法・用量について>
1) 開始用量は2.5mg / kg の1日2回(5mg / kg /日)。投与開始の1週間後以降に、維持用量として1回5mg / kg、1日2回(10mg / kg /日)まで増量することができる。
2) 1回5mg / kg、1日2回(10mg / kg /日)の用量に耐性を認め、発作の更なる軽減を要する患者は、1週間に1回2.5mg/kg、1日2回(10mg/kg/日)までの増量速度で、最大推奨維持量1回10mg/kg、1日2回(20mg/kg/日)までの範囲において、増量による発作軽減の利益があるかもしれない(20mg / kg /日の維持投与量は、推奨される維持投与量10mg / kg /日よりも発作頻度を幾分か減少させるが、有害事象の増加を伴う)。
<臨床的位置づけについて>
1) 複数の抗てんかん薬を併用しても発作のコントロールを得られない場合に本剤による治療を考慮する。
2) 肝機能障害のリスクがあるため、治療開始前に全患者において血清トランスアミナーゼ(ALTおよびAST)および総ビリルビン値を評価する