
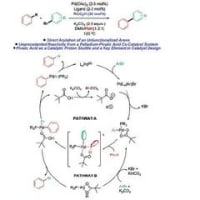
3から鍵段階を書き出してみました。
ベンザインとフランとの[4+2]。ベンザインが環の両側に同時にできるのは、電子密度が高すぎるしストレインもどうかなと思ったので付加はステップワイズに書いてみました。ここで酸素原子が平面の上に出たり下に出たりのミクスチャになります。
OH-が叩いて、ここで架橋している酸素原子が開くのかなと思っていましたが本文を読むと、ここではテザーをきっているだけの様子。最後の段階は両側ともに開環してから酸化よりも、それぞれを開いて酸化、開いて酸化で書かないといきづまりました。なんで置換基のある側に開くのか?はわかりません。置換基のある軌道とC-Hの軌道が、立体電子効果でどうなるか考えたら解決するかもしれません
見づらいとか、まだわかりにくいとかあったら遠慮なくドゾー
ベンザインとフランとの[4+2]。ベンザインが環の両側に同時にできるのは、電子密度が高すぎるしストレインもどうかなと思ったので付加はステップワイズに書いてみました。ここで酸素原子が平面の上に出たり下に出たりのミクスチャになります。
OH-が叩いて、ここで架橋している酸素原子が開くのかなと思っていましたが本文を読むと、ここではテザーをきっているだけの様子。最後の段階は両側ともに開環してから酸化よりも、それぞれを開いて酸化、開いて酸化で書かないといきづまりました。なんで置換基のある側に開くのか?はわかりません。置換基のある軌道とC-Hの軌道が、立体電子効果でどうなるか考えたら解決するかもしれません
見づらいとか、まだわかりにくいとかあったら遠慮なくドゾー










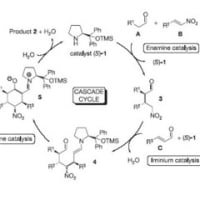

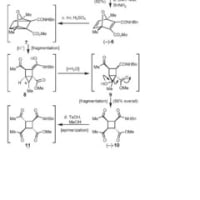
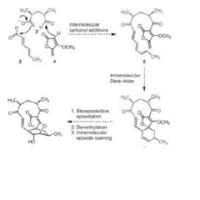

先日fuzi0さんにヒントをもらって考えたところ、Diels-alderでの生成物は、それぞれの酸素が平面より(上、上)、(下、下)、(上、下)、(下、上)の4種類出来て、テザーを切断すると、上や下というのが関係なくなり、このmixtureが1つのモノになっていく、という感じで考えました。実際はいろいろな構造不明物ができていますが^^;
わざわざイラストを載せてくださって本当に感謝しています>< ただ、小さくて・・視力の悪い僕には少々キツイです^^; できたらでよいのですが、もしよろしければサイズを大きくしてもらえないでしょうか?
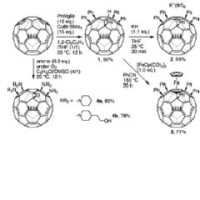
それと、-Si-CH2-CH2-O- の切断の時に、OC2H5とならないのですか?
保護基と見ていたので外すことに目がいってました。そっちで考えた方が良いですね。その後、加水分解と酸化でキノンになると考えた方が、E2で脱保護と考えるより実際の系に近い気がします。
サイズですが・・・何かいい方法ないですかね?ケムドローそのまま使えないので、画像に直してからブログで貼るとエイトマンでもないとみえないぞぉな絵になってしまいます。私のパソに入ってるソフトでいろいろいじったのですがイマイチ。ワードでpdfならもう少しましみたいですが・・・pdf貼れないし。
貼れるところとしてシーサーブログがつながればよいのですが、エアエッジではできませんでした。
何か良い方法があればお願いします^^;
今回の反応機構について自分の意見を述べますね。
1)テザー切断について
OHアニオンがSiを叩く時ですが、Petetrson olefination型でエチレンを副生しつつ、まず最初にフェノキシドアニオンを生じると思います。
橋頭位のカルボアニオンよりもフェノキシドの共役酸のpKa値が低いというのが理由です。
2)酸によるAromatizationについて
私も最初はアニオンの段階で芳香環になると思ったのですが、アニオンのlonepairと環上のオレフィンの軌道が重ならないため、塩基性条件下では芳香環化が進行していないのだと思います。
O原子上にプロトンがたかって、C-O結合が切れるときにカルボカチオンが、橋頭位のどちらかに発生することになりますよね。このとき側鎖が置換基としてある炭素が3級カチオンとなるような共鳴構造が書ける方が生成物になる。と考えられないでしょうか?
Si基は橋頭位に残って、酸処理で取れるってことはないでしょうか?
1)テザー切断について 確かにそうですね。本文(下にコピペ)のbetween the
silicon atoms and the bridgehead carbon atoms に引きずられて、pKa考えてませんでした。というわけでじゅんさんまたまた訂正です^^;
2)酸によるAromatization 軌道で考えるとすっきりしますね。こっちもチャイさんの言うとおり。 歪みが大きいから開いても良い気はするんですよね。TBAFなんかは反応がえらいことになっているみたいですし
3)酸によるAromatizationの選択性
カチオンの安定化で考えるとわかりやすいですね。
ただ、ここはref4a-dを引いた方がはっきりする気がします。個人的にはC-OのシグマスターにC-C,C-Hのシグマからの逆供与なのかな?と思ってますが、遷移状態を考えるか、生成物よりの安定性を考えるかの違いかと。ここの開くところは立体から可逆と考えるのは厳しい気がするのが理由です。
Si酸で外れると考えると、カチオンの安定化効果でもスムーズに説明できそうですね。ただ本文↓では塩基性条件できってる書き方してます。またコメントいただけると助かります♪
we discovered that the bonds between the
silicon atoms and the bridgehead carbon atoms in 2 were most
efficiently cleaved under modified Rickborn12 conditions using
KOH in DMF/H2O (10:1). Treatment of the crude mixture thus
obtained with hydrochloric acid resulted in the regioselective
opening4a-d of the two bicyclooxaheptene rings,
「C-OのシグマスターにC-C,C-Hのシグマからの逆供与」とはどういうことなのでしょうか・・
それと、Si基が酸処理で取れるとすると、それを含めた反応機構が分からなくなります>< 塩基性条件でも、どうやってキノン骨格になるのかも分かりませんが・・^^;力不足です><
あとσスター軌道云々は立体電子効果です。逆供与と言う表現が正しいのかは怪しいです。簡単に言えば、置換基のせいで、C-O結合の強さが非対称になっていると考えてください。アノマー効果やCieplak効果とかを調べてもらえば、立体電子効果はなんとなくわかるかと思います。
あとですね・・ディールスアルダーではendo体ができないのは、立体障害の他になにかあるのでしょうか?
ってのは、論文とは違うのは分かってるんですけど、なんとなく論文のトコほんとかよっ?って思ったので書きました。あれ、中間体単離とかしてないんですよね?本当はどこできれてるとか分からない気がします。
というのもやはりカルボアニオンの発生が納得いかないからです。