分子構造模型 立体化学分子模型 有機化学基本セット1
中古品になりますが欲しい方いらっしゃいませんか?
今はパソコンでモデリングがちょいちょいできますが、それなりに問題解決に役立ちました。短時間で、手を使ってコンフォメーションやAストレインをいじることで位置選択性などを理解できました。
実際に使っていた感想としては、棒球でなくDreidingなので、妙に結合や結合角が動いたりすることなく、立体化学の理解に役立つのではと思います。
欲しい方いらしたらコメントにでもお願いします。
諸事情により有機化学に対するモチベーションが激減しております
年内には切り替えて戻す、と努力中ですが
中古品になりますが欲しい方いらっしゃいませんか?
今はパソコンでモデリングがちょいちょいできますが、それなりに問題解決に役立ちました。短時間で、手を使ってコンフォメーションやAストレインをいじることで位置選択性などを理解できました。
実際に使っていた感想としては、棒球でなくDreidingなので、妙に結合や結合角が動いたりすることなく、立体化学の理解に役立つのではと思います。
欲しい方いらしたらコメントにでもお願いします。
諸事情により有機化学に対するモチベーションが激減しております
年内には切り替えて戻す、と努力中ですが











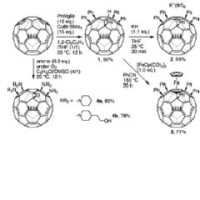
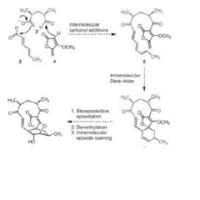

そこで、もしよろしければ10月4日に紹介された論文について、いくつか質問に答えていただけないでしょうか?
台湾からはChem Lettよこせと図々しいコメントもありましたから構わないですよ^o^
開裂の際の中間体と機構あたりですかね?
とりあえず、気になることを全部挙げてみますと・・・
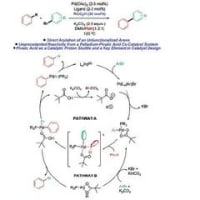
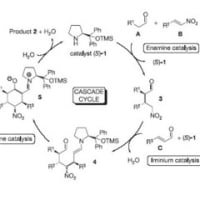
① Scheme1でLDAを用いて選択的にリチオ化をしているとこで、なぜフランの2位がされて、5位がされないのか・・
②この文献で頻出する「ethanolic HCl」とはどういう働きか・・
③ Scheme2でエポキシドにフランを付加させているとこで、なぜルイス酸を用いているのに塩基性条件のエポキシド開環したような生成物ができるのか・・
④NBS,DMFを用いたBr化はラジカル的ではなく、イオン経由なのですか?
⑤Diels-Alder反応の生成物のジアステレオマーというものがどんな構造なのか検討つかないのですが・・
⑥脱ベンジル基の際、ルイス酸付加の後、ベンジルはBrイオンによって攻撃されてBnBrの形で抜けるのですか?
そして、fuzi0さんご指摘の通り、
⑦開裂の際の中間体と機構がさっぱり分かりません・・
たくさんあって申し訳ありません。④や⑦などについてはreferenceを読んでみてもピンときませんでした・・答えられる範囲で結構ですのでどうかよろしくお願いします!
①ピランの酸素原子の関与でしょうか、後付の理由ですが、ちょうど5員環のキレーション構造をとれるかと
②すみません、わかりません。 酸性水溶液ではクエンチで混じりにくく悪さをするので、有機層に混じりやすいエタノールでクエンチしているのかな?と思います。
水溶性の悪い化合物の酸性での脱保護はギ酸やTFAを用いることがあるので、そのような感じかと思います
③エポキシドは絵で書くよりも簡単に開かないのでルイス酸で活性化します。その結果、塩基性条件で開いたものが得られます。質問で立体的に混んでることもあるのかな?と思ったのですが、結構普通の条件の気もします。ちょい見てみたら東京化学同人の「演習有機合成化学」の96の11→12でもより立体的にすいてるものでm進んでいます。
④極性溶媒を用いているからでしょうか。チオフェンの臭素化ではクロホ程度の極性でも進みます。ionicと考えてよいと思います。ヘテロ原子を含む5員環はベンゼンに比べて、電子密度が環上で高いためと考えると、極性反応で考えた方がよい系がたくさんあります。
六、おそらくそうだと思います。メトキシフェノールの脱保護はBBr3をよく用います。Protective groups in organic synthesis という本を見ていただければ・・・。やったことがありますが、クエンチは塩基性でやると汚くなりました。
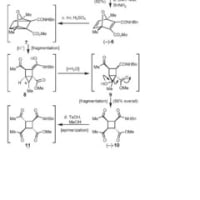
⑦
今予想してるのは、2へヒドロキサイドがSiを叩いて、電荷を解消するために橋頭位にマイナスがのってプロトントラップ。再度Siにヒドロキサイドがattackして脱Me2Si(OH)2
2環性の酸素原子にプロとンがたかって開裂。この選択性は置換基?のせい?これはわかりません。収率の低さはここの開き方によるのかと。あとは芳香環化をドライビングフォースに矢印を書いていけばなんとかなるかと。
わかりにくかったらまたコメントにお願いします。
それは違う。こうだ!という意見がある方は是非コメントにお願いします
月曜化ら
ビール7杯 焼酎3杯 ウイスキーロック3杯をあけて シモネタで満足しながらfのfuzi0
いくつか分からない部分があるので、続けて質問させていただきます。
①のピランの酸素との「5員環」のキレーションというものが見えてきません・・
②の、酸性溶液での悪さとは、具体的にどのようなことなのでしょうか?
④の「電子密度が環上で高いと、極性反応で考えた方がよい」のはなぜですか?
あと、文献を読んだときから疑問なのですが、⑦の「橋頭位」とは、どこのことなのでしょうか?
見ず知らずの僕にここまでご丁寧に答えてくださってありがとうございます!
② 二相系になって基質と酸が反応しにくいとかですかね。ここらは実際にモノ扱ってみないと何が悪いのかわからないです
例えば私の経験では 疎水性の強いモノのアセタール脱保護で、thfー塩酸系では進まなかったことがあります
また、クエンチの際、pHがクリティカルに効いてきたときがあります。酸性でやらなきゃだめとかバッファーでやらなきゃダメとか この場合もそんなものかなと思ってますがわかりません
4,7は後日でお願いします
ラジカルで考えてもいいのかもしれませんが、簡単な反応の類似と考えた方が体系的に理解しやすいと考えています
⑦ スキームかけないのがもどかしいですねー、
Siのあるところで考えています。説明がわかりにくくて厄介ですね&申し訳ない。
週末にやる気があったらお絵かきします。
会社で合成屋だから他のことをやらせようとかで物性評価グループに配属となってしまい、廃人のようになってるんですよ。水曜どうでしょうの大泉洋に匹敵するぼやきが一日中頭を巡っており、書いてる通りモチベーションがあがらないのですねぇ。腐ってもしょうがないと過去1年の報告書や、発表資料をみつつ興味ある問題を見つけよう&新しいことを学べるチャンスと頑張っていますが、自分を偽って無理しているためか帰宅後の疲れの反動がひどい
今の優先順位は、酒>深夜放送>お昼寝>寮のごはん>ビッダーズでオークション>>>有機化学と困った生活をおくっていますのであまり期待しないでください