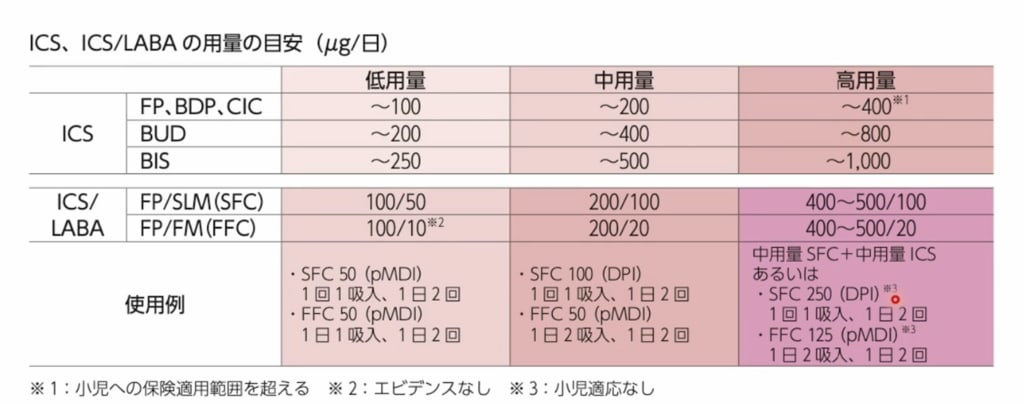
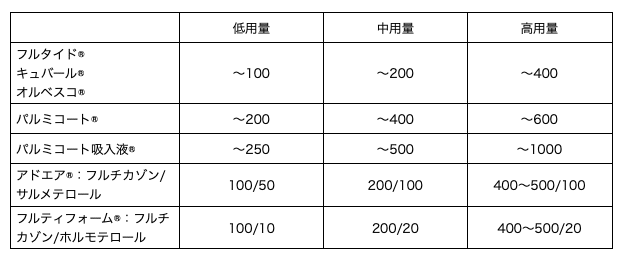
この秋(2024年10月)に「喘息予防・管理ガイドライン2024」が発行されました。
成人喘息を扱った、日本の治療の標準です。
今回初めて「クリニカルクエスチョン」が導入されました。
これは近年のガイドラインに必要とされる形式です。
それを扱った記事を紹介します;
<ポイント>
CQ1.ICSへの追加はLABAとLAMAどちらが有用?
→ ICSへの追加治療としてLABAとLAMAはいずれも同等に推奨される(エビデンスの確実性:B[中])
CQ2.中用量以上のICSでコントロール良好例のステップダウンは?
→ 中用量以上のICSでコントロール良好な場合はICS減量を行うことが提案される(エビデンスの確実性:C[弱])
CQ3.FeNOに基づく管理は有用か?
→ FeNOに基づく管理を行うことが提案される(エビデンスの確実性:B[中])
CQ4.喘息の長期管理薬としてのマクロライドの位置付けは?
→ マクロライド系抗菌薬を長期管理の目的で投与しないことが提案される(エビデンスの確実性:C[弱])
略称が多くて一般の方にはよくわからないと思われますが…
CQ1は、ICS(吸入ステロイド薬)への追加はLABA(長期間作用型β刺激薬)とLAMA(長時間作用型抗コリン薬)のどちらがよいか、という質問です。β刺激薬は狭くなった気管支を広げる作用があり、抗コリン薬は気管支を狭くしないイメージです。
成人領域ではICS+LABA+LAMAの“トリプル吸入剤”が認可されたのでこのCQが取りあげられました。
小児科領域では抗コリン薬はほとんど使用されておらず、β刺激剤中心ですが、LAMAも同等の効果があるとすると、将来臨床応用されてくる可能性がありますね。
CQ2は、十分量の吸入ステロイド薬を長期間投与すると、副作用が発生するという報告が近年相次いだため取りあげられた質問です。
結論として、漫然と投与を続けるのではなく、減量が可能なら必要最低量で維持することが推奨される内容です。ただ「減量が提案される」としつつも、推奨度Cと一歩腰が引けていますね。
私は小児に対して低用量〜中用量で管理し、年1回の呼吸機能検査で病態を評価し、継続・減量を検討しています。中用量+LTRAでもコントロール不良患者は総合病院小児科へ紹介していますが、ごく稀です。
CQ3はFeNO(呼気一酸化窒素濃度)を用いた喘息管理の是非を問う内容です。
喘息患者では症状がないときも気管支の炎症がくすぶっていますが、FeNOはこの気道炎症の程度を反映するとされています。その数値を評価して管理してよいものかどうか・・・回答は「是」。
私は小児喘息患者でFeNO測定が可能になる小学生以上で年1回、FeNOを評価し、治療に反映させています。目安は20以下は良好、35以上は不良とし、臨床症状と合わせて治療薬の継続・増量・減量をしています。
CQ4は昔流行した抗菌薬(=抗生物質)の併用が有用かどうか、再確認する内容です。
マクロライド系抗菌薬は少量でも気道クリアランス効果があるとされ、併用された時代がありました。
しかし真実は、その頃標準治療であったテオフィリン系薬剤の血中濃度を上げる作用があるため、その薬効が強くなったという背景が判明しました。
今回の検討でも有意な効果は証明できず、この治療法は過去のものとなりました。
…以上、自分の日常診療を振り返るよい機会になったCQですね。
▢ 喘息予防・管理ガイドライン改訂、初のCQ策定/日本アレルギー学会
(2024/12/04:ケアネット)より一部抜粋(下線は私が引きました);
2024年10月に『喘息予防・管理ガイドライン2024』(JGL2024)が発刊された。今回の改訂では初めて「Clinical Question(CQ)」が策定された。そこで、第73回日本アレルギー学会学術大会(10月18~20日)において、「JGL2024:Clinical Questionから喘息予防・管理ガイドラインを考える」というシンポジウムが開催された。本シンポジウムでは4つのCQが紹介された。
▶ ICSへの追加はLABAとLAMAどちらが有用?
「CQ3:成人喘息患者の長期管理において吸入ステロイド薬(ICS)のみでコントロール不良時には長時間作用性β2刺激薬(LABA)と長時間作用性抗コリン薬(LAMA)の追加はどちらが有用か?」について、谷村 和哉氏(奈良県立医科大学 呼吸器内科学講座)が解説した。
喘息の治療において、ICSの使用が基本となるが、ICS単剤で良好なコントロールが得られない場合も少なくない。JGL2024の治療ステップ2では、LABA、LAMA、ロイコトリエン受容体拮抗薬、テオフィリン徐放製剤のいずれか1剤をICSへ追加することが示されている1)。そのなかでも、一般的にICSへのLABAの追加が行われている。しかし、近年トリプル療法の有用性の報告、ICSとLAMAの併用による相乗効果の可能性の報告などから、LAMA追加が注目されており、LABAとLAMAの違いが話題となることがある。
そこで、ICS単剤でコントロール不十分な18歳以上の喘息患者を対象に、ICSへ追加する薬剤としてLABAとLAMAを比較した無作為化比較試験(RCT)について、既報のシステマティックレビュー(SR)2)のアップデートレビュー(UR)を実施した。
8試験の解析の結果、呼吸機能(PEF[ピークフロー]、トラフFEV1[1秒量] )についてはLAMAがLABAと比べて有意な改善を認め、QOL(Asthma Quality of Life Questionnaire[AQLQ])についてはLABAがLAMAと比べて有意な改善を認めたが、いずれも臨床的に意義のある差(MCID)には達しなかった。また、喘息コントロール、増悪、有害事象についてはLABAとLAMAに有意差はなく、同等であった。
以上から、「ICSへの追加治療としてLABAとLAMAはいずれも同等に推奨される(エビデンスの確実性:B[中])」という推奨となった1)。ただし、谷村氏は「ICS/LAMA合剤は上市されていないため、アドヒアランス・吸入手技向上の観点からはICS/LABAが優先されうると考える。個別の症状への効果などの観点から、LABAとLAMAを使い分けることについては議論の余地がある」と述べた。
▶ 中用量以上のICSでコントロール良好例のステップダウンは?
「CQ4:成人喘息患者の長期管理において中用量以上のICSによりコントロール良好な状態が12週間以上経過した場合にICS減量は推奨されるか?」について、岡田 直樹氏(東海大学医学部 内科学系呼吸器内科学)が解説した。
高用量のICSの長期使用はステロイド関連有害事象のリスクとなることが知られ、国際的なガイドライン(GINA[Global initiative for asthma]2024)3)では、12週間コントロール良好であれば50~70%の減量が提案されている。しかし、適切なステップダウンの時期や方法、安全性については十分な検討がなされていないのが現状であった。
そこで、中用量以上のICSで12週間以上コントロール良好な喘息患者を対象に、ICSのステップダウンを検討したRCTについて、既報のSR4)のURを実施した。
抽出された7文献の解析の結果、ICSのステップダウンは経口ステロイド薬による治療を要する増悪を増加させず、喘息コントロールやQOLへの影響も認められなかった。単一の文献で入院を要する増悪は増加傾向にあったが、イベント数が少なく有意差はみられなかった。一方、重篤な有害事象やステロイド関連有害事象もイベント数が少なく、明らかな減少は認められなかった。
以上から、「中用量以上のICSでコントロール良好な場合はICS減量を行うことが提案される(エビデンスの確実性:C[弱])」という推奨となった1)。岡田氏は、今回の解析はすべての研究の観察期間が1年未満と短く、骨粗鬆症などの長期的なステロイド関連有害事象についての評価がなかったことに触れ、「長期的な高用量ICSの投与により、ステロイド関連有害事象のリスクが増加することも報告されているため、高用量ICSからのステップダウンにより、ステロイド関連有害事象の発現が低下することが期待される」と述べた。
▶ FeNOに基づく管理は有用か?
「CQ1:成人喘息患者の長期管理において呼気中一酸化窒素濃度(FeNO)に基づく管理は有用か?」について、鶴巻 寛朗氏(群馬大学医学部附属病院 呼吸器・アレルギー内科)が解説した。
FeNOは、喘息におけるタイプ2炎症の評価に有用であることが報告されている。FeNOは、未治療の喘息患者ではICSの効果予測因子であり、治療中の喘息患者では経年的な肺機能の低下や気道可逆性の低下、増悪の予測における有用性が報告されている。しかし、治療中の喘息におけるFeNOに基づく長期管理の有用性に関するエビデンスの集積は十分ではない。
そこで、臨床症状とFeNO(あるいはFeNOのみ)に基づいた喘息治療を実施したRCTについて、既報のSR5)のURを実施した。
対象となった文献は13件であった。解析の結果、FeNOに基づいた喘息管理は1回以上の増悪を経験した患者数、52週当たりの増悪回数を有意に低下させた。しかし、経口ステロイド薬を要する増悪や入院を要する増悪については有意差がみられず、呼吸機能の改善も得られなかった。症状やQOLについても有意差はみられなかった。ICSの投与量については、減少傾向にはあったが、有意差はみられなかった。
以上から、「FeNOに基づく管理を行うことが提案される(エビデンスの確実性:B[中])」という推奨となった1)。結語として、鶴巻氏は「FeNOに基づく長期管理は、増悪を起こす喘息患者には有用となる可能性があると考えられる」と述べた。
▶ 喘息の長期管理薬としてのマクロライドの位置付けは?
「CQ5:成人喘息患者の長期管理においてマクロライド系抗菌薬の投与は有用か?」について、大西 広志氏(高知大学医学部 呼吸器・アレルギー内科)が解説した。
小児を含む喘息患者に対するマクロライド系抗菌薬の持続投与は、重度の増悪を減らし、症状を軽減することが、過去のSRおよびメタ解析によって報告されている6)。しかし、成人喘息に限った解析は報告されていない。
そこで、既報のSR6)から小児を対象とした研究や英語以外の文献などを除外し、成人喘息患者の長期管理におけるマクロライド系抗菌薬の有用性について検討した適格なRCTを抽出した。
採用された17文献の解析の結果、マクロライド系抗菌薬は、入院を要する増悪や重度の増悪を減少させず、呼吸機能も改善しなかった。Asthma Control Test(ACT)については、アジスロマイシン群で有意に改善したが、MCIDには達しなかった。同様にAsthma Control Questionnaire(ACQ)、AQLQもマクロライド系抗菌薬群で有意に改善したが、MCIDには達しなかった。
以上から、本解析の結論は「マクロライド系抗菌薬の持続投与は、喘息患者に有用な可能性はあるものの、長期管理に用いることを推奨できる十分なエビデンスはない」というものであった。これを踏まえて、JGL2024の推奨は「マクロライド系抗菌薬を長期管理の目的で投与しないことが提案される(エビデンスの確実性:C[弱])」となった1)。また、この結果を受けてJGL2024の「図6-5 難治例への対応のための生物学的製剤のフローチャート」における2型炎症の所見に乏しい喘息(Type2 low喘息)から、マクロライド系抗菌薬が削除された。
■参考文献
1)『喘息予防・管理ガイドライン2024』作成委員会 作成. 喘息予防・管理ガイドライン2024.協和企画;2024.
2)Kew KM, et al. Cochrane Database Syst Rev. 2015;2015:CD011438.
3)Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024. Updated May 2024
4)Crossingham I, et al. Cochrane Database Syst Rev. 2017;2:CD011802.
5)Petsky HL, et al. Cochrane Database Syst Rev. 2016;11:CD011439.
6)Undela K, et al. Cochrane Database Syst Rev. 2021;11:CD002997.
(ケアネット 佐藤 亮)