パーキンソン病・運動障害疾患コングレス(MDS2018)の目玉企画は,世界各国の学会員が経験した症例のビデオを持ち寄るビデオ・チャレンジです.難しい症例の不随意運動をいかに考え,いかに診断・治療に結びつけるか,壇上のエキスパートが議論しますのでとても勉強になります.今年は新規遺伝子変異を当てさせるような回答困難な問題は少なく,良問揃いです.ただしそうは言っても知らなかったことも多く,正しく診断,正答することは難しいです.治療可能な患者さんを見逃さないためにもしっかり勉強しなければならないと改めて思いました.みなさんもぜひトライしてみて下さい.
Case 1(インド)
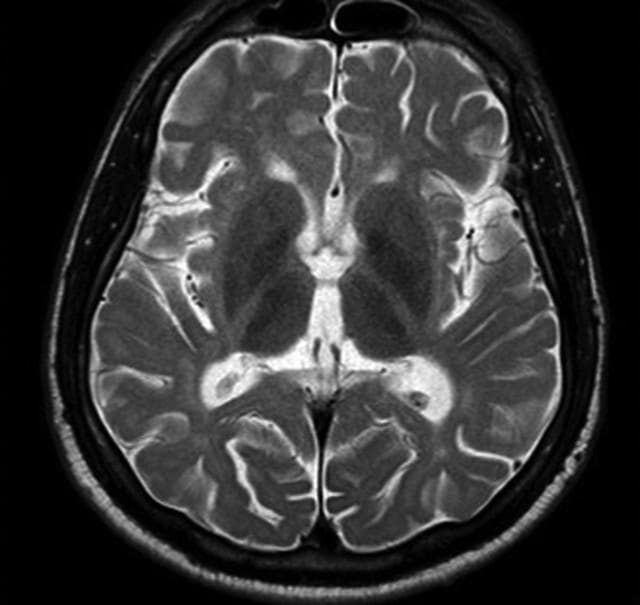
16歳男性.8ヶ月の経過で歩行障害,バランス障害,転倒が進行.上肢の姿勢時+運動時振戦,注視方向性眼振,構音障害と軽度の認知機能低下,易怒性を認める.視覚・聴覚に異常はなく,家族歴もなし.画像ではT2 hypothalamic hypointensityを認め,赤核も低信号.
➔
トルエン中毒(トルエンを含むEraz-exという少なくとも2年以上吸引していた)
T2 hypothalamic hypointensityを呈する疾患には,AMN,遅発発症Tay Sach病(GM2ガングリオシドーシス),POLG変異,成人発症セロイドリポフスチン症,傍腫瘍・自己免疫(抗Ri抗体).画像はhttp://www.mdsabstracts.com/abstract.asp?MeetingID=802&id=113291より.
Case 2(カナダ)
銅メダル
30歳女性.先祖はベトナム人.小脳性運動失調と不随意運動を主訴に来院,16-22歳でコカインなどの薬物依存.23歳で軽度認知障害,その後,顔面のミオキミアと四肢のジストニア,うつが出現.26歳で歩行が困難,27歳で幻覚,てんかん(強直間代発作),29歳で車椅子,高度認知症,30歳でミオクローヌスが出現.眼球はサッケードがhypermetricで,四肢は高度の痙性を認めた.
家族歴では父が神経疾患で死亡(15歳で発症した幻覚,認知症,運動・歩行障害.けいれん).兄も15歳で小脳性歩行障害で発症し,30歳になる前に認知症を発症.家系内に複数,同じ症状の者がいる.頭部MRIは軽度から中等度の脳萎縮.
➔
PSEN1遺伝子変異(全ゲノム解析にてミスセンス変異を同定).進行性認知症,小脳性運動失調(認知症発症前のこともあり)が基本症候で,これに運動異常症(ミオクローヌス,ジストニア),てんかんが合併することあり.非進行例ではコリンエステラーゼ阻害剤が有効であることあり.
Case 3(英国)
58歳男性.精神科から不安・うつに加え,精神症状をともなう認知症ということで紹介された.57歳時に軽度の不安症状で発症.半年後,精神症状のため離婚.食事摂取を中止し,サプリメントで体重を維持.3ヶ月後パニック発作と頸部の異常運動,自動車の運転困難(対向車が来ると叫ぶ).アパシー,幻視,悪夢.
➔
DPPX(Dipeptidyl-peptidase-like protein 6)抗体関連脳炎.3徴は
「体重減少・消化器症状,認知症・精神障害,中枢神経過敏性」である.3分の2の症例は免疫抑制療法が有効だが,治療の中断でしばしば再発する.17%で死亡が報告されているが,ほとんどは無治療例である.
DPPX抗体は2015年のビデオ・チャレンジにも報告されている.
35歳男性,27歳で触ったあとに首・体幹がぴくんと動く(スパスム・ミオクローヌス).徐々に範囲と程度が増強.その後,失調,便秘,回転性めまい,異常感覚,アロディニアも出現.
→Stimulus-sensitive myoclonus, ataxia, and dysautonomia due to DPPX-antibodies(dipeptidyl-peptidase-like protein-6;subunit of Kv4.2 potassium channel)幅広い臨床像.筋強剛,ミオクローヌスからStiff person症候群まで.自律神経障害(消化管,排尿,不整脈)
Ultrashort Case 1(インド)
64歳女性.14年前から全身性間代強直発作.4年前から両側性の手の振戦と運動緩慢が出現.肢節運動失行もあり.プラミペキソールやL-DOPAは無効.記銘力低下.しかしある治療にていずれも改善した.頭部CTにて基底核に石灰化.
➔
原発性副甲状腺機能低下症(カルシウム静注→内服による治療)
Ultrashort Case 2(スリランカ)
14歳から全般てんかん(強直間代発作).特徴的な徴候は,顔面,口唇,手指に認められる全身性のミオキミア.母と妹もてんかんで,同じ抗てんかん薬で治療を受けている.母は8歳で発症,16歳まで進行し,40歳以降は緩徐に改善傾向であった.
➔
Familial myokymia with seizure(Benign familial neonatal seizures 1).Kチャネル遺伝子変異の疑い(遺伝子診断未施行)
ここから症例紹介が開始.
(Case A)全身性ジストニアを呈し,T2WIで淡蒼球と尾状核が高信号.後部被殻がスペアされるため特徴的な所見を呈している.尿中有機酸分析で3-methyl glutaconic acid上昇していた症例の提示.常染色体劣性遺伝.
➔ 全ゲノム解析でSERAC1遺伝子変異を同定し,
MEGDEL症候群と診断.これは3-methylglutaconic aciduria (MEG), deafness (D), encephalopathy (E), and Leigh-like disease (L).画像所見はputaminal eyeと呼ばれている.画像はNeuropediatrics 2015より.

(Case B)44歳男性で亜急性発症の全身性の小脳性運動失調・振戦を呈した症例の提示.造影MRIで小脳脳回が造影される.
➔
クリプトコッカス髄膜脳炎.くも膜炎・軟膜炎の所見で,シロップが垂れたケーキに見えることから
sugar coating signと呼ばれている.
(Case C)69歳男性で6ヶ月の経過で,亜急性にパーキンソニズムを呈し,寝たきり,胃ろうを要した.
➔
硬膜動静脈瘻.手術により回復した.
(Case D)14歳男性で7歳から言語障害,日内変動なく,L-DOPAへの反応性もなし.X線で股関節のhip dysplasiaを認める.
➔
GM1 gangliosidosis type 3
Case 6(韓国)
銀メダル
65歳男性.1年前から不随意運動が出現.緩徐進行性.頸部から始まり上肢,体幹に進展した.クロナゼパムやハロペリドールにより軽度改善.6ヶ月前,ハロペリドール増量後に薬剤性パーキンソニズムが出現,中止により改善したが不随意運動は増悪.家族歴なし.神経学的には顎を大きく上下させるような頸部のyes-yes tremor?,舞踏運動のようにも見える.歩行はbroad-baseで,姿勢保持障害あり.認知機能正常.FLAIRで両側基底核が低信号,両側尾状核の萎縮.IT-15遺伝子CAGリピート伸長なし.その後,前医の頭部MRIを入手し,基底核は初期には高信号を呈していた.アマンタジン1000 mg静注にて顕著に改善.
➔
抗CRMP5(collapsin response mediator protein 5)抗体陽性傍腫瘍性舞踏病.極めて緩徐な進行でも,高齢者では傍腫瘍症候群を鑑別に上げる必要がある.アマンタジンは有効である機序は不明(?).総説にはparaneoplastic choreaとして記載は見たことがあったが,一般的なハンチントン病とは臨床像は異なる印象.
Short case 7(オランダ)
53歳女性.機能性疾患を疑われ紹介される.10~15年前から疲労,行動異常(脱抑制),うつが見られた.数年前から進行性の足の引きずり歩行.1年前から急性発症,進行性の不随意運動を四肢に認めた.舞踏運動であるが,スピードがきわめて早く,機能性疾患を疑わせる.なにかに集中すると症状は改善した.上肢に筋強剛.歩行ではすくみを認める.運動ニューロン徴候なし.頭部MRIで尾状核萎縮なし.
➔
C9orf72遺伝子変異.通常は前頭側頭型認知症+ALSを呈するが,本例はハンチントン病(HD)様で,HD phenocopyと考えられる.HD phenocopyの原因で最も頻度が高いのは,C9orf72遺伝子変異であることが報告されている(Neurology 2014).
Case 8(スウェーデン)
72歳男性.45歳,発声を伴う不随意運動,摂食障害,性格変化が出現.記銘力低下,高度の不眠を認める.家族歴では3世代に渡り,異常運動を認めている(母方の祖父といとこに類症.家系内にmale to male transmissionなし).さらに2名の男性が突然死をしている(剖検で尾状核萎縮と変性所見).既往歴としてレイノー現象,慢性腰痛,心不全を伴う拡張型心筋症と房室ブロックを認め,ペースメーカー植え込み術とACE阻害薬を開始.検査では有棘赤血球あり,CK軽度上昇,脱髄型感覚運動ニューロパチーとミオパチーの合併.赤血球分析でKx蛋白欠失.
➔
McLeod症候群.MAGEB遺伝子における欠失.X染色体に連鎖する成人発症の疾患で,ハンチントン病様所見,心筋症,ニューロパチー,ミオパチー,有棘赤血球症と溶血,CK上昇をみとめる.進行は緩徐.致死性不整脈のため突然死しうるので診断の確定が必要.また血液型不適合輸血にも注意が必要.
Ultrashort Case 3(インド)
21歳男性.家族内類症なし.両親に血族結婚なし.13歳で緩徐に手,頭部,頸部の不随意運動が出現.ミオクローヌスのように見える.最近1-2年で顕著になった.発作性に出現し,消失することがある.不安で増悪する.小脳性運動失調なし.日常生活はほとんど可能.
➔ 全ゲノム解析で,
ADCY5遺伝子ミスセンス変異.ミオクローヌスージストニア型.症状の重症度は極めて軽い.
Ultrashort Case 4(スリランカ)
44歳の未婚の男性.3日間の発熱後,上下肢のけいれん発作が出現.5日間オプソクローヌスが持続.失調による頻回の転倒,易刺激性,不穏.軽度の意識障害.項部硬直,髄膜刺激徴候.頸部リンパ節腫脹.
➔
HIV感染(sero-conversion)に伴うオプソクローヌスーミオクローヌスー失調症候群.
Case 10(オーストリア)
金メダル
22歳女性.両親がいとこ婚.4歳時にけいれん発作(小発作疑い)にて発症.6歳てんかん発作の頻度が増加したが,エトスクシミド内服にて改善.低トーヌスで軽度の発達遅延.22歳,突然,頸部,体幹,上肢の異常運動が出現(寝た状態で頸と体幹を上下に動かすような運動).1-10分の発作で,年4-5回見られた.発作中には意識は保たれたが,発熱により意識障害が出現する.妹は舞踏運動と同様の意識障害を認めた.H-MRSで視床におけるGABAピーク上昇あり.
➔
GABAアミノ基転移酵素欠損症.全ゲノム解析でABAT遺伝子のミスセンス変異をホモで認めた. GABAの代謝にかかわるGABAトランスアミナーゼ欠損症.常染色体劣性遺伝できわめて稀な疾患.
4-Aminobutyrate Aminotransferase(ABAT)遺伝子変異により,ドパミンを水酸化してノルアドレナリンを産生する酵素が欠損する.このためドパミンの増加とノルアドレナリン・アドレナリンの欠乏が生じる.精神遅滞,筋緊張低下,腱反射亢進,嗜眠,難治性のてんかん発作を認める.
Case 11(ドイツ)
48歳女性.18歳時,階段を降りるときに転倒.以後,徐々に転倒が増加.現在は歩行器を用いての歩行.Mannの肢位不可,歩くと体が大きく上下に揺れる(陰性ミオクローヌスのため).歩行に対する不安症状が強い.母も失調,ミオクローヌス,腱反射亢進を呈した.いとこの双子もミオクローヌスを認める.
➔
Cortical tremor
Cortical myoclonusの亜型.典型的にはてんかんに合併する.しばしば家族性で,常染色体優性遺伝形式.転倒に対する不安が顕著に現れる.抗てんかん薬とベンゾジアゼピンの組み合わせで改善する.複数の原因遺伝子が同定されている(NOL3遺伝子,δカテニン遺伝子の5 nucleotide repeat expansion)
Case 12(カナダ)
51歳男性,7ヶ月前に呼吸器症状に引き続き,夜間に増悪するゆっくりとした不自然な発語,流涎,嚥下障害,舌の前後・上下にうねうねと起伏する不随意運動(飲食時に増悪,手で閉口する必要がある,舌咬症,軽快因子なし).5ヶ月後,球麻痺症状の進行,感情失禁,軽度の労作での呼吸苦,痙性,針筋電図にてびまん性の下位運動ニューロン障害.
➔
筋萎縮性側索硬化症(球麻痺型).舌がうねうねと起伏する不随意運動は運動異常症ではまれ.むしろ虚血や外傷による脳幹病変に合併することが多い.Wilson病でも報告あり.
Case 13(ドイツ)
53歳女性.既往歴;RLS.2013年からアルコール依存.2006年,進行性する歩行の不安定性.2013年体重減少.RBDあり.2016年末から精神運動徴候,言語非流暢性,サッケード開始障害,右肩のジストニア,左下肢のジストニア,痙性不全対麻痺+失調性歩行.L-DOPA無効.脳萎縮軽度,DAT-SPECT明らかな左右差なし.SCD,全身性ジストニア遺伝子検索した範囲で陰性.全ゲノム解析でLRRK2遺伝子ミスセンス変異,しかし臨床像が合わない.
➔
ハンチントン病(IT15遺伝子46リピート).頻度の高い疾患の稀な症候も考える必要がある.遺伝子検査で臨床的に意味不明な変異を認めた場合には診断における意義を慎重に考える必要があるという教訓.
Ultrashort Case 5(USA)
20代の3兄弟(2名女性).17-18歳で頸部のジストニア様振戦を呈したのち,バランス障害.緩徐進行性の経過.注意力低下.深部感覚障害,腱反射消失.
➔ αTTP(αtocopherol transfer protein)遺伝子変異.診断
AVED(ataxia with vitamin E deficiency).27家系43症例を対象にした症例集積研究で,28%にhead titubation,13%にジストニアの記載がある(Am J Hum Genet 62; 301-310, 1998).
【グランドラウンド4症例】
Case 1
53歳女性.顔面や四肢のミオクローヌスてんかん.反射性ミオクローヌス,認知機能低下,小脳性運動失調,無動を認めるが,筋強剛なし.頭部MRI異常なし.
➔
Gaucher disease 3型.神経症状を伴うが2型よりも軽度,進行も緩徐.異常眼球運動,ミオクローヌス,小脳性運動失調,けいれんと多様.
Case 2
72歳男性とその息子.常染色体優性遺伝.左手振戦と声のふるえ.ストレスで増悪する書字障害(書痙).両側姿勢時振戦,歩行正常.息子にも同様の症状が見られたが,ある治療で寛解.
➔
瀬川病(Dopa-responsive dustonia).GTPシクロヒドロラーゼ遺伝子変異.
Case 3
23歳男性.小脳性運動失調,頸部の振戦様運動.クロナゼパム有効.歩行不能で車椅子での生活.錐体路徴候.指タップslow.頭部MRIにて小脳萎縮.
➔
SCA11(TTBK2遺伝子変異).TTBK2(Tau-tubulin kinase 2)はカゼインキナーゼ(CK1)グループメンバーで,タウリン酸化と凝集に関与する.調べた範囲では日本人の報告例なし.
Case 4
23歳と26歳の姉妹.妹は7歳から歩行障害.左足のつま先と体幹のジストニアによる動揺性障害.しかし後ろ歩きは上手にできる.書字障害(肩が挙上してしまう),構音障害.L-DOPA無効.
➔
DYT1(DCTN1遺伝子変異)