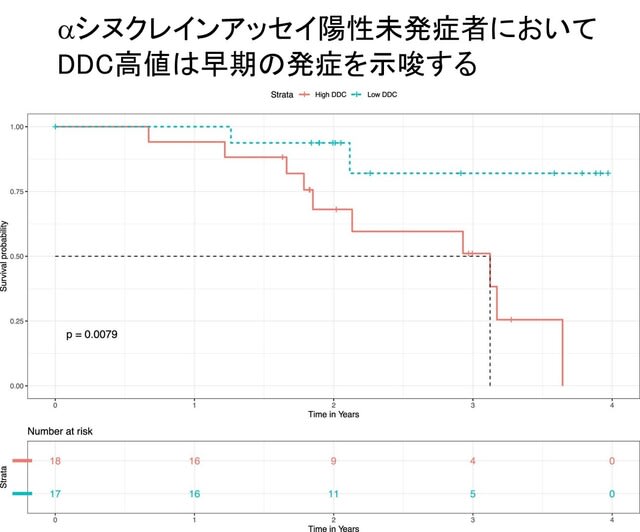
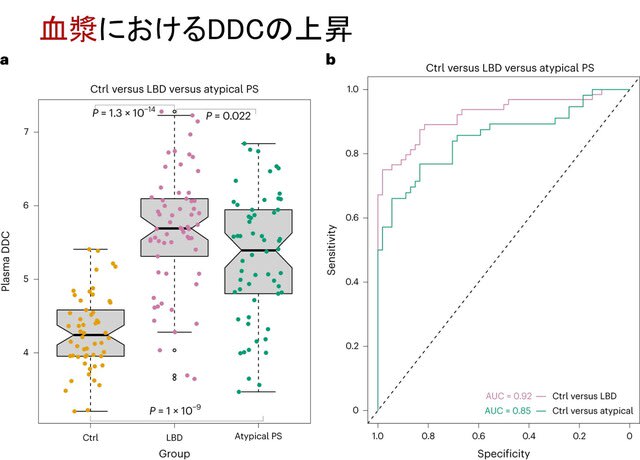
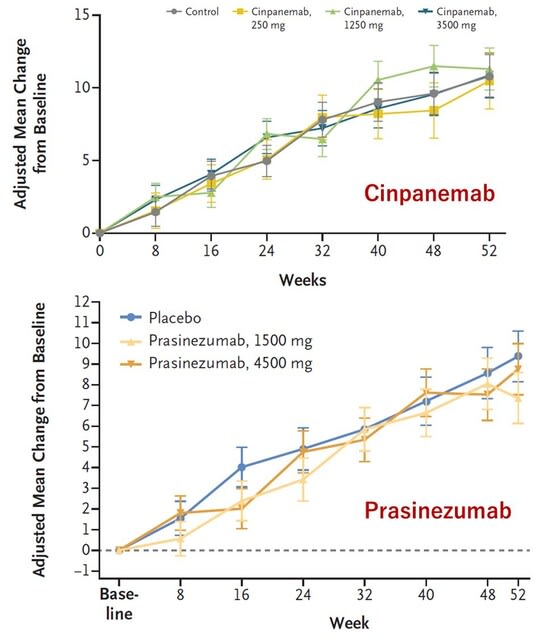
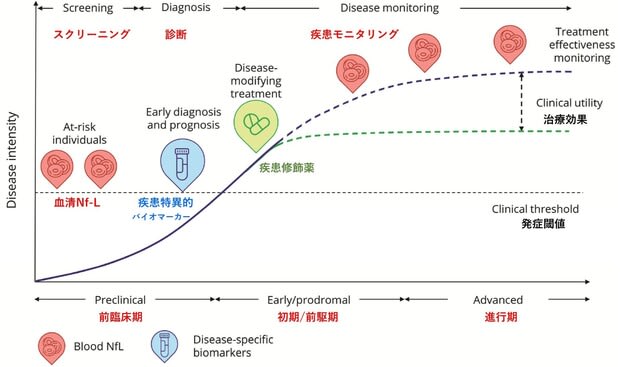
過去の研究で,糖尿病がパーキンソン病(PD)のリスクを増加することが知られています.またPDモデルマウスにおいて糖尿病治療薬「グルカゴン様ペプチド-1(GLP-1)受容体作動薬」が神経保護作用を有することも報告されていました.今回,フランスから,GLP-1受容体作動薬のひとつ,リキシセナチド(lixisenatide,商品名リキスミア)の皮下注射が,第2相二重盲検無作為化プラセボ対照試験LixiParkにて,PDの進行を遅らせる効果が示され,NEJM誌に発表されました.「GLP-1受容体作動薬」のうち脳に到達するものは,PDに対し神経保護効果を示すことを示した意味で素晴らしい研究ですが,一方で慎重に考える必要性を感じました.なぜならこの薬剤は最近,「GLP-1ダイエット」などと呼ばれるやせ薬として自由診療で処方され,安全性の面で懸念が生じているためです(https://tinyurl.com/2crd5uhw).
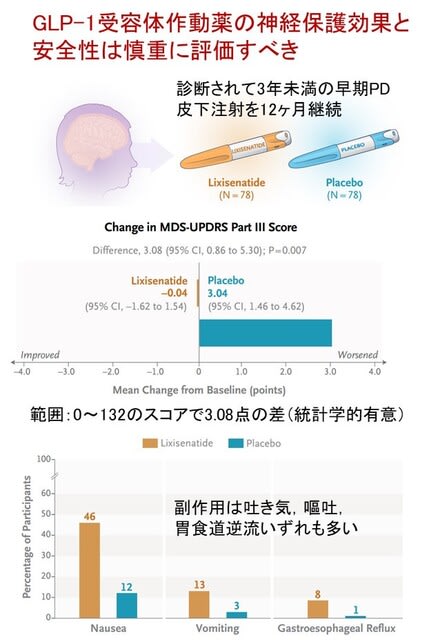
研究の対象は診断されて3年未満で,抗パーキンソン病薬による治療中であるが運動合併症のない者です.リキシセナチドまたはプラセボを12ヵ月間毎日皮下投与する群に1:1の割合で割り付け,その後,2ヵ月のウォッシュアウト期間を設けました.主要エンドポイントは,MDS-UPDRSパートIII(範囲:0~132,スコアが高いほど症状が重い)のスコアのベースラインからの変化で,12ヵ月後に評価しました.
さて結果ですが,78人ずつ両群に割り付けられました.ベースライン時のMDS-UPDRSパートIIIはいずれも約15点でした.12ヵ月後,リキシセナチド群で0.04点の改善(ほぼ不変),プラセボ群で3.04点の悪化を示しました(差,3.08;95%信頼区間0.86~5.30;P=0.007).2ヵ月のウォッシュアウト後(リキシセナチドの2ヶ月の中止後),リキシセナチド群17.7点,プラセボ群20.6点で,効果は保たれていました(とはいえ,かなり短い期間での評価です).MDS-UPDRSサブスコアなどの副次エンドポイントは両群間に差はありませんでした.副作用については,吐き気はリキシセナチド投与群の46%(プラセボ群は13%のみ),嘔吐は13%にみられました.以上より,初期のPD患者において,リキシセナチドは12ヵ月後の運動障害の進行を抑制し有望と考えられました.しかし消化器症状を伴うことが示され,著者らはリキシセナチドの効果と安全性を明らかにするために,より長期かつ大規模な試験が必要と述べています.
私の意見は,1点目は病態修飾療法でしばしば問題になる点で,「この差は本当に臨床的意義があるか?」ということです.統計的に有意であっても効果は小さいと思いました.アルツハイマー病におけるレカネマブと同様,専門家の中でも意見が分かれるだろうと思います(もちろん将来の可能性を予感させるものですが・・・).2点目はこの情報を得たPD患者さんは「慌ててこの内服を開始すべきではない」ということです.まだ第2相試験であり,これから大規模な第3相試験で結論が出ます.発症3年以内の運動合併症のない人限定の効果であることも理解が必要です.さらに上述の通り安全性=副作用が問題になります.吐き気や嘔吐は抗パーキンソン病薬の内服に影響するため避けるべき症状ですし,体重減少もただでさえ進行期に痩せるPDでは好ましくありません.さらにGLP-1受容体作動薬の重篤な副作用として低血糖と急性膵炎があります.決して慌てて内服開始する薬ではないことを認識する必要があります.
研究に疑問もあります.例えば副次エンドポイントで有効性が示せなかった理由が不明ですし,これだけ副作用が多いと盲検とならなかった可能性もあります.作用機序も完全に解明されていません.これからに期待したいと思います.
Meissner WG, et al. Trial of Lixisenatide in Early Parkinson’s Disease. New Engl J Med. April 3, 2024. (doi.org/10.1056/NEJMoa2312323)
研究の対象は診断されて3年未満で,抗パーキンソン病薬による治療中であるが運動合併症のない者です.リキシセナチドまたはプラセボを12ヵ月間毎日皮下投与する群に1:1の割合で割り付け,その後,2ヵ月のウォッシュアウト期間を設けました.主要エンドポイントは,MDS-UPDRSパートIII(範囲:0~132,スコアが高いほど症状が重い)のスコアのベースラインからの変化で,12ヵ月後に評価しました.
さて結果ですが,78人ずつ両群に割り付けられました.ベースライン時のMDS-UPDRSパートIIIはいずれも約15点でした.12ヵ月後,リキシセナチド群で0.04点の改善(ほぼ不変),プラセボ群で3.04点の悪化を示しました(差,3.08;95%信頼区間0.86~5.30;P=0.007).2ヵ月のウォッシュアウト後(リキシセナチドの2ヶ月の中止後),リキシセナチド群17.7点,プラセボ群20.6点で,効果は保たれていました(とはいえ,かなり短い期間での評価です).MDS-UPDRSサブスコアなどの副次エンドポイントは両群間に差はありませんでした.副作用については,吐き気はリキシセナチド投与群の46%(プラセボ群は13%のみ),嘔吐は13%にみられました.以上より,初期のPD患者において,リキシセナチドは12ヵ月後の運動障害の進行を抑制し有望と考えられました.しかし消化器症状を伴うことが示され,著者らはリキシセナチドの効果と安全性を明らかにするために,より長期かつ大規模な試験が必要と述べています.

私の意見は,1点目は病態修飾療法でしばしば問題になる点で,「この差は本当に臨床的意義があるか?」ということです.統計的に有意であっても効果は小さいと思いました.アルツハイマー病におけるレカネマブと同様,専門家の中でも意見が分かれるだろうと思います(もちろん将来の可能性を予感させるものですが・・・).2点目はこの情報を得たPD患者さんは「慌ててこの内服を開始すべきではない」ということです.まだ第2相試験であり,これから大規模な第3相試験で結論が出ます.発症3年以内の運動合併症のない人限定の効果であることも理解が必要です.さらに上述の通り安全性=副作用が問題になります.吐き気や嘔吐は抗パーキンソン病薬の内服に影響するため避けるべき症状ですし,体重減少もただでさえ進行期に痩せるPDでは好ましくありません.さらにGLP-1受容体作動薬の重篤な副作用として低血糖と急性膵炎があります.決して慌てて内服開始する薬ではないことを認識する必要があります.
研究に疑問もあります.例えば副次エンドポイントで有効性が示せなかった理由が不明ですし,これだけ副作用が多いと盲検とならなかった可能性もあります.作用機序も完全に解明されていません.これからに期待したいと思います.
Meissner WG, et al. Trial of Lixisenatide in Early Parkinson’s Disease. New Engl J Med. April 3, 2024. (doi.org/10.1056/NEJMoa2312323)