がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
489)がん細胞におけるグルコース非依存性の代謝適応:グルタミンと逆向きTCA回路
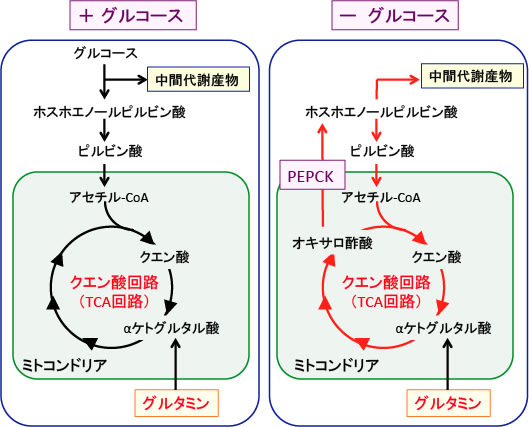
図:細胞内に取込まれたグルコースとグルタミンはクエン酸回路(TCA)回路などでエネルギー産生と物質合成の材料になる。グルコースが利用できない状況では、グルタミンがαケトグルタル酸に変換してTCA回路を経由し、オキサロ酢酸からホスホエノールピルビン酸になる経路でミトコンドリアでの物質合成が維持される。このときがん細胞では、ホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)の発現が亢進することによってこの経路が促進される。PEPCKは肝臓における糖新生に関わる酵素であるが、がん細胞ではグルコース非依存的な代謝適応の際に利用されている。(Molecular Cell 60, 195–207, 2015年)
489)がん細胞におけるグルコース非依存性の代謝適応:グルタミンと逆向きTCA回路
【がん細胞はグルコースの消費が亢進している】
細胞はミトコンドリアにおけるTCA回路と電子伝達系における酸化的リン酸化によって、酸素を使ってグルコース(ブドウ糖)から効率的にエネルギー(ATP)を産生しています。
一方、酸素がない状態では、嫌気性解糖系(グルコースを嫌気的に分解して乳酸を生成する代謝系)によってエネルギー(ATP)が産生されます。運動をして筋肉細胞に乳酸が貯まるのは、酸素の供給が不足して嫌気性解糖が進むからです。
解糖はグルコースがピルビン酸になる過程で、この酵素反応は細胞質で行われます。酸素の供給が十分でないとピルビン酸は細胞質で乳酸に変わります。
酸素の供給がある状態では、ピルビン酸はミトコンドリア内に取り込まれて、TCA回路と電子伝達系によってさらにATPの産生が行われます。
正常細胞では、酸素が存在すれば酸素を使ったミトコンドリアでの呼吸によってATPが産生されますが、がん細胞では酸素が十分に存在する状況でも、酸素を使わない解糖系でのグルコース代謝が亢進しているのが特徴です。
酸素が存在する条件で解糖系が亢進している状態を「好気性解糖」と言います。この現象を発見したオットー・ワールブルグにちなんで「ワールブルグ効果」とも言います。
このように、がん細胞ではミトコンドリアにおける酸化的リン酸化によるエネルギー産生が低下し、細胞質における嫌気性解糖系を介したエネルギー産生が増加しているのが特徴です。(下図)

図:グルコース(ブドウ糖)は血液中から細胞に取り込まれ、解糖、TCA回路(クエン酸回路やクレブス回路と呼ばれる)、電子伝達系における酸化的リン酸化を経てエネルギー(ATP)が取り出される。解糖はグルコースがピルビン酸になる過程で、この酵素反応は細胞質で行われる。
酸素が十分にある状態では、ピルビン酸はミトコンドリアの基質に取り込まれ、ピルビン酸脱水素酵素によって補酵素A(CoA)と結合してアセチルCoAになり、TCA回路に入ってNADHやFADH2が生成される。こうして生成されたNADHやFADH2は、ミトコンドリア内膜に埋め込まれた酵素複合体に電子を渡し、この電子は最終的に酸素に渡され、まわりにある水素イオンと結合して水を生成する。このようにTCA回路で産生されたNADHやFADH2の持っている高エネルギー電子をATPに変換する一連の過程を酸化的リン酸化と呼び、これの酵素反応をおこなうシステムを電子伝達系と呼ぶ。こうしてつくられたATPはミトコンドリアから細胞質へ出て行き、そこで細胞の活動に使われる。がん細胞では、酸素が存在する条件でも解糖系が亢進し(好気性解糖)、乳酸の産生が増え、ミトコンドリアにおける酸化的リン酸化によるエネルギー産生が低下している。
がん細胞がグルコースを大量に消費することは良く知られています。がん細胞では正常細胞に比べて数倍から数十倍ものグルコースの取込みが増えています。
がん細胞を検出するPET検査は、がん細胞がグルコースを正常細胞よりも大量に消費する現象を利用しています。解糖系だけだとグルコース1分子当たりATPは2分子しか産生されませんが、ミトコンドリアで完全に分解されるとグルコース1分子当たり32〜38分子のATPが産生されます。

図:グルコース(ブドウ糖)は細胞内に取込まれると、解糖でピルビン酸になり、酸素が無いと嫌気性解糖(乳酸発酵)で乳酸が最終的に産生される。ミトコンドリアではTCA回路と電子伝達系での酸化的リン酸化によって酸素を使って二酸化炭素と水に分解される。グルコース1分子当たり、解糖系だけだと2分子のATPしか産生されないが、ミトコンドリアで完全に分解されると32から38分子のATPが産生される。
グルコースはATP産生だけでなく、その炭素骨格からアミノ酸や脂肪酸や核酸を合成できるので、グルコースを完全に二酸化炭素と水に分解してしまうと細胞分裂に必要な物質合成ができないため、ミトコンドリアでのエネルギー産生が抑制されている理由の一つになっています。
がん細胞に限らず、増殖活性の高い細胞では、エネルギー産生と物質合成の材料確保を両立するため、解糖系でのエネルギー産生が亢進しています。(下図)

図:グルコース(ブドウ糖)はエネルギー(ATP)と細胞構成成分(脂質や核酸など)を作り出す材料になる。細胞が増殖を停止している場合は、ほとんどのグルコースをATP産生に使えるので、ミトコンドリアで酸素を使ってTCA回路と酸化的リン酸化で二酸化炭素(CO2)と水(H2O)に完全に分解してATPを産生できる。細胞分裂・増殖している場合は、細胞を増やすための物質合成の材料としてグルコースを使うためにミトコンドリアでの完全分解は抑制される。
【2-デオキシ-D-グルコースは解糖系を阻害する】
一般的にグルコースの取込みの多いがん細胞ほど増殖が早く、悪性度が高く、予後が悪いと言えます。
取り込まれたグルコースはエネルギー産生と細胞を構成する成分の合成に使われるので、グルコースの取込みが多いことは増殖活性が高いことを意味します。
したがって、がん細胞におけるグルコースの取込みや解糖系での代謝を阻害すると、がん細胞の増殖活性を低下させることができます。また、抗がん剤治療や放射線治療にグルコースの取込みや解糖系を阻害する治療を併用すると、抗がん剤や放射線治療の効き目を高めることができます。
がん細胞で亢進している解糖系を阻害する方法に2-デオキシ-D-グルコース(2-DG)があります。
2-DGは、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換されたグルコース誘導体です。
2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター:GLUT)を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。
リン酸化されて2-DG-6リン酸になるとGLUTを通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内で蓄積します。
蓄積した2-DG-6リン酸はヘキソキナーゼをフィードバック阻害するので、正常のグルコース代謝(解糖系やペントースリン酸経路)も阻害されます。
(下図)
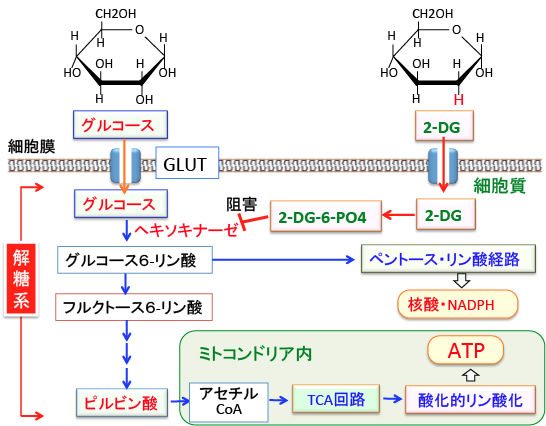
図:2−デオキシ-D-グルコース(2-DG)はグルコースの2位の水酸基(OH)が水素原子(H)に置換したグルコース類縁体で、グルコースと同じようにグルコーストランスポーター(GLUT)を通って細胞内に入る。グルコースはヘキソキナーゼでグルコース-6-リン酸に変換されてさらに解糖系酵素で分解されてATP産生へ使われ、あるいはペントースリン酸回路で核酸やNADPHの合成に利用される。一方、2−DGはヘキソキナーゼで6位がリン酸化されて2-デオキシ-D-グルコース-6-リン酸(2-DG-6-PO4)に変換されるが、2-DG-6-PO4はその先の解糖系酵素で代謝できない。細胞質内で蓄積した2-DG-6-PO4はヘキソキナーゼをフィードバック阻害するので、解糖系でのグルコース代謝が阻害されてATP産生や核酸やNADPHの産生が低下する。
【がん細胞はグルコースを断たれても増殖できる】
一般的に、がん細胞ではグルコースの取込みと解糖系の亢進と乳酸の産生が増えています。
がん細胞が増殖するために必要なエネルギー産生と物質合成はグルコース依存度が高いので、グルコース摂取を少なくするだけで増殖抑制効果が得られます。
2-デオキシ-D-グルコース(2-DG)でヘキソキナーゼの段階で解糖系とペントースリン酸経路を阻害すると、がん細胞の増殖は抑制されます。
しかし、がん細胞のミトコンドリア機能があまり障害されていない場合は、2-DGによる増殖抑制は減弱します。
多くの場合、がん細胞でもミトコンドリアの機能は保たれています。そのため、2-DGの抗腫瘍効果は限界があります。
それは、グルコースの利用が制限されると、がん細胞は他の栄養成分(主にアミノ酸)を使ってエネルギー産生と物質合成ができるような代謝適応を行おうとするためです。
グルコース摂取をゼロにしても人間は生きていけますが、たんぱく質(アミノ酸)は正常細胞の維持に必要なため、通常は体重1kg当たり1g程度のたんぱく質の摂取が必要です。
いくつかのアミノ酸(必須アミノ酸)は体内で合成できないので、食事からの摂取が必要です。
グルコースが無い状況でも、がん細胞はたんぱく質由来のアミノ酸を使ってエネルギー産生と物質合成を行い、増殖を続けることが可能になります。
この代謝適応のメカニズムを知ると、2-DGやケトン食の抗腫瘍効果を高める方法が理解できます。
【糖質と脂質とタンパク質の代謝経路は密接に関連している】
グルコース(ブドウ糖)の代謝系である解糖系とTCA回路(クエン酸回路)は、アミノ酸や脂肪酸との代謝系から独立しているのではなく、これらグルコースとアミノ酸と脂肪酸の代謝経路の間には生化学的な物質の流れがあり、これらの生命構成成分間の合成(同化)および分解(異化)の経路は密接につながっています(下図)。

図:細胞の主要の代謝経路の関係: グルコースを代謝する解糖系とクエン酸回路(TCA回路)は脂肪酸やアミノ酸の代謝経路と密接に関連し、しかもこれらの経路の多くが逆行できる。したがって、糖質を摂取しなくても、脂肪酸やアミノ酸から体内で糖を合成でき、エネルギー(ATP)や細胞構成成分(細胞膜や核酸など)を作ることができる。これが、糖質制限だけではがん細胞の増殖抑制に限界がある理由になっている。(糖質制限ではインスリンの分泌抑制によるがん細胞増殖抑制は得られるが、エネルギーを枯渇させる効果は限定的と言える)
アミノ酸や脂肪酸に由来する炭素骨格はアセチルCoAからTCA回路に入って分解され、エネルギーを産生し(異化)、これらの経路から得られる炭素骨格は細胞の高分子構成成分の合成材料となります(同化)。
つまり、糖質がほとんど含まれていない肉だけを食べても、肉に含まれるタンパク質(分解されてアミノ酸になる)と脂肪(分解されて脂肪酸とグリセロールになる)から、糖もできるのです。
このことが、糖質制限を行っても低血糖にならないので、がん細胞の増殖を抑える効果に限界がある理由になっています。
糖質制限やケトン食によるインスリン分泌の低下やケトン体の増加は、がん細胞の増殖抑制に大きく寄与しますが、がん細胞のエネルギー産生や物質合成を完全に止めることができない(多少は抑制されるが)ので、がん細胞の増殖を完全に押さえ込むことには限界があると言わざるを得ません。
糖質制限やケトン食の抗がん作用の限界を克服する手段として、「2-デオキシ-D-グルコースなどを使ってがん細胞の解糖系を阻害する方法」に加えて、「そのときにがん細胞が行う代謝の変化(代謝適応)をターゲットにする」ことが必要になります。
がん細胞のおけるグルコース非依存性の代謝適応について理解することが重要になります。
【低酸素誘導因子-1がワールブルグ効果を引き起こす】
前述のように、がん細胞の代謝の最大の特徴は、「グルコースの取込みと解糖系の亢進と、ミトコンドリアでの酸化的リン酸化の抑制」です。これをワールブルグ効果(Warburg effect)と呼んでいます。
正常細胞では酸素が無い状況では解糖系でエネルギーを産生し、これを嫌気性解糖といい、乳酸がたまる代謝になります。正常細胞では、酸素が使える状況では嫌気性解糖系は阻止され、ミトコンドリアでの酸素を使った代謝に切り替わります。
しかし、がん細胞では、酸素が十分に存在する条件でも、解糖系でのエネルギー産生が主体で、ミトコンドリアでの酸化的リン酸化によるエネルギー産生は抑制されています。この酸素が存在する状況での解糖系亢進を「好気性解糖」と言います。
がん細胞が数を増やすためには、取り入れたグルコースをエネルギー産生のためだけでなく、細胞を構成する高分子成分(細胞膜やDNAなど)を合成するための材料として確保する必要があります。つまり、全てのグルコースを水と二酸化炭素に完全に分解するのではなく、一部を核酸や脂質の合成に利用するために、ミトコンドリアでの酸化的リン酸化が抑制されているのです。
この好気性解糖やワールブルグ効果を根本で制御しているのが低酸素誘導因子-1(HIF-1)で、増殖因子などで活性化されるPI3K/Akt/mTORシグナル伝達系やIL-6/STAT3系などによってHIF-1は活性化されます。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子ですが、がん細胞では低酸素状況でなくてもHIF-1は恒常的に活性化されています。
HIF-1はグルコースを細胞内に取込むグルコーストランスポーターや、解糖系酵素のヘキソキナーゼ、ペントース・リン酸経路のグルコース-6リン酸脱水素酵素の発現を亢進します。さらにピルビン酸から乳酸に変換する乳酸脱水素酵素の発現を亢進し、ピルビン酸脱水素酵素を阻害するピルビン酸脱水素酵素キナーゼの発現を亢進します。その結果、ピルビン酸からアセチルCoAへの移行が抑制されて、ミトコンドリアでのATP産生は抑制されます。(下図)
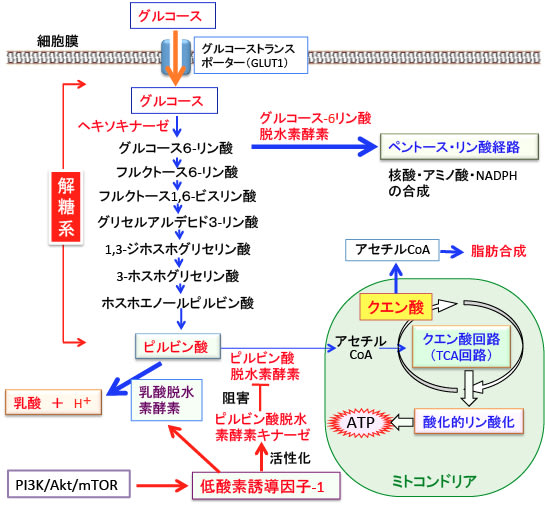
図:がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸の産生が増えている(ワールブルグ効果)。低酸素誘導因子(HIF-1)はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす。ヘキソキナーゼの量を増やして解糖系を亢進し、グルコース-6-リン酸脱水素酵素を増やしてペントース・リン酸経路を活性化する。乳酸脱水素酵素の量を増やしてピルビン酸から乳酸への変換を促進し、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導してピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。これらの作用によって、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化を抑制されている。TCA回路で生成されたクエン酸はアセチルCoAに変換されて脂肪やコレステロールの産生に使われる。
HIF-1の活性化を阻止することは、がん細胞のワールブルグ効果を正常化し、代謝適応を阻止することにつながります。(364話参照)
【グルタミンからホスホエノールピルビン酸への変換】
がん細胞が増殖するために、栄養素の需要は増大します。特にグルコースの取込みと利用は、正常細胞の数倍から数十倍に達します。
したがって、グルコースが不足すると、がん細胞はその増殖と生存を維持するために代わりの栄養源を使うようスイッチを切り替えなければなりません。
グルコースが欠乏すると、グルタミンをエネルギー産生や物質合成の材料に使うように代謝系が変更されます。
このとき、ホスホエノールピルビン酸カルボキシキナーゼという酵素を使って、グルコースに依存しないで増殖できることが知られています。以下のような報告があります。
Mitochondrial Phosphoenolpyruvate Carboxykinase Regulates Metabolic Adaptation and Enables Glucose-Independent Tumor Growth.(ミトコンドリアのホスホエノールピルビン酸カルボキシキナーゼは代謝的適応を調節し、グルコースに依存しない腫瘍の増殖を可能にする)Molecular Cell 60, 195–207, 2015年
【要旨】
がん細胞は栄養素が欠乏した状況で増殖するために代謝的に適応する。今回我々は、代謝的ネットワーク分析を組み合わせ、グルコースに依存しないがん細胞の増殖を支える代謝経路を同定した。
グルコースの欠乏は、クエン酸回路(TCA回路)ならびに糖新生の早期段階の経路を変更することによって、グルコースに依存しない細胞増殖を促進した。
グルコースの制限は、ミトコンドリアにおけるホスホエノールピルビン酸カルボキシキナーゼの活性亢進によって、グルタミンからホスホエノールピルビン酸への合成を促進した。
このような状況下では、セリンやプリンの生合成を含めた、通常であればグルコースによって維持されている生合成経路の材料として、グルタミン由来のホスホエノールピルビン酸が使われていた。
ホスホエノールピルビン酸カルボキシキナーゼ(PCK2)の発現は、グルコースが制限された状況下でのin vitorにおける腫瘍細胞の増殖の維持ならびにin vivoでの腫瘍成長の維持に必要だった。
PCK2発現の上昇はいくつかのヒトの腫瘍で観察され、非小細胞性肺がん患者の腫瘍組織でも多く認められた。
我々の研究結果は、ヒトの腫瘍において、グルコースに依存しない細胞増殖を促進し、代謝ストレスへの抵抗性をもたらす、がん細胞の代謝再構成におけるホスホエノールピルビン酸カルボキシキナーゼ(PCK2)の役割を明らかにしている。
この論文は2015年発行であるため、新しい発見と言えます。
ホスホエノールピルビン酸カルボキシキナーゼは、糖新生で働く酵素で、今までは主に肝臓でしか研究されていなかったのですが、がん細胞では、グルコースが利用できない状況では、この酵素を使って、解糖系のホスホエノールピルビン酸を作って、TCA回路での物質合成やエネルギー産生を維持しているということです。(トップの図参照)
このように、がん細胞の代謝系は柔軟性(フレキシビリティ)があるので、代謝をターゲットにしたがん治療には限界があり、がん治療を困難にしている理由になっています。
しかし、がん細胞が環境への適応のために使うメカニズムを理解することは、がん治療への新たな可能性を高めることができます。
グルタミンは非必須アミノ酸で、体内で合成されますが、がん細胞の代謝において極めて重要な役割を担っています。
ホスホエノールピルビン酸カルボキシキナーゼ(phosphoenolpyruvate carboxykinase:PEPCK)は、オキサロ酢酸を脱炭酸してホスホエノールピルビン酸を合成する酵素で、解糖の逆反応を行い糖新生に関与します。
がん細胞では、グルコースは主に解糖系で消費され、TCA回路にはあまり利用されません。このような状況で、グルタミンがαケトグルタル酸に変換されてTCA回路での代謝を維持しています。
がん細胞では、グルコースの代謝は解糖系が亢進していますが、ミトコンドリアのTCA回路が働いていないわけではありません。
TCA回路はアミノ酸や核酸や脂肪酸などの物質代謝の中心です。したがって、TCA回路が全く働かない場合は、がん細胞の増殖と生存も維持できません。
グルタミンはがん細胞の増殖と生存に、グルコースに次いで重要な栄養素であると認識されています。
【逆向きTCA回路(reverse TCA cycle)による脂肪酸合成】
正常細胞では、TCA回路(クエン酸回路、クレブス回路)は下図のように時計回りで反応が進行します。
TCA回路で産生されるクエン酸は細胞質に出てATPクエン酸リアーゼでアセチルCoAに変換されて脂肪酸合成に使用されます。
ある種の急激に増殖する腫瘍のミトコンドリアでは、通常の「時計回り」のTCA回路に加えて、逆の向きの「反時計回り」の還元的カルボキシル化(reductive carboxylation)という経路が生じています。
グルタミン由来のαケトグルタル酸の酸化的代謝はコハク酸を産生しTCA回路を順行性に回します。αケトグルタル酸のイソクエン酸脱水素酵素(isocitrate dehydrogenase)による還元的代謝はTCA回路のクエン酸を増やします。
低酸素で増殖するがん細胞は、ミトコンドリア依存性の脂肪酸合成をバイパスするために還元的グルタミン代謝を使うことが報告されています。
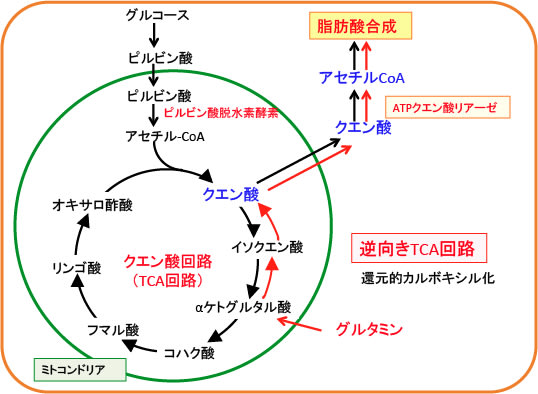
図:TCA回路で産生されるクエン酸は細胞質に出てATPクエン酸リアーゼでアセチルCoAに変換されて脂肪酸合成に使用される。急激に増殖する腫瘍のミトコンドリアでは、TCA回路の順行性の代謝に加えて、グルタミン由来のαケトグルタル酸がイソクエン酸脱水素酵素(isocitrate dehydrogenase)による還元的代謝によってTCA回路を逆行してクエン酸を増やしている。低酸素で増殖するがん細胞は、ミトコンドリア依存性の脂肪酸合成をバイパスするために還元的グルタミン代謝を使うことが報告されている。
以上のように、グルコースの取込みや解糖系を阻害しても、がん細胞はグルタミンを利用して、エネルギー産生や物質合成の経路を活性化して生存と増殖を維持します。
したがって、グルコースの取込みと解糖系を阻害する方法(2-デオキシグルコース、ケトン食、ジインドリルメタン、シリマリンなど;第353話参照)にグルタミンの利用を阻害する方法を併用すると抗腫瘍効果を高めることができます。
糖尿病治療薬のメトホルミンはミトコンドリアにおけるグルコースとグルタミンの利用を阻害することが報告されています。(詳細は次回)
| « 488)ミトコン... | 490)メトホル... » |



