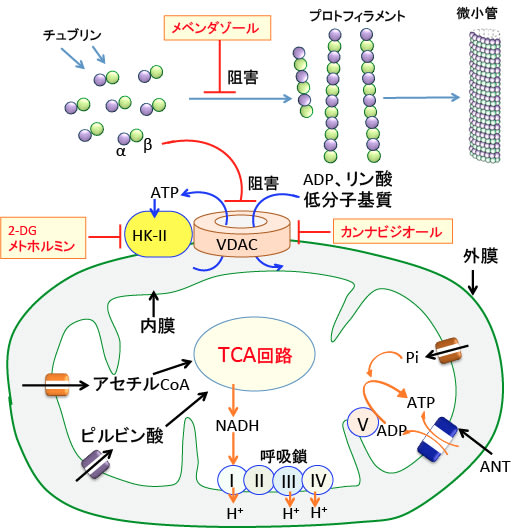
図:ミトコンドリアには内膜と外膜の2つの生体膜があり、物質はこの膜を通過して細胞質とミトコンドリア・マトリックスを行き来する。内膜にはアセチルCoAやピルビン酸や無機リン(Pi)やADPやATPなどが通過するための特異なタンパク質(トランスポーターやチャネル)がある。ミトコンドリア外膜では、多くの物質はVDAC(Voltage-dependent anion channel:電位依存性陰イオンチャネル)を使って通過する。VDACはミトコンドリアと細胞質の間の代謝物質の輸送を制御し、細胞のエネルギー産生ひいては生存に必須の働きを行っているので、VDACの働きを阻害するとがん細胞の増殖を抑制しアポトーシスを誘導できる。メベンダゾールで微小管の重合を阻止するとフリーのチュブリンダイマーがVDACの働きを阻害する。大麻成分のカンナビジオールがVDACを阻害することが報告されている。さらに、VDACはがん細胞で解糖系を促進する律速酵素のヘキソキナーッゼ-IIと結合し、解糖系の亢進(ワールブルグ効果)にも関与している。ヘキソキナーゼ-II活性は2—デオキシグルコース(2DG)やメトホルミンで阻害できる。つまり、VDAC-1とヘキソキナーゼ-IIをターゲットにしたがん治療が注目されており、この目的でメベンダゾール、2-デオキシグルコース(2-DG)、メトホルミン、カンナビジオールは相乗効果が期待でき、がん細胞の増殖抑制効果を高めることが期待できる。
414)VDAC-1とチュブリンとカンナビジオール
【VDAC-1の働きを阻害するとがん細胞の増殖がストップする】
がんや様々な神経疾患など多くの病気の発生にミトコンドリアの異常が関与しています。とくにVDAC(電位依存性陰イオンチャネル)の異常が多くの病気の発生に関わっていることが最近明らかになっています。
ミトコンドリアには外膜と内膜があり、内膜の内側がミトコンドリア・マトリックス、外膜と内膜の間を膜間腔と言います。
細胞質とミトコンドリア・マトリックスの間の物質や水の行き来は、外膜と内膜に存在するチャネルやトランスポーターと呼ばれるタンパク質によって制御されています。
TCA回路で代謝されるアセチルCoAやピリピン酸やATP産生に使われるADPやリン酸は、内膜ではそれぞれ固有のトランスポーターやチャネルを使って膜を通過します。
一方、外膜では多くの物質はVDAC(Voltage-dependent anion channel:電位依存性陰イオンチャネル)を使って通過します(下図)。
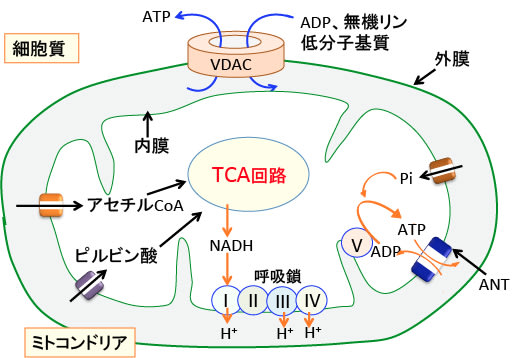
図:ミトコンドリアの内膜にはアセチルCoAやピルビン酸や無機リン(Pi)やADP(アデノシン2リン酸)やATP(アデノシン3リン酸)などが通過するための特異なタンパク質(トランスポーターやチャネル)がある。ATPとADPは内膜ではANT(Adenine Nucleotide Transporter)によって通過する。ミトコンドリア外膜では、ADPやATPや無機リンや低分子物質はVDAC(Voltage-dependent anion channel:電位依存性陰イオンチャネル)を使って通過する。
このようにVDACはミトコンドリア外膜に存在する最も重要なチャネル蛋白質であり、ミトコンドリアと細胞質の間の代謝物質の輸送を制御し、細胞のエネルギー産生ひいては生存に必須の働きを行っている。(J Pharmacol Exp Ther. 342(3): 637–641. 2012年のFig.1を改変)
つまり、VDACは細胞質とミトコンドリアの間の代謝産物やエネルギー(ATP)やイオンなどを通過させるゲートで、ミトコンドリア・ポリン(mitochondrial porin)とも呼ばれています。
細胞の生存だけでなくアポトーシス(細胞死)の制御にも重要な働きをしています。すなわち、VDACはチトクロームCの通過やBCL-2ファミリー蛋白質との相互作用を制御することによってアポトーシスを制御しています。
したがって、がん治療においても、VDACは重要なターゲットになっています。
VDACには1から3まで3種類のアイソフォームがあり、分子量は30~35KDaでそれぞれ70%の類似性(homology)があります。
多くのがん細胞でVDAC-1の発現が亢進しており、VDAC-1の発現を阻害するとがん細胞の増殖が停止することが明らかになっています。
【チュブリンダイマーはVDACの働きを阻害する】
微小管は細胞骨格を形成する蛋白質であり, チュブリンというタンパク質が集まった長い直径約25nmの管状構造をもっています。
細胞分裂する際に、複製されたDNAは染色体と呼ばれる構造に凝集し、細胞の両極へと引き寄せられ、等分されますが、このとき染色体を分裂した2つの細胞に分離する働きをするのが微小管です。
微小管はαチュブリンとβチュブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成されています。
チュブリンから微小管が形成される過程を重合、微小管がチューブリンに戻る過程を脱重合といいます。この重合や脱重合の過程を阻害すると細胞分裂を阻害することになるので、微小管阻害剤が抗がん剤として多く開発されています。
図:微小管はαチュブリンとβチュブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成され、チュブリンのヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び、これが13本集まって管状の構造(直径25nm)を取ったものが微小管となる。細胞分裂が行われる際、細胞の中ではDNAが複製され、複製されたDNAは微小管によって引き寄せられ、分裂後のそれぞれの細胞に分けらる。微小管の重合を阻害すると、細胞分裂のM期を停止させてアポトーシスを起こす。
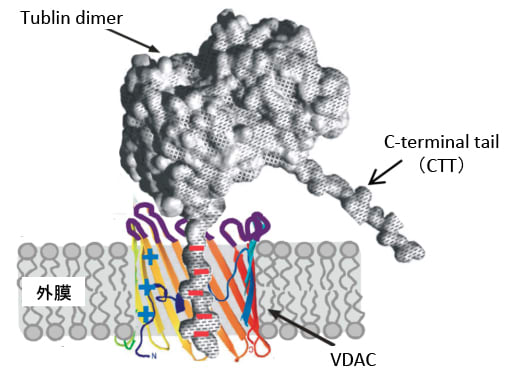
最近の研究で、チュブリン・ダイマーのC末端のTail状の構造がVDACの内腔を塞いでVDACを介して行われる物質の移動を阻害して、エネルギー産生や物質代謝におけるミトコンドリアの働きを阻害することが知られています。(下図)
図:ミトコンドリア外膜に存在するVDAC(電位依存性陰イオンチャネル)の内腔をチュブリンダイマーのC-terminal tailが防いで、ミトコンドリアの働きを阻害する。(Biochim Biophys Acta. 1818(6): 1526–1535. 2012年のFigure 3を改変)
例えば、コルヒチンでチュブリンの重合を阻害すると、細胞内でフリーのチュブリンダイマーが増えて、ミトコンドリアのVDACを塞いで、エネルギー産生が低下することが報告されています。
コルヒチンと同じようにコルヒチン結合ドメインに作用してチュブリンの重合を阻害する薬として
メベンダゾールや
ノスカピンがあります。(
401話参照)
【がん細胞ではヘキソキナーゼ-IIの発現と活性が亢進している】
がん細胞では、グルコースの取込みと解糖系が亢進しているのが特徴で、これをワールブルグ効果と言います。
このワールブルグ効果を是正すること、すなわちグルコースの取込みと解糖系の亢進を抑制することは、がん細胞の増殖の抑制につながることになります。
がん細胞におけるワールブルグ効果の成立には様々な因子やタンパク質が関与していますが、これらはがん治療のターゲットとして研究されています。
その一つがヘキソキナーゼ-IIです。
ヘキソキナーゼはグルコーストランスポーターを介して細胞内に取り込んだグルコース(ブドウ糖)の6位の水酸基をATP(アデノシン3リン酸)を使ってグルコース-6リン酸に変換する酵素です(下図)。

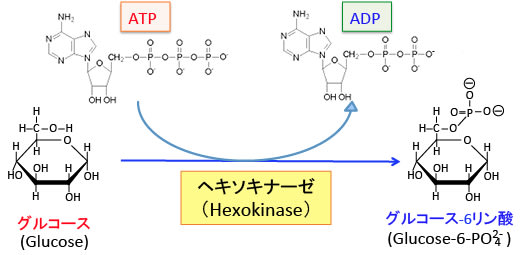
グルコースはグルコース・トランスポーターを通過できますが、リン酸化されてグルコース-6リン酸になるとグルコース・トランスポーターを通過できません。
つまり、細胞内に入ってきたグルコースを細胞内に停めておき、そのから先の代謝に進めるための最初のステップに働く酵素です。解糖系の律速酵素の一つです。
グルコース-6リン酸は、解糖系で代謝されてピルビン酸になり、さらにミトコンドリアで代謝されてATP産生に使用されます。また、ペントース・リン酸経路などでNADPHや核酸などの産生に使われます。
ヘキソキナーゼにはIからIVの4種類のアイソフォーム(基本的な機能に関連するアミノ酸残基は共通しているが、他の部分の アミノ酸配列は異なるタンパク質)があります。
このうち、がん細胞ではヘキソキナーゼ-IIが多く発現しているのが特徴です。
つまり、がん細胞ではヘキソキナーゼ-IIの発現と活性が亢進している結果、解糖系が亢進し、細胞分裂に必要なエネルギー産生と物質合成が亢進しているのです。
したがって、ヘキソキナーゼ-IIの発現を抑制したり、ヘキソキナーゼ-IIの活性を阻害すると、がん細胞で亢進している解糖系を抑制してがん細胞の増殖を抑えることができます。
ヘキソキナーゼ-IIは低酸素誘導因子—1(HIF-1)によって発現が誘導されるので、HIF-1の活性を阻害する方法(ラパマイシン、ジインドリルメタン、シリマリンなど;
364話参照)やヘキソキナーゼを阻害する2-デオキシグルコースやメトホルミン(
368話参照)を用いれば、がん細胞の解糖系を阻害することができます。
【がん細胞ではヘキソキナーゼ-IIがVDAC-1と結合している】
VDAC-1(Voltage-dependent anion channel-1:電位依存性陰イオンチャネル-1)はミトコンドリア外膜に存在するチャネル蛋白質で、ミトコンドリアと細胞質の間の代謝物質の輸送を制御し、細胞のエネルギー産生やアポトーシス(細胞死)の制御に重要な役割を担っています。
チャネル(channel)というのは細胞の生体膜(細胞膜や内膜など)にある膜貫通タンパク質の一種で、イオンや低分子物質を透過させるタンパク質の総称です。生体膜は脂質でできているため、水溶性の物質は生体膜を貫通できません。このような水溶性の低分子の物質を通過させる穴のような構造をしたタンパク質がチャネルです。
特にがん細胞においては、VDAC-1に解糖系酵素のヘキソキナーゼ-IIが結合して、低酸素環境下でも発育できる特殊なエネルギー代謝系(解糖系の亢進)を確立しています。
すなわち、がん細胞ではヘキソキナーゼ-IIが過剰に発現しており、ミトコンドリア外膜のVDAC-1に結合し、グルコースからグルコース-6リン酸への変換を促進しています。
ミトコンドリアのマトリックスのATP合成酵素はアデニン・ヌクレオチド輸送体や無機リン酸輸送体と複合体を形成し、ミトコンドリアで産生したATPをVDAC-1に結合したヘキソキナーゼーIIへ直接送り込み、ヘキソキンーゼ-IIはこのATPを使って、グルコースをリン酸化しています。
がん細胞において、増殖能を維持するためには、このヘキソキナーゼ-IIとVDAC-1の結合が重要であり、この結合が阻害されると、グルコース代謝によるがん細胞のエネルギー産生と物質合成が阻害されます(下図)。
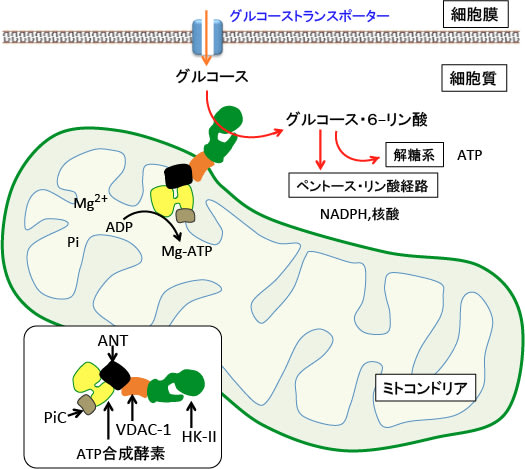
図:細胞膜のグルコース・トランスポーターを通って細胞内に取込まれたグルコースは、ヘキソキナーゼ-II(HK-II)によってリン酸化されグルコース・6リン酸に変換される。
リン酸基がつくとグルコース・トランスポーターを通過できないので、細胞内に保持されてさらに解糖系やペントース・リン経路で代謝され、ATPやNHDPHや核酸の産生に使われる。ヘキソキナーゼーIIはミトコンドリアの外膜に存在するVDAC-1(Voltage-dependent anion channel-1:電位依存性陰イオンチャネル-1)に結合している。
ATP合成酵素はANT(adenine nucleotide translocator:アデニン・ヌクレオチド輸送体)とPiC(inorganic phosphate carrier:無機リン酸輸送体)と複合体を形成し、ミトコンドリアで産生したATPをVDAC-1に結合したヘキソキナーゼーIIへ直接送り込む。ヘキソキンーゼ-IIはこのATPを使って、グルコースをリン酸化する。
がん細胞において増殖能を維持するためには、このヘキソキナーゼ-IIとVDAC-1の結合が重要であり、この結合が阻害されると、グルコース代謝によるがん細胞のエネルギー産生と物質合成が阻害される。(Semin Cancer Biol. 19(1): 17–24. 2009年のFig.1を改変)
【カンナビジオールはVDACを制御する】
大麻成分のカンナビジオールがVDAC-1の働きを阻害することが報告されています。以下のような報告があります。
Direct modulation of the outer mitochondrial membrane channel, voltage-dependent anion channel 1 (VDAC1) by cannabidiol: a novel mechanism for cannabinoid-induced cell death. (カンナビジオールによるミトコンドリア外膜チャネル、電位依存性陰イオンチャネル1(VDAC1)の直接的制御)Cell Death and Disease (2013) 4, e949; doi:10.1038/cddis.2013.471
【要旨】
カンナビジオールは精神変容作用のない植物カンナビノイドの一種であり、がん細胞や活性化した免疫細胞の増殖を阻害し細胞死を誘導する。古典的なカンナビノイド受容体であるCB1とCB2のアゴニスト(作動薬)ではなく、その作用機序については十分に解明されていない。
この研究においては、BV-2ミクログリア細胞を用いて、種々のミトコンドリア機能に対するカンナビジオールの効果を検討した。
その結果、カンナビジオール投与によって、細胞内カルシウムは2相性に上昇し、ミトコンドリアの機能と形態が変化し、細胞死が誘導された。
種々の解析の結果、細胞内においてカンナビジオールがミトコンドリアのタンパク質と共存(同じ場所に存在)していることが示された。
さらに、カンナビジオールはミトコンドリアの外膜に存在して、エネルギー産生や物質代謝の恒常性やアポトーシスの制御に重要な働きをしているタンパク質の電位依存性陰イオンチャネル1(VDAC1)の伝導性(channel conductance)を顕著に低下させた。
さらに、カンナビジオールとVDAC1は直接的に相互作用を行っていることが示された。
以上のことから、VDAC1はカンナビジオールのミトコンドリアにおける新規のターゲット物質となっていることが示され、このカンナビジオールによるVDAC1の阻害が、カンナビジオールの免疫抑制作用と抗がん作用のメカニズムに関与している可能性が示唆された。
糖尿病、がん、関節リュウマチ、多発性硬化症などの動物実験モデルにおける検討で、カンナビジオールには単独で強い抗炎症作用と免疫抑制作用が認められています。
さらに、カンナビジオールには抗不安作用や吐き気止め(抗悪心・抗嘔吐作用)や抗精神病作用があることが報告されています。
さらに、様々な動物実験系で、カンナビジオールによるがん組織の縮小や転移抑制の作用が報告されています。
カンナビジオールは古典的カンナビノイド受容体のCB1とCB2には作用しない(アゴニストにならない)ので、テトラヒドロカンナビジオールのような精神変容作用は示しません。
カンナビジオールのターゲット分子として様々な受容体やタンパク質が報告されています。例えば、GPR55, GPR18, セロトニン受容体の5-HT1A、Ca透過性の陽イオンチャネルの一種であるtransient receptor potentialvchannelsのTRPV1, TRPV2, TRPM8, TRPA1、ペルオキシソーム増殖因子活性化受容体γ(Peroxisome proliferator-activated receptor γ:PPARγ)などが報告されています。(
412話参照)
カンナビジオールは神経細胞の傷害に対しては細胞保護的に作用しますが、がん細胞や活性化された幾つかの免疫細胞に対しては細胞死を誘導する作用があります。
がん細胞においては、カンナビジオール投与によってミトコンドリアの膜透過性が亢進し、活性酸素の産生が増え、アポトーシスが誘導されることが報告されています。(
410話、)
前述したように、VDAC1 はミトコンドリアの外膜に存在する多機能性のチャネルで、ミトコンドリアと細胞質の間での代謝産物の移動を制御することによって細胞のエネルギー産生と物質代謝の調節において中心的な役割を担っています。
さらに、VDAC1はアポトーシスを実行する際に重要なタンパク質(チトクロームC、apoptosis-inducing factor など)をミトコンドリアから細胞質に放出する役割を担い、アポトーシスを制御するタンパク質(ヘキソキナーゼ、Bcl-2ファミリーなど)と相互作用することによってアポトーシスの制御に中心的な役割を担っています。
VDAC1は膜電位が低い状態(-20~20mV)ではチャネルは開いた状態で高伝導性を示します。
一方、膜電位が高い状態(higher positive and negative potential)ではチャネルの伝導性は低下し、ADPやATPのような高分子はミトコンドリア膜を通過できなくなります。
VDAC-1機能の障害でミトコンドリアの膜透過性が低下すると、細胞はエネルギー産生ができず、細胞は死ぬことになります。
したがって、がん細胞におけるVDAC1チャネルの伝導性(conductance)を阻害することは新規のがん治療の開発のターゲットとなっています。
この論文では、カンナビジオールがミトコンドリアのVDAC1と直接相互作用することによってVDAC1の機能を阻害(VDAC1の伝導性を低下)して、ミトコンドリア機能を障害することを報告しています。
この作用ががん細胞や活性化した免疫細胞の増殖を抑制し、細胞死(アポトーシス)を誘導することによって抗がん作用や免疫抑制作用を示すという結果です。これが様々ながんや自己免疫疾患や炎症性疾患に対するカンナビジオールの作用メカニズムの一つの可能性があるという論文です。
ただし、この作用メカニズムは培養細胞を使った実験であるため、人体でこのような作用が期待できるかどうかは不明です。
しかし、ミトコンドリアの外膜の伝導性(透過性)を阻害して細胞質とミトコンドリアの間の物質の交流を阻害し、一方でミトコンドリア内での活性酸素の産生を高めて、がん細胞を自滅に追い込むという方法はがん細胞を死滅させる方法として有望です。
解糖系を阻害する
2−デオキシグルコース(
381話参照)、TCA回路と電子伝達系を活性化する
ジクロロ酢酸ナトリウム(
366話参照)、呼吸酵素とヘキソキナーゼ-IIを阻害する
メトホルミン(
384話参照)、チュブリンの重合を阻害してチュブリンダイマーによるVDAC-1を阻害する可能性が示唆される
メベンダゾール(
401話参照)や
ノスカピン、VDAC-1を阻害する
カンナビジオールの併用は理論的には相乗効果が期待できそうです。
さらに、低酸素誘導因子—1(HIF-1)の活性を阻害する方法(ラパマイシン、ジインドリルメタン、シリマリンなど;
364話参照)の併用も有用です。
エネルギー産生や物質合成が亢進したがん細胞では、ミトコンドリア機能とヘキソキナーゼ-IIの働きをターゲットにすればがん細胞を死滅させることができます。進行がんの代替医療として、このような組合せを試してみる価値はあると思います。