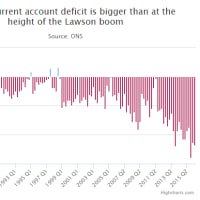
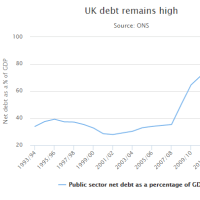
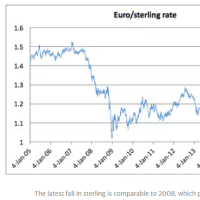
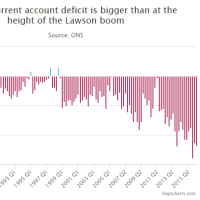
Faulty medical implants investigation: 'We can help you label it European so China is not on packaging'
(欠陥インプラント捜査:「パッケージに中国製と表示されないように、欧州製と偽装表示するのを手伝えるよ」)
By Claire Newell and Holly Watt
Telegraph: 9:56PM BST 23 Oct 2012
国産ウナギとかアサリとかハマグリとかのことを思い出しました。
英国では、人工股関節インプラントの医療事故が多発しまくっているらしく、OBEまでもらった英国屈指の芸能人、故ジミー・サヴィルのペド・スキャンダルと同じくらい大騒ぎであります。
ちょっと前は、不良豊胸用インプラントの医療事故が大問題になってましたっけ。
あ、誰か英国の病院に入院して手術とか言ってませんでしたっけ、日本のオーモノセージカ。
あれ嘘かなあ…。
わざわざ英国くんだりまで行って、偽装した中国製人工血管とかなんとか入れられてたら大笑いではありませんか。
いや、セージカさん的には名誉なことなの?
しかし40代でヒップリプレースメント手術とか、英国人はいったいどうなってるんでしょう???




(欠陥インプラント捜査:「パッケージに中国製と表示されないように、欧州製と偽装表示するのを手伝えるよ」)
By Claire Newell and Holly Watt
Telegraph: 9:56PM BST 23 Oct 2012
Firm tells reporters posing as representatives of hip implant maker how to bend the law.
人工股関節インプラントのメーカーの人間を装った記者に、この会社は法をかいくぐる方法を教えてくれました。
For the female executive from the Hungarian firm which is authorised to approve medical devices throughout Europe, the brochure outlining a proposal for a new “metal-on-metal” hip implant should have rung alarm bells.
ヨーロッパ全域で医療機器の承認を行う権限を持つハンガリー企業の女性幹部に、新しい「メタル・オン・メタル」の人工股関節インプラントを提案するパンフレットは、警戒感を呼ぶはずでした。
The two people purporting to be executives from a Chinese firm called “Changi” should politely have been told that such a product could be risky and certification might be a problem.
『Changi』という中国企業の幹部を装った2人は、そのような製品は危険性があり、承認するには問題があるかも知れない、と礼儀正しく告げられるはずでした。
But Anna Szabo, an executive at SGS in Budapest, offered advice on how to “market” the questionable product to unsuspecting patients in Britain and elsewhere. While the product would still need approval, Ms Szabo said: “What we suggest is that you make a certification so that the, on the product itself, the label would be from a Hung- … European country and therefore the Chinese producer will not be on the packaging.”
しかし、ブダペストにあるSGSの幹部、アンナ・ジャーボ氏は、英国などで何も知らない患者に疑わしい製品を「販売する」方法についてアドバイスをくれました。
それでも問題の製品は承認が必要なのですが、ジャーボ氏はこう言いました。
「あなたが製品そのものを承認するというのはどうでしょう。そうすればレベルはハンガ…ヨーロッパの国の製品だと表示されますし、そうすれば、中国のメーカーだということはパッケージに書かれません」
“Why is that a good idea?” asked the person Ms Szabo thought was representing a potentially lucrative client from a Chinese firm, but was, in fact, an undercover reporter from The Daily Telegraph.
「何故それが名案なのですか?」
ジャーボ氏は、金になる中国企業クライアントの人間だと考えていましたが、実は小紙の覆面記者は尋ねました。
“This is better from a marketing point of view,” the SGS executive replied. Ms Szabo said they could find someone in Hungary to represent the Chinese company. “The point would be on the packaging of the things … is much better if you have a European kind of origin country,” she said. “It’s much more of a paperwork kind of thing,” she said.
「この方がマーケティング的に良いのです」と彼女は答えました。
そして、この中国企業を代表する人間をハンガリー国内で見つけられる、と言いました
「ポイントはパッケージの記載事項です。生産国はヨーロッパの国の方が遥かに良いのです」
「書類の関係ですよ」
The executive assured the reporters that the Chinese company would not have to set up a company in Europe. “Either we find somebody or you can do it on your own. That’s no problem,” she said.
ジャーボ氏は記者に、ヨーロッパに会社を立ち上げる必要がないことを保証しました。
「我々が誰かを見つけるか、あなた方で見つけられるかです。それは問題ではありません」と彼女は言いました。
The advice was offered in a follow-up telephone call after a meeting with Ms Szabo at an office block in Budapest.
ブダペストにあるオフィスでジャーボ女史と会った後にかけた、フォローアップの電話でも、彼女は同じアドバイスをしました。
SGS is one of over 70 notified bodies in the EU which are able to hand out the coveted CE marking ― the official licence.
SGSは、EU域内に70以上ある、誰もが欲しがるCEマーク(公式ライセンス)を承認する団体の一つです。
In an increasingly cut-throat business, the regulatory organisations which are supposed to safeguard patients, appear to be aggressively competing to win business from dozens of medical device companies. They are not supposed to offer consultancy to companies seeking regulatory approval, but some notified bodies charged with issuing licences appear to take a relaxed view towards the rules.
ビジネスの厳しさが増す中で、患者を護るはずの規制組織は、数十社に上る医療機器メーカーからビジネスを獲得しようと、積極的に競争しているようです。
これらの既成組織は規制当局の承認を求める企業の相談に乗ってはいけないことになっていますが、ライセンス発行料を徴収する一部の公認機関は、この規則を厳しく捉えていないようです。
It is difficult to find out where products have been approved within the EU ― and which may have been made abroad – but the issue of devices being “relabelled” came up repeatedly as The Daily Telegraph visited notified bodies in Europe.
EUのどこで製品が承認されたのか(また、海外で製造された可能性のある製品)を特定するのは困難です。
しかし、小紙記者がヨーロッパの複数の公認機関を訪れる中で、医療機器の「偽装」問題は繰り返し出てきました。
At EVPU, a notified body in Slovakia, its representatives said it was easy to establish a “representative” in Britain and then label the products as British-made.
スロバキアの公認機関、EVPUでは、英国に「代表者」を立てて、製品を英国製と偽装するのは簡単だと告げられました。
“You can make some company in England and then sell this product are produced in England,” said Peter Luley, an EVPU employee. “It works, it works, and it is normally done by many company.” The representatives said that under these rules, the manufacturer is seen as being British. They said this was “standard procedure”.
「英国内に会社を立ち上げて、製品を英国製として販売することは可能です」とEVPUの従業員、Peter Luley氏は言いました。
「上手く行きます、上手く行きますって。それに、沢山の会社が普通にやっていることですよ」
これらの規則の下では、メーカーは英国メーカーだとみなされるのだ、とLuley氏は言いました。
これは「標準手順」だと言ったのです。
As one EVPU representative said: “It’s very hard to find the products that is from India, because exist OBL procedure, this own brand labelling. And we have lots of customers from the UK, which buy the product from India manufacturer and put on his own label.”
EVPUの従業員の一人はこう言いました。
「インド製品を発見するのはとても難しいが、これはOBL、Own Brand Labellingという手続きのせいです。それに、インドのメーカーから製品を買って自社ラベルを貼るお客様、英国にも沢山います」
An undercover reporter asks: “Their own name on it?” to which the representative replies: “He is the legal manufacturer …This is allowed by the medical directive [the European Union rules].” The EVPU executives admitted this made the approval procedure opaque. “So it makes some problem to find original manufacturer of some devices,” one said.
覆面記者はこう尋ねました。
「彼らは自社名のラベルを貼るんですか?」
するとこの従業員は答えました。
「彼が法律上の製造業者なのです。これは医療機器(に関するEU規則)で認められています」
EVPUの幹部は、このせいで承認手続きが曖昧になっていると認めました。
「というわけで、一部の医療機器のそもそものメーカーを知るのはやや難しくなっているわけです」
The representative then added: “Used for Indian manufacturer or for the distribution of the product to European Union, because if you see on some products 'Made in India’, 'Made in China’, [it is] “urgh”. 'Made in UK’, in Germany or Switzerland,” she said.
同氏は続けてこう言いました。
「インドのメーカーや、EUで製品を流通させるために用いられています。製品が『インド製』、『中国製』と書いてあると『オエー』となる製品はありますからね。『英国製』か『ドイツ製』か『スイス製』ですよ」と彼女は言いました。
At ITC, a notified body in the Czech Republic, a representative said Asian and Indian companies liked operating in this way, because consumers believed the products were manufactured in Europe.
チェコ共和国の公認機関、ITCでは、消費者は製品がヨーロッパ製だと思うので、アジア企業やインド企業はこのような方法を取ることを好む、と告げられました。
EVPU declined to comment.
EVPUはノー・コメントでした。
A spokesman for SGS said the company was “confident that the technical review process would have highlighted the dangerous nature of the products described and SGS would have declined to issue a proposal.” The spokesman said it discussed OBL manufacture because it was “the duty of the notified body to understand the basis and requirements of potential clients and to advise them on the features of each option”.
SGSの広報担当者いわく、同社は「技術的なレビュー・プロセスはそのような製品の危険を浮き彫りにしたはずであり、SGSは提案を出すことを断ったはずだと確信している」そうです。
同担当者によれば、「潜在的クライアントの基礎と要件を理解し、各オプションの特徴を助言することは公認機関の義務」なので、同社はOBLメーカーと話し合ったのだとか。
A spokesman for ITC said: “As an EU notified body we comply in full accordance with the law.”
ITCの広報担当者は「EUの公認機関として我々は100%法律を遵守している」と言いました。
Turkish admission: approval of medical devices is a 'money-making business’
トルコは、医療機器の承認は「儲かる商売」だと認めました。
An executive at a Turkish regulatory body has admitted that the process for approving medical devices is a “money-making business”.
トルコの某規制機関の幹部は、医療機器の承認手続きは「儲かる商売」だと認めました。
Teoman Alpay, an executive at Kalitest, suggested that some regulatory bodies loosen the “requirements” for licensing an artificial hip by implementing a less rigorous approach towards European requirements. Turkey, which is not a member of the European Union, has been allowed to approve medical devices for sale in the single market since 2009.
一部の規制機関は、ヨーロッパの要件をこれまでほど厳しく守らないようにて、人工股関節インプラントの承認「要件」を緩めた、Kalitest社の幹部、Teoman Alpay氏は述べました。
In a meeting with people purporting to be from a Chinese firm seeking approval for a metal-on-metal hip implant, Mr Alpay said: “This is a money-making business.”
メタル・オン・メタルの人工股関節インプラントの承認を求める中国企業の社員を装った小紙記者との会合で、Alpay氏は「これは儲かる商売です」と言いました。
He added: “If you want to be a little bit further among your competitors, you should just decrease your requirements and in this business, decreasing the requirements means not fulfilling the requirements of MDD [Medical Devices Directive].” Mr Alpay said that it was true that some notified bodies did not comply, but they were not based in Turkey.
そしてこう続けました。
「競合を少しでも出し抜きたいのなら、要件を減らすべきです。この商売では、要件を減らすこと、イコール、MDDの要件を満たさないことではありません」
一部の公認機関が遵守していないというのは本当だが、トルコの機関ではない、とAlpay氏は言いました。
At Alberk, a notified body in Turkey located above a car mechanics in Istanbul, an executive also indicated he was prepared to overlook “minor” problems when considering a product for a licence. Kadir Tarakci said: “Small points is nothing for us because everyone has [omissions]. Everybody, trust me, everybody.”
イスタンブールの自動車修理工場の上にある、トルコの公認機関、Alberk社でも幹部が、ライセンス発行を検討する際は「些細な」問題は見逃すつもりだとほのめかしました。
「些細なポイントは我々にとって無意味です。というのも、誰だって(手落ちは)ありますからね。誰だってですよ、本当に、誰だってです」とKadir Tarakci氏は言いました。
Both firms said the executives who made the comments have since left the companies.
両社とも、上記のコメントした幹部は会社を辞めたと言っています。
The comments from the two Turkish firms appear to highlight a problem with the system where competing regulatory bodies in Europe aggressively market their services to potential clients.
トルコ企業2社のコメントは、ヨーロッパの競争する規制機関が潜在的クライアントに自分達のサービスを積極的に売り込む、という制度の問題を浮き彫りにしたようです。
国産ウナギとかアサリとかハマグリとかのことを思い出しました。
英国では、人工股関節インプラントの医療事故が多発しまくっているらしく、OBEまでもらった英国屈指の芸能人、故ジミー・サヴィルのペド・スキャンダルと同じくらい大騒ぎであります。
ちょっと前は、不良豊胸用インプラントの医療事故が大問題になってましたっけ。
あ、誰か英国の病院に入院して手術とか言ってませんでしたっけ、日本のオーモノセージカ。
あれ嘘かなあ…。
わざわざ英国くんだりまで行って、偽装した中国製人工血管とかなんとか入れられてたら大笑いではありませんか。
いや、セージカさん的には名誉なことなの?
しかし40代でヒップリプレースメント手術とか、英国人はいったいどうなってるんでしょう???