高難度の手術をhigh volume centerに集中させることで手術成績を向上させるというのは非常に合理的な方向性だと思います。しかしアメリカでも” For some procedures targeted by these initiatives, there are too few high-volume hospitals.”というような状態だと、日本だと条件を満たす病院はさらに少なくなると思われます。また"Although many studies have demonstrated an association between higher surgical volume and better perioperative outcomes, the underlying mechanisms remain unclear. "とあるように、high volume centerで手術成績がよい真の理由は不明だというのも、確かにそうだろうなと思います。術者の技量だけではなく、病院の設備、術後ケアの手厚さ、リスクマネジメントなど、手術成績にはhigh volumeというだけでは語れない部分も多く、low volumeでも大変よい成績を残している病院も(特に日本では)たくさんあります。また高難度手術を集中させるのであれば、その分その病院への人的配置や診療報酬は手厚くしてあげないと、働いている医療従事者は燃え尽きてしまいます。このあたりは民間保険が中心のアメリカの方が病院間の格差をつけやすいかもしれません。患者の病院へのアクセスをどのように確保するかは、日本人の大好きな「治療機会の平等」のためには重要でしょう。ということで色々と問題はありそうですが、手術を受ける側としてはhigh volume centerで受けたいという希望も強いでしょうから、是非日本でも(厚生労働省には)前向きに検討してもらいたいです。
MedScapeでも紹介されていましたので、読んだ方も多いかと思います。デノスマブ(Dmab)投与中断後に急速な骨代謝マーカー上昇および骨密度低下が生じ、多発椎体骨折を生じる患者がいることが知られており、中断後にはビスホスホネート投与が推奨されていますが、その有効性について最近いくつかのグループから報告がなされています(Reid 2017; Lehman 2017; Horne 2018; Everts-Graber 2020; Anastasilakis 2019)が、骨密度維持効果や投与のタイミングなどについて、必ずしも一定した見解は示せていません。この論文は、59名のDmab中断患者を中断6カ月後(6M group)、9カ月後(9M group)、骨代謝マーカー上昇時(OBS group)にゾレドロン酸(ZOL)投与群にランダムに割り付け、投与後12カ月までの骨密度の変化などを検討したものです。
(結果)ZOL投与から6カ月後の腰椎骨密度の減少は、6M, 9M, OBS groupそれぞれで2.1 ± 0.9% (mean ± SEM), 4.3 ± 1.1%, 3.0 ± 1.1%、12カ月後は4.8 ± 0.7%, 4.1 ± 1.1%, 4.7 ± 1.2% であり、各群とも有意に減少しており、群間の有意差はありませんでした。ZOL投与後6カ月目の大腿骨頚部の骨密度低下は6M groupで有意に少なかったものの(1.3% vs 4.2% vs 2.7%)、12カ月後には群間差はなくなりました(3.0% vs 4.5% vs 4.6%)。骨代謝マーカーについては6 M groupでp-cross-linked C-terminal telopeptide (p‐CTX)が投与1カ月後に低下した以外はいずれのグループも骨形成・骨吸収マーカーともに急速な上昇が見られました。骨折は4例に見られ、それぞれ上腕骨骨折(高エネルギー外傷, 6M group, ZOL投与9カ月後)、肋骨骨折(低エネルギー外傷, OBS group ZOL投与10カ月後)、臨床L1骨折(低エネルギー骨折, 9M group, ZOL投与9カ月時)、臨床 L1骨折(低エネルギー骨折, 9M group, ZOL投与9カ月時)でした。以上の結果から、Dmab中断後のZOL投与では十分な骨密度低下抑制作用は期待できないと結論しています。
(結果)ZOL投与から6カ月後の腰椎骨密度の減少は、6M, 9M, OBS groupそれぞれで2.1 ± 0.9% (mean ± SEM), 4.3 ± 1.1%, 3.0 ± 1.1%、12カ月後は4.8 ± 0.7%, 4.1 ± 1.1%, 4.7 ± 1.2% であり、各群とも有意に減少しており、群間の有意差はありませんでした。ZOL投与後6カ月目の大腿骨頚部の骨密度低下は6M groupで有意に少なかったものの(1.3% vs 4.2% vs 2.7%)、12カ月後には群間差はなくなりました(3.0% vs 4.5% vs 4.6%)。骨代謝マーカーについては6 M groupでp-cross-linked C-terminal telopeptide (p‐CTX)が投与1カ月後に低下した以外はいずれのグループも骨形成・骨吸収マーカーともに急速な上昇が見られました。骨折は4例に見られ、それぞれ上腕骨骨折(高エネルギー外傷, 6M group, ZOL投与9カ月後)、肋骨骨折(低エネルギー外傷, OBS group ZOL投与10カ月後)、臨床L1骨折(低エネルギー骨折, 9M group, ZOL投与9カ月時)、臨床 L1骨折(低エネルギー骨折, 9M group, ZOL投与9カ月時)でした。以上の結果から、Dmab中断後のZOL投与では十分な骨密度低下抑制作用は期待できないと結論しています。
Anne Sophie Sølling et al., Treatment with zoledronate subsequent to denosumab in osteoporosis: a randomized trial. J Bone Miner Res. 2020 May 27. doi: 10.1002/jbmr.4098.
日本でも新型コロナウイルス感染が拡大していた時期には予定整形外科手術が延期となっていた病院が多かったと思います。そのような場合でも大腿骨近位部骨折については緊急性があるという考えから手術を行っていた病院が多かったのではないでしょうか。この論文はCOVID-19が猖獗を極めたイタリアLombardy地方からの大腿骨近位部骨折受傷COVID-19患者についての報告です。
19人の大腿骨近位部骨折患者の平均年齢は85歳(74-90歳)で、骨折型はOTA/AO4 type 31-A1 (8 fractures; 42.1%), 31-A2 (5 fractures; 26.3%), 31-B2 (5 fractures; 26.3%), 31-B33 (1 fracture; 5.3%)でした。3人は発熱や呼吸器症状がなかったため、本studyから除外されました。残りの16人すべて熱発および酸素飽和度低下を示し、14人は補助換気が必要でした。全員胸部CT上、間質性肺炎などの肺炎像を呈していました。薬物療法としては低分子ヘパリン、ヒドロキシクロロキン(200 mg x 2/day)、アジスロマイシン(500 mg x 2/dayが投与されました。術後呼吸不全および多臓器不全(multiple-organ-failure syndrome, MOFS)のため3人が術前に死亡しました。残る13人のうち10人は入院当日(12-24時間後)、3人は抗凝固療法を中止していたため、安定後3日間手術を延期しました。手術は脊椎麻酔+神経ブロックで外側骨折はintramedullay nail(γネイル)を、内側骨折は人工骨頭を行い、平均手術時間はそれぞれ30分、50分でした。
術後呼吸不全のため4人死亡しましたが、9人は平均7日で血液動態や呼吸状態は安定しました。基本的に手術によって患者の可動性が改善し、呼吸状態にも好影響があり、全身状態も安定したということで、大腿骨近位部骨折に対する手術はCOVID-19患者に対しても推奨されると結論しています。ただし呼吸状態が非常に悪い(PO2<90%)、38度を超える発熱、全身の臓器不全を呈するなど、生命予後の悪い患者については手術の適用にならないだろうとしています。
19人の大腿骨近位部骨折患者の平均年齢は85歳(74-90歳)で、骨折型はOTA/AO4 type 31-A1 (8 fractures; 42.1%), 31-A2 (5 fractures; 26.3%), 31-B2 (5 fractures; 26.3%), 31-B33 (1 fracture; 5.3%)でした。3人は発熱や呼吸器症状がなかったため、本studyから除外されました。残りの16人すべて熱発および酸素飽和度低下を示し、14人は補助換気が必要でした。全員胸部CT上、間質性肺炎などの肺炎像を呈していました。薬物療法としては低分子ヘパリン、ヒドロキシクロロキン(200 mg x 2/day)、アジスロマイシン(500 mg x 2/dayが投与されました。術後呼吸不全および多臓器不全(multiple-organ-failure syndrome, MOFS)のため3人が術前に死亡しました。残る13人のうち10人は入院当日(12-24時間後)、3人は抗凝固療法を中止していたため、安定後3日間手術を延期しました。手術は脊椎麻酔+神経ブロックで外側骨折はintramedullay nail(γネイル)を、内側骨折は人工骨頭を行い、平均手術時間はそれぞれ30分、50分でした。
術後呼吸不全のため4人死亡しましたが、9人は平均7日で血液動態や呼吸状態は安定しました。基本的に手術によって患者の可動性が改善し、呼吸状態にも好影響があり、全身状態も安定したということで、大腿骨近位部骨折に対する手術はCOVID-19患者に対しても推奨されると結論しています。ただし呼吸状態が非常に悪い(PO2<90%)、38度を超える発熱、全身の臓器不全を呈するなど、生命予後の悪い患者については手術の適用にならないだろうとしています。

この論文で著者らは、SARS-CoV-2を感染させたVero E6細胞(アフリカグリーン猿腎由来細胞)においてウイルスおよび細胞由来のリン酸化タンパクを網羅的に解析し、タンパク―タンパク相互作用やウイルスによって活性化されている(であろう)キナーゼを同定しました。その結果casein kinase II (CK2)およびp38 MAP kinaseの活性化がサイトカイン産生および細胞周期阻害に関与していること、ウイルス感染によってCK2を含むfilopodia形成が促進され、ウイルス粒子のbuddingに関与している可能性が示されました。またウイルスによって活性化される様々なキナーゼ阻害薬がCOVID-19治療薬として有望であるとしています。
Phosphoprotein mappingを様々な時間軸で細かく行い(0, 2, 4, 8, 12, 24時間という6 points)、タンパク―タンパク相互作用を解明したり、治療標的となるキナーゼを同定したりというのは大変な作業だったとは思うのですが、コントロールに用いた"mock infection"というのは一体何なのか?これが他のコロナウイルスとは異なるSARS-CoV-2の特徴なのか?サルではなく人の細胞ではどうなのか?腎ではなく肺の細胞ではどうなのか?など、多くの疑問符を残す研究です。もちろん「文句を言うならお前がやってみろ」と言われてもできませんけど・・
ウイルス感染によってAPOH, CD9, TSPAN14, AHSG, SERPINA1, A2Mなどの血小板制御、血栓、凝固抑制に関与するタンパク発現(リン酸化ではなく)が低下するというデータはCOVID-19による血栓形成と関連して興味深かったです。
Parkinson病はモハメド・アリなどの著名人も罹患したことで有名な疾患です。脳内黒質・線条体ドパミンニューロンの変性・消失がその主病変であることが知られています。治療法としてはL-DOPAの投与が有効で、脳内でドパミンに変わり、減少しているドパミンを補い、症状を緩和します。L-DOPAは現在も第一選択薬と位置付けられていますが、長期投与によって効果の減弱やon-off現象、dyskinesiaなどが見られることが知られており、より有効性・安全性の高い新たな治療法が待たれている難病です。
これまでに様々な細胞移植療法が試みられており、ES細胞やiPS細胞にも期待がもたれています(https://www.cira.kyoto-u.ac.jp/j/press…/…/181109-120000.html)。このような試みの一つとして皮膚線維芽細胞やastrocyteを神経細胞へと分化させるという研究が進んでおり、マウスastrocyteにNEUROD1, ASCL1, LMX1AそしてmicroRNAであるmiR218を導入することによってドパミンニューロン(induced dopamin-releasing neuron, IDA neuron)に分化誘導が可能であり、その移植によって部分的にParkinson病モデルマウスの症状を改善させたことが報告されています(Rivetti di Val Cervo P et al., Nat Biotechnol. 2017 May;35(5):444-452)。しかしこのような方法の問題点は、移植したneuronが遠隔neuronと正常な脳で見られるようなネットワークを形成しないため、機能回復が部分的にとどまってしまうことです。
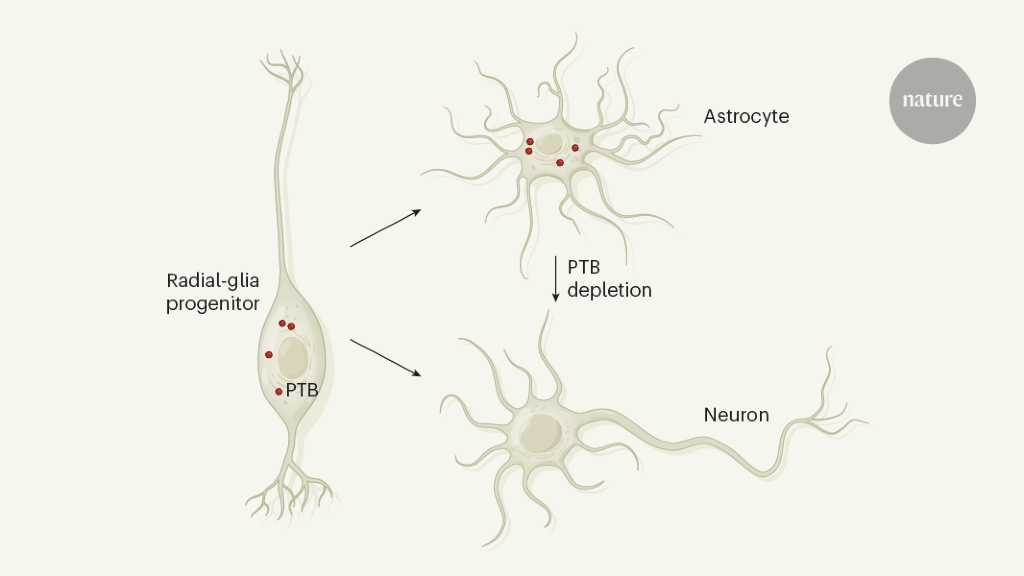
今回NatureおよびCellに発表された2つの論文は、異なるアプローチを用いて、脳に存在するastrocyteをIDA neuronに分化させるアプローチによってParkinson病の改善が可能であった、という内容です。キーになっているのはneuronへの分化を抑制的に制御するPTBという分子です。
Qianらはまずin vitroでsmall hairpin RNAを用いてRNA-binding proteinであるPTBをコードするPtbp1遺伝子を抑制することによってastrocyteをIDA neuronに分化させることが可能であることを明らかにしました。またZhouらはCRISPR-CasRxシステムを用いてPtbp1遺伝子を抑制することによって同様の結果を得ました。In vivoにおいてもQianらは黒質に存在するアストロサイト、Zhouらは線条体のアストロサイトにおけるPtbp1を抑制することでIDA neuronへと分化させることに成功しました。Ptbp1遺伝子の抑制によってIDA neuronで発現している転写因子であるLmx1a, Foxa2の発現亢進も誘導されました。興味深いことにPtbp1遺伝子の抑制は脳の様々な部位において異なる転写因子の発現を誘導し、異なるneuronへの分化を誘導することも示されました。
今後このようなアプローチが臨床的に応用可能かどうかはPtbp遺伝子をastrocyteで効率よく抑制する手法の開発にかかっています。またPTBの作用メカニズムのさらなる解明も必要でしょう。しかしこれらの研究はParkinson病の治療に新たな方向性を与える貴重なものと考えられます。
1. Qian, H. et al. Reversing a Model of Parkinson's Disease With in Situ Converted Nigral Neurons. Nature. 2020 Jun;582(7813):550-556. https://www.nature.com/articles/s41586-020-2388-4
2. Zhou, H. et al. Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice. Cell. 2020 Apr 30;181(3):590-603.e16.
https://linkinghub.elsevier.com/ret…/…/S0092-8674(20)30286-5
https://www.nature.com/articles/d41586-020-01817-4
これまでに様々な細胞移植療法が試みられており、ES細胞やiPS細胞にも期待がもたれています(https://www.cira.kyoto-u.ac.jp/j/press…/…/181109-120000.html)。このような試みの一つとして皮膚線維芽細胞やastrocyteを神経細胞へと分化させるという研究が進んでおり、マウスastrocyteにNEUROD1, ASCL1, LMX1AそしてmicroRNAであるmiR218を導入することによってドパミンニューロン(induced dopamin-releasing neuron, IDA neuron)に分化誘導が可能であり、その移植によって部分的にParkinson病モデルマウスの症状を改善させたことが報告されています(Rivetti di Val Cervo P et al., Nat Biotechnol. 2017 May;35(5):444-452)。しかしこのような方法の問題点は、移植したneuronが遠隔neuronと正常な脳で見られるようなネットワークを形成しないため、機能回復が部分的にとどまってしまうことです。
今回NatureおよびCellに発表された2つの論文は、異なるアプローチを用いて、脳に存在するastrocyteをIDA neuronに分化させるアプローチによってParkinson病の改善が可能であった、という内容です。キーになっているのはneuronへの分化を抑制的に制御するPTBという分子です。
Qianらはまずin vitroでsmall hairpin RNAを用いてRNA-binding proteinであるPTBをコードするPtbp1遺伝子を抑制することによってastrocyteをIDA neuronに分化させることが可能であることを明らかにしました。またZhouらはCRISPR-CasRxシステムを用いてPtbp1遺伝子を抑制することによって同様の結果を得ました。In vivoにおいてもQianらは黒質に存在するアストロサイト、Zhouらは線条体のアストロサイトにおけるPtbp1を抑制することでIDA neuronへと分化させることに成功しました。Ptbp1遺伝子の抑制によってIDA neuronで発現している転写因子であるLmx1a, Foxa2の発現亢進も誘導されました。興味深いことにPtbp1遺伝子の抑制は脳の様々な部位において異なる転写因子の発現を誘導し、異なるneuronへの分化を誘導することも示されました。
今後このようなアプローチが臨床的に応用可能かどうかはPtbp遺伝子をastrocyteで効率よく抑制する手法の開発にかかっています。またPTBの作用メカニズムのさらなる解明も必要でしょう。しかしこれらの研究はParkinson病の治療に新たな方向性を与える貴重なものと考えられます。
1. Qian, H. et al. Reversing a Model of Parkinson's Disease With in Situ Converted Nigral Neurons. Nature. 2020 Jun;582(7813):550-556. https://www.nature.com/articles/s41586-020-2388-4
2. Zhou, H. et al. Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice. Cell. 2020 Apr 30;181(3):590-603.e16.
https://linkinghub.elsevier.com/ret…/…/S0092-8674(20)30286-5
https://www.nature.com/articles/d41586-020-01817-4