Parkinson病はモハメド・アリなどの著名人も罹患したことで有名な疾患です。脳内黒質・線条体ドパミンニューロンの変性・消失がその主病変であることが知られています。治療法としてはL-DOPAの投与が有効で、脳内でドパミンに変わり、減少しているドパミンを補い、症状を緩和します。L-DOPAは現在も第一選択薬と位置付けられていますが、長期投与によって効果の減弱やon-off現象、dyskinesiaなどが見られることが知られており、より有効性・安全性の高い新たな治療法が待たれている難病です。
これまでに様々な細胞移植療法が試みられており、ES細胞やiPS細胞にも期待がもたれています(https://www.cira.kyoto-u.ac.jp/j/press…/…/181109-120000.html)。このような試みの一つとして皮膚線維芽細胞やastrocyteを神経細胞へと分化させるという研究が進んでおり、マウスastrocyteにNEUROD1, ASCL1, LMX1AそしてmicroRNAであるmiR218を導入することによってドパミンニューロン(induced dopamin-releasing neuron, IDA neuron)に分化誘導が可能であり、その移植によって部分的にParkinson病モデルマウスの症状を改善させたことが報告されています(Rivetti di Val Cervo P et al., Nat Biotechnol. 2017 May;35(5):444-452)。しかしこのような方法の問題点は、移植したneuronが遠隔neuronと正常な脳で見られるようなネットワークを形成しないため、機能回復が部分的にとどまってしまうことです。
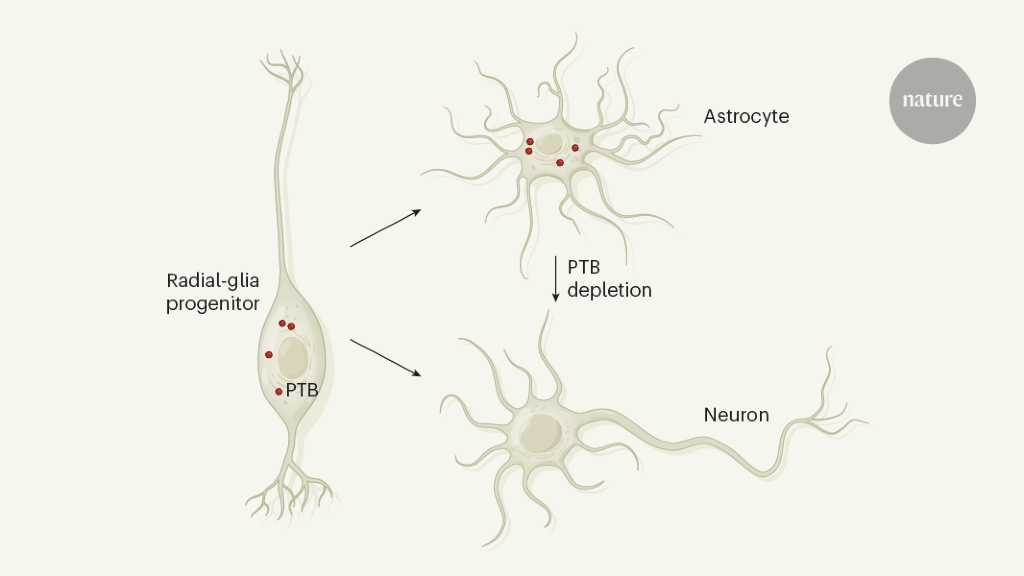
今回NatureおよびCellに発表された2つの論文は、異なるアプローチを用いて、脳に存在するastrocyteをIDA neuronに分化させるアプローチによってParkinson病の改善が可能であった、という内容です。キーになっているのはneuronへの分化を抑制的に制御するPTBという分子です。
Qianらはまずin vitroでsmall hairpin RNAを用いてRNA-binding proteinであるPTBをコードするPtbp1遺伝子を抑制することによってastrocyteをIDA neuronに分化させることが可能であることを明らかにしました。またZhouらはCRISPR-CasRxシステムを用いてPtbp1遺伝子を抑制することによって同様の結果を得ました。In vivoにおいてもQianらは黒質に存在するアストロサイト、Zhouらは線条体のアストロサイトにおけるPtbp1を抑制することでIDA neuronへと分化させることに成功しました。Ptbp1遺伝子の抑制によってIDA neuronで発現している転写因子であるLmx1a, Foxa2の発現亢進も誘導されました。興味深いことにPtbp1遺伝子の抑制は脳の様々な部位において異なる転写因子の発現を誘導し、異なるneuronへの分化を誘導することも示されました。
今後このようなアプローチが臨床的に応用可能かどうかはPtbp遺伝子をastrocyteで効率よく抑制する手法の開発にかかっています。またPTBの作用メカニズムのさらなる解明も必要でしょう。しかしこれらの研究はParkinson病の治療に新たな方向性を与える貴重なものと考えられます。
1. Qian, H. et al. Reversing a Model of Parkinson's Disease With in Situ Converted Nigral Neurons. Nature. 2020 Jun;582(7813):550-556. https://www.nature.com/articles/s41586-020-2388-4
2. Zhou, H. et al. Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice. Cell. 2020 Apr 30;181(3):590-603.e16.
https://linkinghub.elsevier.com/ret…/…/S0092-8674(20)30286-5
https://www.nature.com/articles/d41586-020-01817-4
これまでに様々な細胞移植療法が試みられており、ES細胞やiPS細胞にも期待がもたれています(https://www.cira.kyoto-u.ac.jp/j/press…/…/181109-120000.html)。このような試みの一つとして皮膚線維芽細胞やastrocyteを神経細胞へと分化させるという研究が進んでおり、マウスastrocyteにNEUROD1, ASCL1, LMX1AそしてmicroRNAであるmiR218を導入することによってドパミンニューロン(induced dopamin-releasing neuron, IDA neuron)に分化誘導が可能であり、その移植によって部分的にParkinson病モデルマウスの症状を改善させたことが報告されています(Rivetti di Val Cervo P et al., Nat Biotechnol. 2017 May;35(5):444-452)。しかしこのような方法の問題点は、移植したneuronが遠隔neuronと正常な脳で見られるようなネットワークを形成しないため、機能回復が部分的にとどまってしまうことです。
今回NatureおよびCellに発表された2つの論文は、異なるアプローチを用いて、脳に存在するastrocyteをIDA neuronに分化させるアプローチによってParkinson病の改善が可能であった、という内容です。キーになっているのはneuronへの分化を抑制的に制御するPTBという分子です。
Qianらはまずin vitroでsmall hairpin RNAを用いてRNA-binding proteinであるPTBをコードするPtbp1遺伝子を抑制することによってastrocyteをIDA neuronに分化させることが可能であることを明らかにしました。またZhouらはCRISPR-CasRxシステムを用いてPtbp1遺伝子を抑制することによって同様の結果を得ました。In vivoにおいてもQianらは黒質に存在するアストロサイト、Zhouらは線条体のアストロサイトにおけるPtbp1を抑制することでIDA neuronへと分化させることに成功しました。Ptbp1遺伝子の抑制によってIDA neuronで発現している転写因子であるLmx1a, Foxa2の発現亢進も誘導されました。興味深いことにPtbp1遺伝子の抑制は脳の様々な部位において異なる転写因子の発現を誘導し、異なるneuronへの分化を誘導することも示されました。
今後このようなアプローチが臨床的に応用可能かどうかはPtbp遺伝子をastrocyteで効率よく抑制する手法の開発にかかっています。またPTBの作用メカニズムのさらなる解明も必要でしょう。しかしこれらの研究はParkinson病の治療に新たな方向性を与える貴重なものと考えられます。
1. Qian, H. et al. Reversing a Model of Parkinson's Disease With in Situ Converted Nigral Neurons. Nature. 2020 Jun;582(7813):550-556. https://www.nature.com/articles/s41586-020-2388-4
2. Zhou, H. et al. Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice. Cell. 2020 Apr 30;181(3):590-603.e16.
https://linkinghub.elsevier.com/ret…/…/S0092-8674(20)30286-5
https://www.nature.com/articles/d41586-020-01817-4