がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
558)がん細胞のATPを枯渇する方法(その1):ケトン食とメトホルミンと2-DG
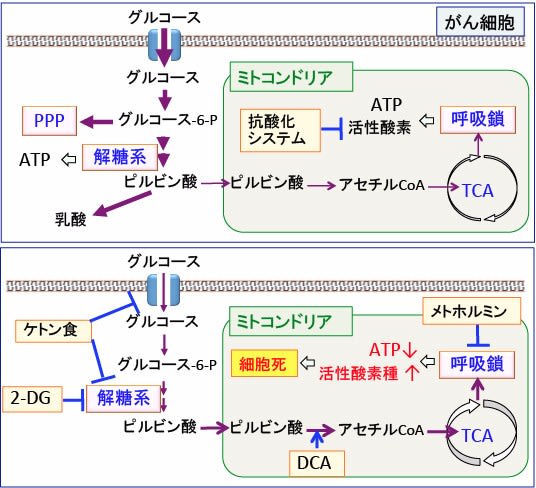
図:(上)がん細胞ではグルコースの取り込みと解糖系とペントースリン酸経路(PPP)が亢進している。ミトコンドリアでの酸素呼吸(酸化的リン酸化)は活性酸素を産生してがん細胞にダメージを与えるので、酸素呼吸は抑制されている。さらに抗酸化システムを増強して酸化ストレスを防いでいる。
(下)解糖系を阻害し、ミトコンドリアでの酸素呼吸を亢進し、呼吸鎖を阻害すると、ATP産生が減少し、活性酸素の産生が増えて、がん細胞は死滅する。がん細胞の解糖系を阻害するケトン食と2-デオキシグルコース(2-DG)、ミトコンドリアでの代謝を促進するジクロロ酢酸ナトリウム(DCA)、呼吸鎖を阻害して活性酸素の産生を高めるメトホルミンを組み合わせると、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができる。
558)がん細胞のATPを枯渇する方法(その1):ケトン食とメトホルミンと2-DG
【がん細胞の代謝の柔軟性とは】
一般に、『がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っている。これを好気性解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言う。』と教科書的に信じられています。
しかし、がん細胞はこの基本法則を厳密に守っているわけではありません。特にがん幹細胞(Cancer Stem Cell)では、エネルギー産生や物質代謝において、かなりの柔軟性(フレキシビリティ)を持っています。
エネルギー産生には酸素を使わない解糖系やミトコンドリアで酸素を使う酸素呼吸(酸化的リン酸化)があります。
エネルギー産生の材料には、グルコースだけでなく、アミノ酸、脂肪酸、ケトン体、乳酸などを使います。
脂肪酸やケトン体をエネルギー産生に利用するには、ミトコンドリアでの代謝になるので、解糖系が亢進しミトコンドリアでの酸素呼吸が低下しているがん細胞では、脂肪酸やケトン体を利用しにくい状態にあります。これが、超低糖質高脂肪食のケトン食の抗がん作用の根拠の一つです。しかし、ケトン食の抗腫瘍効果には限界があります。
がん細胞は何としてでも生きていこうとします。
グルコースが枯渇して利用できなくなったり、解糖系が阻害されると、ミトコンドリアでの酸素呼吸によるエネルギー産生を亢進します。エネルギー産生の材料が脂肪酸とケトン体しかなければ、これらを利用します。
このような代謝の状況を「代謝の柔軟性(metabolic flexibility)」と言います。がん細胞に代謝の柔軟性がなければ、解糖系を阻害する方法(2-デオキシ-D-グルコースやケトン食)だけで、がん細胞を死滅できます。
しかし、解糖系を阻害するだけでは、がん細胞を死滅できません。代謝の柔軟性によってミトコンドリアを利用するエネルギー産生にスイッチを切り替えることができるからです。
グルコースが利用できない状況でがん細胞が生きていくためには、脂肪酸やケトン体も利用するようになるのです。
この代謝の柔軟性に対抗するための解決法としては、「解糖系とミトコンドリアでの酸素呼吸を同時に阻害する」という方法が考えられます。
しかし、解糖と酸素呼吸を阻害すると、正常細胞にもダメージが大きくなります。
そこで、正常細胞とがん細胞のミトコンドリアや抗酸化システムの違いを利用することになります。
一つは、がん細胞はミトコンドリアの機能に様々な異常があって、活性酸素が出やすい状況にあります。酸化ストレスの亢進はがん細胞の増殖や転移を抑制し、細胞死を誘導します。
つまり、代謝をターゲットにしたがん治療には①解糖系の阻害、②ミトコンドリアでのATP産生阻害、③ミトコンドリアでの活性酸素の産生亢進、④抗酸化システムの阻害の4つが必要だと言えます。
【断食はがん細胞を自滅させる】
がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っています(下図)。
これを好気性解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言い、がん細胞の代謝の特徴としてあまりに有名です。
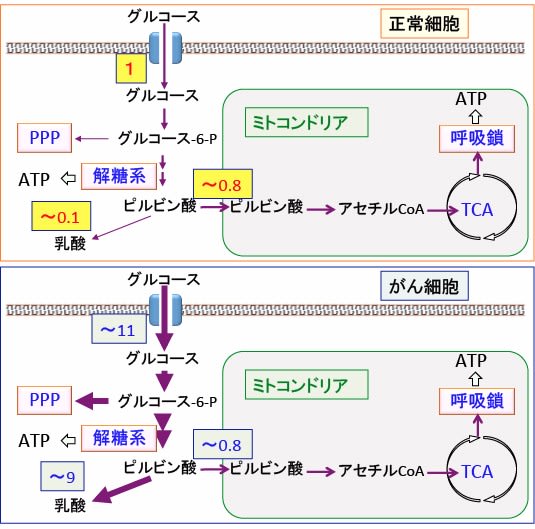
図:がん細胞ではグルコースの取り込みと解糖系が亢進し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制されている。そのレベルはがん細胞によって異なるが、一つの平均的な数値として、正常細胞のグルコースの取込み量を1とした相対値を記載している。正常細胞では取り込まれたグルコースの8割くらいがミトコンドリアでの代謝に使われている(上図)。がん細胞でもミトコンドリアでの代謝は同程度に起こっているが、グルコースの取込みは10倍程度に亢進し、その多くは解糖系で代謝され、乳酸の産生が顕著に増えている(下図)。(参考:Free Radic Biol Med 2015 Feb; 0: 253-263)
ワールブルグ効果を是正するために解糖系を阻害して酸素呼吸を亢進すると、がん細胞は自滅します。その一つの方法として絶食(断食)があります。以下のような報告があります。
Fasting induces anti-Warburg effect that increases respiration but reduces ATP-synthesis to promote apoptosis in colon cancer models
(大腸がんの実験モデルにおいて、断食は酸素呼吸を亢進し、ATP合成は低下させることによってワールブルグ効果を是正し、アポトーシスを亢進する)Oncotarget. 2015 May 20; 6(14): 11806–11819.
【要旨】
がん細胞における抗がん剤耐性は、好気性解糖の亢進と酸化的リン酸化の低下というがん細胞の代謝の特徴(ワールブルグ効果)と関連が深く、このワールブルグ効果を是正すると、多くのがん細胞において、抗がん剤耐性を軽減できることが知られている。
以前の研究において、短期間の絶食が、抗がん剤によるダメージから正常細胞を保護し、がん細胞に対してはダメージを高める効果があることを報告したが、そのメカニズムに関しては、十分に解明されていない。
今回の研究では、抗がん剤のオキサリプラチンと48時間の絶食の併用が、大腸がん細胞CT26細胞株の増殖にどのような影響を及ぼすかを検討した。
細胞培養によるin vitro(試験管内)の実験と、動物を使ったin vivo(生体内)の実験系の両方において、48時間の絶食はオキサリプラチンの抗腫瘍効果を増強した。
CT26大腸がん細胞において、48時間の絶食は好気性解糖系とグルタミン代謝(glutaminolysis)を低下させ、ミトコンドリアでの酸化的リン酸化を亢進した。
絶食はミトコンドリアの呼吸酵素複合体-I(Complex I)と複合体II(Complex II)における酸素消費を増やし、活性酸素の産生を高めて酸化ストレスを高めたが、ATP産生は減少した。
抗がん剤治療は、コハク酸/複合体IIによる酸素消費を増やし、酸化ストレスと亢進してアポトーシスを誘導することによって、さらに細胞毒性を高める。
これらの結果は、短期間(48時間)の絶食によるグルコースとアミノ酸の欠乏はワールブルグ効果を是正し、ミトコンドリアでの酸素消費を増やすがATP産生は増やせず、その結果、酸化ストレスによる酸化傷害を引き起こしてアポトーシスが誘導されることを示している。
がんの食事療法において絶食(断食)があります。断食はがん細胞のグルコースの利用を低下させ、ケトン体産生やオートファジーの亢進などによって抗腫瘍効果を発揮します。ただし、断食の長期間の実施は体重や体力や栄養状態を低下させるデメリットがあります。しかし、2〜3日程度の短期間の断食が抗がん剤や放射線治療の副作用を軽減し、抗腫瘍効果を高めることは人間でも証明されています。(391話参照)
この論文では、絶食はがん細胞の解糖系とグルタミン代謝を抑制し、ミトコンドリアでの酸素呼吸を亢進し、活性酸素の産生を増やして酸化ストレスを高め、ATP産生を低下させる効果によってがん細胞にアポトーシスを誘導することを明らかにしています。
がん細胞のワールブルグ効果を是正すると、がん細胞は酸化ストレス亢進とATP枯渇によって死滅するということを示しています。(下図)

図:絶食(断食)はがん細胞におけるグルコースの取込み(①)と解糖系(②)とペントースリン酸経路(③)とグルタミン代謝(④)を抑制し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進し(⑤)、活性酸素の産生を増やして酸化ストレスを高め(⑥)、ATP産生を抑制して細胞増殖を抑制し、アポトーシスを誘導する(⑦)。
【がんの食事療法としてケトン食はベターではあるがベストではない】
血糖とインスリン産生を高める糖質の多い食事に比べれば、超低糖質のケトン食はがんの食事療法として優れています。
しかし、肝臓や腎臓などで糖新生が起こって1日100グラム程度のグルコースが合成されて血糖は維持されます。また、アミノ酸のグルタミンから物質合成やエネルギー産生を亢進できます。正常細胞にとってアミノ酸は必要なので、タンパク質の摂取は制限できません。
したがって、ケトン食はがんの食事療法としてベストとは言えません。
そこで、何も摂取しない「絶食(断食)」が究極のがんの食事療法として提唱されています。確かに、糖もタンパク質も脂肪も入ってこなければ、がん細胞の増殖と生存はかなり抑えられます。
しかし、生体の方も栄養不良になって、生命の維持ができなくなります。
がん細胞がエネルギー欠乏になって全滅するか、体が栄養失調で死んでしまうかというチキンレースになります。
一般的には、がん細胞は筋肉などの正常細胞を分解して、自分の栄養として取り込むので、体の方が先に負けてしまいます。つまり、絶食療法ではがんには勝てません。
ベストながんの食事療法はありません。ベストが無い中で、ケトン食や断食(ファスティング)はベターだと言うだけです。 足りない部分を補う必要があります。
【ミトコンドリアを活性化して同時に機能を阻害する】
ミトコンドリアを活性化するとATP産生が増えるので、がん細胞の増殖を促進するのではないかという懸念があります。実際、ジクロロ酢酸ナトリウムでミトコンドリア機能を高めるとがん細胞の増殖が促進する場合があることが報告されています。
この場合に、ミトコンドリアの呼吸鎖の酵素を阻害すると、ATP産生は阻害され、活性酸素が多く産生されて、酸化ストレスでがん細胞を死滅できます。
つまり、がん細胞の代謝の特徴をターゲットにした治療法は以下の3つを同時に行うと、抗腫瘍効果を高めることができます。
① 解糖系を阻害する。(ケトン食、2-デオキシグルコース)
② ピルビン酸脱水素酵素を活性化してミトコンドリアでの酸素呼吸(酸化的リン酸化)を増やす。(ケトン食、ジクロロ酢酸ナトリウム)
③ ミトコンドリアの呼吸酵素複合体を阻害して、ATP産生は抑制して、活性酸素の発生を増やす。(メトホルミン、ドキシサイクリンなど)
この中で、①と③が重要です。解糖系とミトコンドリアでのエネルギー産生を同時に阻害することが重要です。がん細胞のエネルギーを枯渇させるためには①と③を同時に行う必要があります。
がん細胞の酸化ストレスを高める目的では②が重要です。がん細胞のミトコンドリアを活性化すると活性酸素の産生が増えて酸化ストレスが亢進します。このとき、呼吸鎖を阻害する方法を併用するとATP産生低下と酸化ストレス亢進によってがん細胞は死滅しやすくなります。
抗酸化システム(グルタチオンやチオレドキシンシステムなど)を阻害する方法を加えると、さらに抗腫瘍効果が高まります。
がん細胞は代謝の柔軟性(metabolic flexibility)が高いのが特徴です。
一般的には、解糖系が亢進し、ミトコンドリアでの酸素呼吸は抑制されていますが、解糖系を阻害すると、がん細胞はミトコンドリアでの酸素呼吸でエネルギーを産生します。したがって、解糖系とミトコンドリアの酸素呼吸(呼吸鎖)の両方を阻害しないと、代謝の柔軟性によって、がん細胞を死滅できないのです。
元々、ミトコンドリアは細菌だったので、抗菌剤などが③のミトコンドリアの呼吸酵素複合体を阻害する目的で利用できます。実際に、抗菌薬のドキシサイクリンなどがミトコンドリアをターゲットにしたがん治療に利用されています(次話で解説します)。
ケトン食は①解糖系阻害と②ミトコンドリアの酸素呼吸を増やす作用があります。ケトン食だけで抗腫瘍効果に限界があるのは、③のメカニズムが無いからです。ケトン食を実践するときには③を併用することが重要です。
抗がん剤治療を行っているときは、抗がん剤が③の作用をする場合があるので、抗がん剤+ケトン食は効果が期待できます。抗がん剤治療を行っていないときは、別の方法で③を実施する必要があります。
【ケトン体はがん細胞のミトコンドリアの酸化的リン酸化を活性化する】
前述の論文のように絶食はがん細胞のワールブルグ効果を是正してがん細胞を死滅させる効果が期待できます。しかし、長期間の絶食は体力や栄養状態を低下させる欠点があります。
体力や栄養状態を低下させないで絶食と同じような効果が期待できる方法としてケトン食があります。
がん細胞はケトン体や脂肪酸をエネルギー源として利用しにくい状態にあります。
それは、がん細胞は酸素を使ったエネルギー産生を行いたくない理由があるからです。
したがって、酸素を使わない解糖系を亢進し、ミトコンドリアの酸素呼吸をできるだけ抑制しています。
脂肪酸もケトン体もミトコンドリアでしか代謝できないので、ミトコンドリアの代謝が抑制されているがん細胞では脂肪酸もケトン体も利用できない(利用したくない)状況にあります。
しかし、がん細胞でもミトコンドリアの機能は維持されています。したがって、解糖系を阻害すると、ミトコンドリアでのエネルギー産生を高めるしかありません。実際、がん細胞もケトン体や脂肪酸を分解してエネルギー産生はできます。ただ、したくないだけです。
そこで、ケトン体や脂肪酸をエネルギー源としてがん細胞に使用させるように仕向けると、がん細胞の酸化ストレスを高めて、増殖を抑制し、死滅できます。
つまり、がん細胞がエネルギー産生のためにケトン体や脂肪酸を使用させて、自滅させるように仕掛けるのです。
ケトン体はモノカルボン酸トランスポーター(monocarboxylate transporters)の MCT1と2を使って、細胞質とミトコンドリアに入ることができます。
ケトン食はがん細胞の解糖系を阻害し、酸化的リン酸化を亢進する結果、ワールブルグ効果を是正して抗腫瘍効果を発揮します。
しかし、がん細胞はグルタミンの取込みを増やしてTCAでの物質代謝(脂肪酸合成など)を維持し、ケトン体もエネルギー源として利用しようとします。したがって、ケトン食単独では、抗腫瘍効果に限界があり、場合によってはがん細胞を助けることにもなります。
がん細胞がミトコンドリアでの酸化的リン酸化を亢進するときには、活性酸素の産生を高めるメトホルミンやレスベラトロール、抗酸化システムを阻害するジスルフィラムやオーラノフィン、解糖系を阻害する2-デオキシグルコースなどの併用が重要になります。
つまり、がん細胞の酸化ストレスを徹底的に高めることが重要です。中途半端では逆効果になる(がん細胞の増殖を促進する)ので、注意が必要です。

図:糖質摂取を極力減らし、脂肪の摂取を増やしてケトン体の産生を増やすケトン食は、グルコースの取込みや解糖系を抑制(=正常化)し(①)、ペントース・リン酸経路を阻害してNADPHの産生を低下させ、がん細胞内の活性酸素消去能を低下させる(②)。さらに、ケトン食の主要なエネルギー源となる脂肪酸とケトン体はミトコンドリアでアセチルCoAに変換されて代謝されるため、これらをエネルギー源として利用すると活性酸素の産生が亢進して酸化ストレスによるダメージを受けることになる(③)。つまり、ケトン食はがん細胞に対してエネルギー産生を抑制し、活性酸素の産生を高めて酸化ストレスを亢進する2つの機序によってがん細胞を自滅させることができる(④)。(参考:Redox Biology 2: 963-970, 2014年)
【がん細胞の酸化ストレスを高めると死滅しやすくなる】
がん細胞では酸素が十分に存在する場合でも、解糖系でのグルコース代謝が亢進して、相対的にミトコンドリアでの酸化的リン酸化は抑制されています。
しかし、それでも、ミトコンドリアでの酸化的リン酸化によるエネルギー産生は正常細胞のレベルくらいは起こっています。解糖系が阻害されるような状況では、ミトコンドリアでの酸素呼吸を増やします。生きていくためには「代謝の柔軟性」が必要です。
しかし、がん細胞はミトコンドリア機能にいろんな異常があるので、正常細胞に比べて活性酸素が発生しやすくなっています。
多量に産生された活性酸素を十分に消去できないと、消去できなかった活性酸素種がミトコンドリア内の成分を酸化傷害でダメージを与え、アポトーシスによる細胞自滅を引き起こすことになります。酸化ストレス自体はがん細胞の増殖や転移を抑制する作用があります(505話参照)。
そこで、がん細胞は酸化ストレスを軽減するために、細胞に備わった抗酸化システムの活性を亢進しています。
多くの抗がん剤治療によって引き起こされるプログラム細胞死(アポトーシス)は、全てではないにしてもそのほとんどは活性酸素種によって引き起こされる可能性が示されています。
放射線照射が活性酸素種の産生によってアポトーシスを誘導するのと同じように、多くの抗がん剤も最終的には活性酸素種を産生することによってアポトーシスを誘導しています。
タキサン系抗がん剤のパクリタキセルに対するがん細胞の感受性がそのがん細胞の抗酸化能に逆相関するという実験結果が報告されています。つまり、抗酸化能の高いがん細胞ほど抗がん剤が効きにくいことが知られています。
活性酸素種を産生させてがん細胞を死滅させるときに抗酸化剤のN-アセチルシステインを同時に投与すると、活性酸素によるがん細胞の死滅は起こらなくなります。
したがって、抗がん剤や放射線治療の効き目を高める方法として、ミトコンドリアでの活性酸素の量を増やす方法(呼吸酵素複合体-Iの阻害など)と抗酸化システム(グルタチオン、チオレドキシン、Nrf2活性など)を阻害する方法を組み合せることが有用であることが理解できます。
【電子伝達系(呼吸鎖)からの漏れが活性酸素種の量を高めている】
ミトコンドリアにおける電子伝達系(呼吸鎖)においてATPが産生されるとき、必然的に活性酸素種(スーパーオキシド、過酸化水素、ヒドロキシラジカルなど)が発生します。
ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,ミトコンドリアのクリステにおいて,一連の酵素系(呼吸鎖複合体 I~IV)とATP合成酵素(呼吸鎖複合体Vとも言う)の連鎖を経て,最終受容体である酸素(O2)に渡されて水 H2Oになります。 複合体 I~IVの段階は,ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため電子伝達系(呼吸鎖)と呼ばれます。
電子伝達系によってミトコンドリアマトリックスから膜間空間にプロトン(水素イオン)がくみ出され、輸送されたプロトンによってミトコンドリア内膜の内外にΔΨと呼ばれる電気化学的ポテンシャル(プロトンによって生じるpH差および電荷の差)が作り出されます。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成します。これを酸化的リン酸化と言います。
ミトコンドリアの呼吸鎖や酸化的リン酸化の過程が阻害されると、プロトン(水素イオン)がうっ滞して、ミトコンドリアからの活性酸素種の産生が増加することが知られています。メトホルミンやレスベラトロールは呼吸酵素複合体Iを阻害して、ミトコンドリアからの活性酸素の発生を増やす作用があります。
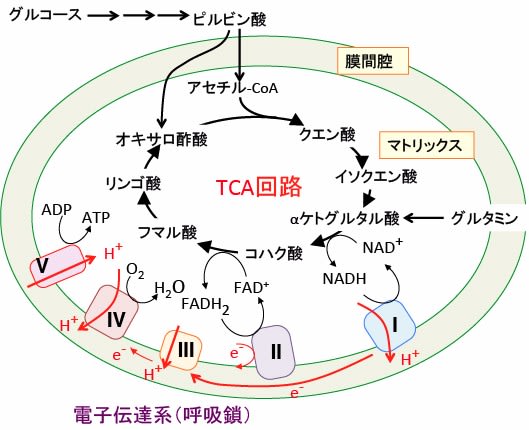
図:ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,電子伝達系(呼吸鎖複合体 I~IV)によって、ミトコンドリア・マトリックスから膜間空間にプロトン(水素イオン)がくみ出され、ミトコンドリア内膜の内外に電気化学的ポテンシャル(プロトンによって生じる電荷の差)が作り出される。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成する。これを酸化的リン酸化と言う。
【メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害する】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
ビグアナイド剤は、中東原産のマメ科のガレガ(Galega officinalis)から1920年代に見つかったグアニジン誘導体から開発された薬です。ガレガは古くから、糖尿病と思われる病気(口渇や多尿)の治療に経験的に使われ有効性が認められており、その関係でこのガレガから血糖降下作用のあるビグアナイドが発見されました。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。
その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。
活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。メトホルミンはミトコンドリア毒なのです。
体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。
この作用は、基本的には運動と同じことです。運動も体内のATP量が減るので、グルコースの分解が促進されるように代謝が変わります。代謝に関しては、メトホルミンは運動しないで運動と同じ効果を発揮します。(運動は筋肉を鍛えるので、健康作用は運動の方が勝っています)
最近の研究では、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素(mitochondrial glycerol-phosphate dehydrogenase: mGDP)を阻害することも報告されています。(下図)

図:メトホルミンは有機カチオン輸送体1(organic cation transporter 1 :OCT1)によって細胞内に入り、ミトコンドリアに集積する。ミトコンドリアでは呼吸酵素複合体IとmGDP(ミトコンドリア・グリセロールリン酸脱水素酵素)を阻害してNADH酸化を阻害する。その結果、ミトコンドリアでのATP産生は低下する。これらの作用はAMP活性化プロテインキナーゼ(AMP)シグナル伝達系を亢進し、cAMP/PKAシグナル伝達系を抑制し、糖新生を抑制し、解糖を亢進する。(参考:BMC Biol. 2014; 12: 82.)
メトホルミンは抗老化作用や寿命延長作用があります。そのメカニズムとして、呼吸酵素阻害によるATP産生阻害が関連しています。
ATP産生阻害によってAMPKが活性化されます。さらに、電子伝達系(呼吸鎖)の阻害によって活性酸素の産生が増える結果、細胞は転写因子のFox03aやPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)やNrf2の活性を高め、抗酸化酵素酵素や解毒酵素の発現を高め、ストレス抵抗性を高め、加齢関連疾患の発症を抑制し、寿命を延ばす作用を発揮します。ミトホルミシスの機序です(504話参照)。
このメトホルミンの呼吸酵素阻害作用は、がん細胞において活性酸素の産生を増やす目的でがん治療への応用が検討されています。
つまり、がん細胞の酸化ストレスを高めるジクロロ酢酸と2-デオキシグルコースとケトン食の組み合せにメトホルミンを併用すると抗腫瘍効果を高めることができますが、その機序としてミトコンドリアでの活性酸素を増やす作用が指摘されています。
メトホルミンがミトコンドリアでのグルコースとグルタミンの利用を阻害して物質合成を阻害し、がん細胞の増殖を抑制する効果が報告されています。(490話参照)
【絶食と同じ抗がん作用を示すケトン食+2-デオキシグルコース+メトホルミン+ジクロロ酢酸】
がん細胞におけるワールブルグ効果を抑制し、エネルギー代謝を正常に是正すれば、がん細胞の増殖を抑制し、細胞死を誘導できます。
2-デオキシ-D-グルコース(2-DG)は解糖系を阻害することによって乳酸とATPの産生を阻害します。
経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害する作用があります。最近の研究では、メトホルミンが2-DGと同様に解糖系酵素のヘキソキナーゼの活性を阻害する作用も明らかになっています。
したがって、2-DGとメトホルミンを併用すると、がん細胞のエネルギー産生を阻害する効果を高めることができます。解糖系とミトコンドリアでの酸素呼吸を同時に阻害するからです。
マウスの移植腫瘍の実験モデルで、2-DGとメトホルミンを併用すると相乗的な抗腫瘍効果が得られることが報告されています。(Mol Cancer Ther. 10(12): 2350-2362, 2011年)
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果は得られませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。様々な種類のがん細胞をマウスに移植した動物実験において、2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は弱いのですが、この2つを併用すると強い腫瘍縮小効果が認められています。
がん細胞が増殖するためには、増殖のシグナルと、エネルギー産生と物質合成のための材料が必要です。増殖シグナル伝達系は、インスリン/インスリン様成長因子-1(IGF-1)とそれらの受容体の結合によって刺激されるPI3K/Akt/mTORC1伝達系が重要です。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)と解糖系のヘキソキナーゼを阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を抑制します。
一方、2-DGはグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。
メトホルミンには乳酸アシドーシスを引き起こす副作用があります。乳酸が増えて、血液が酸性になる状態です。
大きながん組織があると乳酸の産生が増えています。乳酸アシドーシスを防ぐために、肝臓では乳酸をブドウ糖に変換する糖新生が亢進します。メトホルミンは糖新生を阻害する効果があるので、乳酸産生の増加した状態でメトホルミンを服用すると乳酸アシドーシスを起こしやすくなります。
この場合、がん細胞の解糖系を抑制し、ミトコンドリアでの酸素呼吸を増やす2-デオキシグルコースやジクロロ酢酸ナトリウムやケトン食を併用するとメトホルミンによる乳酸アシドーシスの発生を防ぐことができます。特にジクロロ酢酸ナトリウムは乳酸アシドーシスの治療に古くから使用されています。

図: がん細胞は解糖系が亢進して乳酸の産生が増えている(1)。乳酸は肝臓や腎臓やがん間質細胞で糖新生によってグルコースに変換されている(2)。2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害し(3)、ジクロロ酢酸ナトリウム(DCA)はピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進する(4)。メトホルミンは糖新生を阻害する(5)。メトホルミンは呼吸鎖を阻害して(6)、ATP産生を低下させ(7)、さらにミトコンドリアでの活性酸素の産生を増やして酸化ストレスを亢進する(8)。ケトン食はグルコースの利用を阻害し(9)、脂肪酸とケトン体はミトコンドリアでの代謝を亢進して酸素呼吸(酸化的リン酸化)を亢進する(10)。これらの組み合せは、酸化ストレスを高め、ATP産生を低下させて、がん細胞の増殖を抑制し、細胞死を誘導する(11)。2-DGとDCAはメトホルミンによる乳酸アシドーシスを防ぐので、副作用も少なくなり、抗腫瘍活性を高めることができる。
ケトン食だけでは抗腫瘍効果は弱いのですが、2-デオキシグルコース(2-DG)とメトホルミンとジクロロ酢酸ナトリウムを併用すると、がん細胞の増殖を抑制できます。さらに抗酸化システムを阻害するジスルフィラムやオーラノフィンを併用すると、がん細胞を酸化ストレスで自滅できます。(510話参照)
がん細胞は酸化ストレスを避けるためにいろんな手段を使っています。ミトコンドリアの酸素呼吸を抑えたり、グルタチオンの産生を増やしたりしています。グルコースの取込みを亢進して解糖系とペントースリン酸回路を亢進しているのも酸化ストレスの軽減に役立っています。
このようながん細胞の代謝の特徴をターゲットにすれば、がん細胞を自滅に追いやることができます。
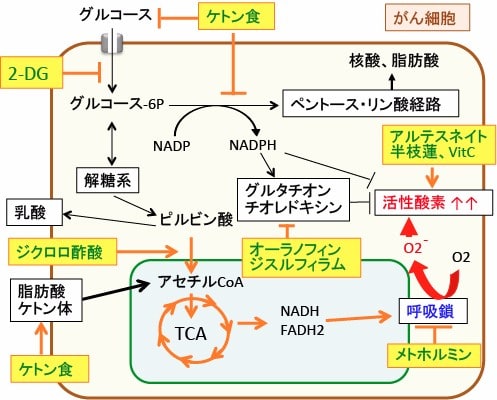
図:がん細胞の代謝の特徴であるワールブルグ効果(解糖系の亢進と酸化的リン酸化の抑制)を正常化し、がん細胞の酸化ストレスを高める方法として、がん細胞の解糖系やペントース・リン酸経路を阻害するケトン食と2-デオキシグルコース(2-DG)、ミトコンドリアでの代謝を促進するジクロロ酢酸、呼吸鎖を阻害して活性酸素の産生を高めるメトホルミン、細胞質でフリーラジカルを産生するアルテスネイトや半枝蓮や高濃度ビタミンC点滴、グルタチオンやチオレドキシンによる抗酸化システムを阻害するオーラノフィンやジスルフィラムがある。これらを組み合わせると、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができる。
| « 557)アセチル-... | 559)がん細胞... » |



