がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
318)脂肪酸のβ酸化を亢進すると寿命が延びる
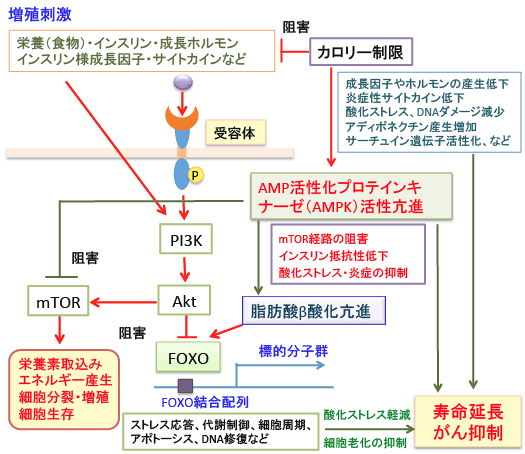
図:カロリー制限は、酸化ストレスの軽減や細胞老化を抑制し、寿命延長やがんを含めた老化性疾患の発生を遅らせる効果がある。このとき、FOXO(Forkhead box O)という転写因子の活性化が関与している。カロリー制限やAMPKの活性化は脂肪酸燃焼(β酸化)を促進するが、脂肪酸β酸化に関連する遺伝子発現が過剰発現(結果として脂肪酸の燃焼が亢進)すると、FOXOを活性化してカロリー制限と同様の寿命延長効果が得られることが報告されている。これは、カロリー制限を行わないでも、糖質制限やケトン食やAMPK活性化などで脂肪酸の燃焼を促進すれば、寿命延長効果や抗がん作用を得られる可能性を示唆している。
318)脂肪酸のβ酸化を亢進すると寿命が延びる
【カロリー制限と類似の効果を再現する方法の研究が注目されている】
寿命延長の達成で最も再現性のある方法はカロリー制限です。栄養障害を起こさずに食事からの摂取カロリーを30~40%程度減らすと寿命延長効果があることは、酵母から線虫、ハエ、マウス、霊長類に至る多くの生物種において確認されています。さらに、カロリー制限は老化を遅延し、がんを含めた老化関連疾患の発症を遅らせる効果も確かめられています。(317話参照)
そして、このカロリー制限と同じような効果がある方法(食事療法や医薬品やサプリメントなど)の研究が盛んです。この飽食の時代に30~40%のカロリー制限を長期に続けるのは苦痛が大きいので、カロリー制限を行わずにカロリー制限と同じような効果をもつ方法が求められているというわけです。
現時点では、一つの方法でカロリー制限と全く同じ効果を再現できる方法は見つかっていませんが、多数の候補物質が見つかっており、医薬品の開発を盛んに行われています。現在知られている方法だけでも、複数を組み合わせると、30~40%のカロリー制限の効果に近づけることはできそうです。
その候補としては、AMP活性化プロテインキナーゼを活性化する抗糖尿病薬のメトホルミン(216話,308話参照)や、レスベラトロール・ケルセチン・ベルベリン・アルクチゲニンなどの植物成分(309話,311話参照)、冬虫夏草に含まれるコルジセピン(232話参照)、長寿遺伝子といわれるサーチュイン遺伝子(SIRT1)を活性化する方法(240話参照)、アディポネクチンの産生を高める黄蓍(オウギ)(292話参照)など多数が知られています。サーチュイン遺伝子やAMPKの活性化をターゲットにした医薬品の開発も盛んに行われています。
サ−チュイン遺伝子やAMPKの活性化や、アディポネクチンの産生増加、抗酸化作用や抗炎症作用などをもった成分が生薬や植物から多数見つかっていますので、不老長寿やがん予防を目指す漢方薬の研究においても、このような観点からの研究や考察が重要になってきています。
【脂肪酸のβ酸化のレベルが寿命に影響する】
カロリー制限すると脂肪の燃焼が亢進します。このとき、カロリー制限がAMPKを活性化し、活性化したAMPKが脂肪酸のβ酸化を亢進するということになっています。糖質制限などによるインスリン/インスリン様成長因子シグナル系の抑制も脂肪酸β酸化を促進します。
β酸化(ベータさんか)とは脂肪酸を酸化して脂肪酸アシルCoA(fatty acyl-CoA; 脂肪酸と補酵素Aのチオエステル)を生成し、そこからアセチルCoAを取り出す代謝経路のことです。脂肪酸アシルCoAのβ位において段階的な酸化が行われることからβ酸化と名付けられました。β酸化は4つの反応の繰り返しから成り、反応が一順するごとにアセチルCoAが1分子生成され、最終生産物もアセチルCoAとなります。生成されたアセチルCoAはTCA回路(クエン酸回路、クレブス回路)に送られ、酸化的リン酸化を経てATP産生に使われます。動物細胞では脂肪酸からエネルギーを取り出すための重要な代謝経路です。
脂肪酸のβ酸化はミトコンドリアで行われますが、長鎖脂肪酸はカルニチンが無いとミトコンドリアに入れませんが、中鎖脂肪酸はカルニチンの助けなしにミトコンドリアに運ばれ、β酸化で代謝されます。(下図)

さて、カロリー制限やAMPK活性化などで脂肪酸のβ酸化が亢進されますが、脂肪酸のβ酸化の亢進自体がカロリー制限と類似のメカニズムで寿命延長効果を示すことが報告されています。以下のような論文が最近発表されています。
Overexpression of Fatty-Acid-β-Oxidation-Related Genes Extends the Lifespan of Drosophila melanogaster(脂肪酸β酸化に関連する遺伝子の過剰発現はショウジョウバエの寿命を延ばす)
Oxid Med Cell Longev. 2012; 2012: 854502. Published online 2012 September 11. doi: 10.1155/2012/854502
この研究グループは、ショウジョウバエの突然変異系統(ミュータント:変異体)を使って、寿命に関連する遺伝子の研究を行っています。ある遺伝子が過剰発現していることによって寿命が延長したショウジョウバエの突然変異系統を解析して、寿命延長効果のある遺伝子を幾つか発見しています。その中に、脂肪酸のβ酸化に関連する遺伝子のfatty-acid-binding protein(脂肪酸結合蛋白) と dodecenoyl-CoA delta-isomerase があったということです。
つまり、脂肪酸のβ酸化に関与する遺伝子が過剰に発現したショウジョウバエの突然変異系統は正常と比べて寿命が延びるという結果を報告しています。
コントロールの正常のハエの平均寿命が32日に対して、fatty-acid-binding proteinの遺伝子が過剰に発現しているハエの平均寿命は58日、dodecenoyl-CoA delta-isomerase遺伝子が過剰に発現しているハエの平均寿命は42日でした。
また、正常なハエでは、カロリー制限によって寿命が31.4%延長したのに対して、脂肪酸β酸化関連の遺伝子が過剰発現しているハエでは、カロリー制限による寿命延長が12%と15%と減少していました。これは、脂肪酸β酸化関連遺伝子の過剰発現による寿命延長作用のメカニズムはカロリー制限による寿命延長作用のメカニズムと共通していることを意味しています。つまり、カロリー制限を行わないでも、脂肪酸のβ酸化を促進することはカロリー制限と同じ寿命延長効果を再現できることを示しています。
ただし、カロリー制限の寿命延長効果が脂肪酸β酸化の亢進でゼロになったわけではなく、約半分に減少した程度なので、カロリー制限による寿命延長作用にはβ酸化亢進以外のメカニズムも関与していると考察しています。
さらに、酸化ストレスや飢餓に対する抵抗性が高まっていることを示しています。つまりβ酸化の亢進したハエでは、パラコートを使った酸化障害やエサを減らすことによる飢餓によって死亡する率が減少することが示されています。さらに、このような効果のメカニズムとしてFOXOシグナル伝達系が活性化されていることが示されています。
そして、この論文の結論は「脂肪酸のβ酸化に関与する遺伝子の過剰発現はカロリー制限と同じような機序で寿命を延ばし、そのメカニズムとして転写因子のFOXOの活性化の関与が示唆された」ということでした。
【FOXOとは】
長寿になるには、様々なストレスに対する抵抗性が高くなっている必要があります。医学の発達によって80歳代での死亡が多くなっていますが、100歳を超えるような超高齢になるには、それなりの理由があるはずです。FOXOは様々なストレスに対する抵抗力を高める作用を担っており、カロリー制限における寿命延長や老化性疾患の抑制において重要な役割を果たしていることが知られています。
FOXOは「Forkhead box O」の略で、DNA結合ドメインFOX(Forkhead box)をもつForkheadファミリーのサブグループ“O”に属する転写因子です。哺乳類ではFOXO1,3,4,6の4種類が存在、線虫ではDaf-16、ショウジョウバエではdFOXOとそれぞれ1種類のみ存在し、栄養飢餓時に活性化される転写因子です。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質で、FOXOはストレス応答、代謝制御、細胞周期、アポトーシス、DNA修復などに関連する多くの遺伝子の発現誘導を促します。
がん抑制遺伝子としての性格ももっており、FOXOの活性化は抗がん作用があります。
FOXOはインスリン-PI3K-AKTシグナルによって負に制御されています。つまり、PI3K-AKTシグナルが活性化されるとAKTによって直接的にリン酸化され、FOXOの核外移行を促進することでその転写活性は抑制されます。
一方、栄養飢餓状態ではPI3K-AKTの不活性化に伴いFOXOの活性化が誘導されることになります。つまり、カロリー制限や糖質制限やAMPK活性化などによる寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています。
脂肪酸のβ酸化の亢進がどのようなメカニズムでFOXOを活性化するかは現時点では不明です。しかし、何らかの機序で、脂肪酸の燃焼(β酸化)の亢進はFOXOの活性化を介して寿命延長と抗がん作用を発揮する可能性が示唆されます。
【脂肪酸のβ酸化を亢進する中鎖脂肪酸とケトン食】
「ケトン食」というのは、体内でケトン体が多く産生されるように考案された食事です。古来、さまざまな疾患に絶食療法が行われており、特にてんかん発作が絶食によって減少することは古くから知られていました。そして、「脂肪を多く炭水化物の少ない食事をと摂れば、絶食と同等の効果が得られる」という考えのもとに、1920年代に米国のメイヨークリニックでケトン食療法(ketogenic diet)が発案されました。つまり、ケトン食というのは、絶食療法の代わりとして考案されたものですが、糖質制限食よりも、脂肪の燃焼亢進作用が高いことが報告されています。たとえば、地中海料理から糖質を減らしたケトン食(ケトジェニックな地中海料理:Ketogenic Mediterranean Diet)がメタボリック症候群の改善に顕著な効果があることが報告されています(305話参照)
また、中鎖脂肪酸を利用すると脂肪酸のβ酸化のレベルを高めることができます。
脂肪はグリセロール(グリセリンともいう)1分子に3分子の脂肪酸が結合した構造をしており、これを中性脂肪(トリグリセリド)と言います。食事から摂取した脂肪は十二指腸や小腸内で膵液中のリパーゼによって加水分解され、トリグリセリド(中性脂肪)から脂肪酸とグリセロールが分離されます。グリセロールは水溶性なのでそのまま小腸から毛細血管に吸収され、解糖系で代謝されたり、糖新生によってブドウ糖に変換されます。
脂肪酸は水に不溶性ですが、胆嚢から十二指腸に分泌される胆汁中に含まれる胆汁酸やホスファチジルコリンやコレステロールによって乳化されたミセルを形成します。ミセルというのは、水になじむ部分(親水基)と油になじむ部分(親油基)をもつ物質が、水の中で親水基を外に親油基を内に向けて球状に会合した粒子です。ミセルは水溶性で受動拡散によって消化管粘膜の吸収上皮細胞内に吸収されます。
脂肪酸が腸管から吸収されるとき、脂肪酸の大きさ(炭素鎖の長さ)の違いによって代謝のされかたが異なります。炭素数が13以上の長鎖脂肪酸の場合は、腸壁を通り抜けると、腸管粘膜上皮細胞内で再びグリセロールと結合して中性脂肪(トリグリセリド)になり蛋白質などと一緒になってカイロミクロンというリポ蛋白質粒子になります。カイロミクロンはリンパ管から胸管に入り、鎖骨下静脈から大循環系に入って全身に運ばれます。主に脂肪組織や筋肉組織に取込まれ、一旦貯蔵されてからグリコーゲンが枯渇したときに分解されて、ゆっくりと消費されます。つまり、長鎖脂肪酸はエネルギーとして代謝されにくく、体脂肪として蓄積されやすい脂肪酸です。
炭素数が8~12の中鎖脂肪酸は胆汁酸によるミセル化は不要で、小腸吸収細胞に容易に吸収され、分子が小さいことから腸管で毛細血管に吸収され、長鎖脂肪酸のように中性脂肪に再合成されず、カイロミクロンを作らずに遊離脂肪酸のまま門脈に入って肝臓へ運ばれ、速やかにエネルギー源となって代謝されます。中鎖脂肪酸は肝細胞内のミトコンドリアに入り、炭素分子が1つおきに酸化されるβ酸化という過程に入ってアセチルCoA を生じてTCA 回路に入って代謝されますが、ブドウ糖の補給が少ない状況ではアセチルCoAはケトン体産生に利用されます。
脂肪酸がβ酸化のためにミトコンドリアに取込まれるとき、長鎖脂肪酸はL-カルニチンが必要ですが、中鎖脂肪酸はL-カルニチンの助けなしにミトコンドリア内に入って速やかに代謝されます。中鎖脂肪酸はエネルギーとして燃焼される効率が高く、体脂肪として蓄積しにくい脂肪酸です。
中鎖脂肪酸は長鎖脂肪酸より約4倍も吸収が速く、代謝も5~10 倍も速いと言われています。このように中鎖脂肪酸のエネルギー利用速度は速いので、激しい運動の持続時間を延長する効果も報告されています。また、長鎖脂肪酸は感染防御や免疫系に負荷がかかりますが中鎖脂肪は影響が少なく、また組織への蓄積傾向や臓器障害のもととなる脂質過酸化反応も少ないためより安全に摂取できると言われています。
長鎖脂肪酸は糖類が存在するとケトン体産生が抑えられますが、中鎖脂肪酸からケトン体を作る経路は糖質の影響をほとんど受けずにケトン体が多量に産生されます。肝臓ですぐに分解される中鎖脂肪酸を利用するとケトン体を大量に産生することができます。(下の図と表)


このような特徴のある中鎖脂肪酸を多めに摂取して、カロリーが多くならないように糖質を制限すると、脂肪酸のβ酸化を亢進することができます。30~40%のカロリー制限の効果には及ばないかもしれませんが、中鎖脂肪酸の摂取を増やせば、カロリー制限の程度を低下させることができるかもしれません。
糖質制限をすれば、インスリン/インスリン様成長因子のシグナルとPI3K/Akt/mTOR系が抑制されるので、理論的には相乗効果が期待できると考えられます。また、脂肪酸のβ酸化が転写因子のFOXOを活性化するので、脂肪酸のβ酸化を亢進することががん細胞の増殖抑制につながる可能性も示唆されます。
つまり、上記の論文は、中鎖脂肪ケトン食の抗がん作用を支持していると思います。
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
| « 317)カロリー... | 319)にきび(a... » |



