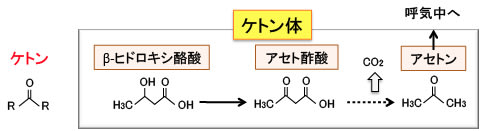
図:肝臓で生成されたケトン体(アセト酢酸とβ-ヒドロキシ酪酸)は肝臓以外の組織の細胞に運ばれミトコンドリアのTCA回路と電子伝達系でATP産生に使われる。すなわち、βヒドロキシ酪酸からアセト酢酸への変換時とTCA回路での反応でNADHやFADH2に捕捉された電子は電子伝達鎖で受け渡され、最終的にATP合成酵素によってATPが合成される。
【インスリンの作用が正常ならケトン体は全く無害】
ケトン体は19世紀中頃に糖尿病性ケトアシドーシスの患者の尿に大量に含まれることから最初に見つかったので、「ケトン体は糖代謝の異常によって生成される毒性のある代謝産物である」とこの時代の医師の多くが認識していました。
「ケトン体は食事からの糖質や糖原性アミノ酸(glucogenic amino acid)の供給が不足したときに、肝臓で産生が増える正常な代謝産物である」ことに医者が理解するのに半世紀を要しています。
しかし残念なことに、「絶食やケトン食によって正常な人間に起こる安全で生理的なケトン症(ケトーシス)」と「インスリン欠乏性の糖尿病患者にみられる病的で制御不能なケトアシドーシス」の違いを理解できていない臨床医がまだ存在することです。
ケトーシス(ケトン症:ketosis)は血中のケトン体が増加した状態です。ケトン体のアセト酢酸とβ-ヒドロキシ酪酸は酸性が強いので、ケトン体が血中に多くなると血液や体液のpHが酸性になります。このようにケトン体が増えて血液や体液が酸性になった状態をケトアシドーシス(ketoacidosis)と言います。
糖尿病性ケトアシドーシスは主に1型糖尿病患者に起こり、インスリンが不足した状態で脂肪の代謝が亢進し、血中にケトン体が蓄積してアシドーシス(酸性血症)を来たし、ひどくなると意識障害を来たし、治療しなければ死に至ります。このように糖尿病の人では血液中のケトン体濃度の上昇は糖尿病の悪化を示すサインとして知られていますので、ケトン体は体に悪い物質と思われる方が多いと思います。しかし実際は、インスリンの働きが正常である限りケトン体は極めて安全なエネルギー源です。
血液には緩衝作用があるので、長期の絶食によって達しうる6~8mM程度の高ケトン血症ではアシドーシス(酸性血症)にはなりません。
ケトン体は肝細胞と赤血球(ミトコンドリアが無い)を除く全ての細胞で利用でき、日常的に産生されています。糖質を普通に摂っている人での血中ケトン体(アセト酢酸とβヒドロキシ酪酸の合計)の基準値は26~122μmol/lです。
絶食すると数日で血中ケトン体は基準値の30~40倍もの高値になりますが、インスリンの作用が保たれている限り安全です。一時的に酸性血症(アシドーシス)になることもありますが、血液の緩衝作用によって正常な状態に戻ります。
つまり、ケトン体の上昇が怖いのは、インスリンの作用不足がある糖尿病の場合で、糖尿病性ケトアシドーシスはインスリン作用の欠乏を前提とした病態です。断食や糖質制限に伴うケトン体産生の亢進の場合は生理的であり、インスリン作用が正常であれば何の問題もないと言えます。
【絶食でなぜケトン体が産生されるのか】
長期におよぶ絶食のときにはケトン体が脳のエネルギーの60%以上を供給しています。したがって、グルコースを1日80gも節約でき、もしケトン体が供給されなければ体のタンパク質を分解してエネルギー源を産生することになります。
飢餓状態の時にケトン体を産生するのは、食事が摂れないときに体を動かすエネルギーを作り生命を維持するためです。
血液には緩衝作用があるので、非糖尿病の人間であれば、長期間の絶食によって血中のケトン体のレベルが6~8mM程度まで上昇しても臨床的に危険なアシドーシス(酸性血症)にはなりません。
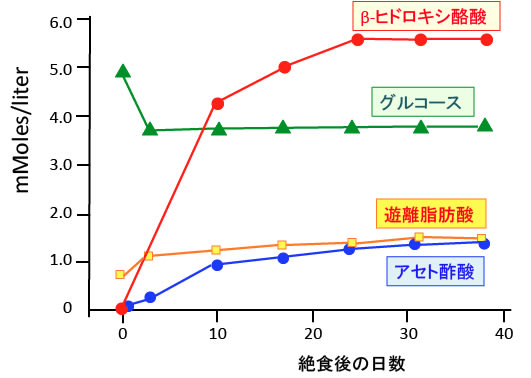
肥満者が絶食した場合の血中のグルコース、β-ヒドロキシ酪酸、アセト酢酸、遊離脂肪酸の推移が報告されています。(New Eng J Med 282: 668-675, 1970年)
グルコースの分子量は180でβヒドロキシ酪酸の分子量は104です。下図でグルコースの4mMは72mg/dl、5mMは90mg/dlになります。絶食を長期間行ってても、肝臓で糖新生が起こるので、血糖は4mM前後に維持されます。
一方、絶食を行うとアセト酢酸とβ-ヒドロキシ酪酸は上昇し、特にβ-ヒドロキシ酪酸は6mM程度まで増えます。β-ヒドロキシ酪酸の分子量は104なので、6mMは62.4mg/dlになります。
図:肥満者に40日間の絶食を行った場合のβ-ヒドロキシ酪酸、アセト酢酸、グルコース、遊離脂肪酸の血中濃度の推移。(出典:N Eng J Med. 282: 668-675, 1970年)
絶食でケトン体産生が起こる理由を理解するためには、次の4つの生理学的な事実を知る必要があります。
1)体内にはグルコースの直接的な供給源であるグリコーゲンの貯蔵量は少量しかない。肝臓には~100g程度、筋肉には~400g程度のグリコーゲンが貯蔵されているが、これは半日~1日のエネルギー量に過ぎない。
2)体内のタンパク質の貯蔵は少量しかない。
3)人間の体内の脂肪組織には大量の中性脂肪が貯蔵されている。この中性脂肪は標準的な体格の人で約2ヶ月分のエネルギーの貯蔵に相当する。
4)炭素数が12以上の長鎖脂肪酸は血液脳関門を通過できない。
これらの条件から、食事が摂れないときには、中性脂肪を燃焼させてケトン体を産生し、そのケトン体が脳のエネルギー源として利用されるように体が適応するように進化したと考えられます。
正常な体型の70kgの男性では、体内には12kgの中性脂肪がエネルギー源として貯蔵されています。筋肉量は約6kgであり、糖質(グリコーゲンとして)の貯蔵量は肝臓にせいぜい100g程度、筋肉には400g以下しかありません。
通常はグルコースが脳のエネルギー源となっています。
一晩の絶食によって、血糖値を上昇させるグルカゴンの分泌が増え、インスリンの分泌は減少します。その結果、脂肪組織から脂肪酸が遊離し、筋肉組織での脂肪酸の利用が増え、肝臓ではケトン体の産生が増えます。
しかしながら、糖質欠乏の初期の段階では血中のケトン体の濃度はまだ低く、脳のエネルギー源はまだグルコースに大きく依存しています。
摂取カロリーが減ると、脂肪組織から脂肪酸と一緒に遊離したグリセロールを使って肝臓で糖新生が起こります。あるいは、貯蔵されたタンパク質が分解して生成するアミノ酸のうちの糖原性アミノ酸を使って肝臓で糖新生が行われるます。
さらに絶食状態が続くと、糖新生が十分に行われなくなり、肝臓は脂肪酸の分解で精製されたアセチル-Coアからケトン体を産生するようになるのです。(トップの図を参照)
ポジトロン・エミッション・トモグラフィー((陽電子放射線断層撮影: PET)を使ったラットの研究では、ケトン食や絶食のときには、脳のケトン体の取込みは通常の7~8倍に増加することが示されている。
【ケトン体を増やせばがん細胞は死滅する】
がん細胞ではケトン体をエネルギーに変換する酵素系の活性が低下しているので、ケトン体をエネルギー源として利用できません。
また、がん細胞では細胞を増やすために脂肪酸を合成する酵素系の活性が非常に高くなっていますが、逆の脂肪酸を分解してエネルギーを産生する酵素の活性は低下しています。
つまり、体内のグルコース(ブドウ糖)の量を減らし、脂肪酸の分解でATPを得ている体内状況を作り出せば、ミトコンドリアの機能が正常な正常細胞は脂肪酸の代謝によってATPを効率的に産生できるので生存できるのに対し、がん細胞は脂肪酸からATPを産生できないためエネルギーが枯渇して死滅するのです。
さらに、ケトン体のアセト酢酸とβ-ヒドロキシ酪酸にはそれ自体に抗がん作用があります。がん細胞と正常線維芽細胞の培養細胞を使った実験で、培養液にアセト酢酸やβヒドロキシ酪酸を添加すると、正常な線維芽細胞の増殖は阻害されず、がん細胞の増殖は用量依存的に抑制されることが報告されています。ケトン体ががん細胞のブドウ糖の取り込みと代謝を阻害するためだと考えられています。また、がん細胞を移植した動物実験でも、ケトン体を多く出させる中鎖脂肪酸の豊富な高脂肪食を与えると、腫瘍の成長が抑えられ、がんによる体重の減少を防ぐ事が報告されています。
図:がん細胞ではブドウ糖の取込みが亢進している。ブドウ糖の摂取で分泌が増えるインスリンはがん細胞の増殖を刺激する。脂肪の分解でできるケトン体をがん細胞はエネルギー源として利用できない。さらに、ケトン体自身にがん細胞の増殖を阻害する作用がある。正常細胞はブドウ糖もケトン体も効率的に利用できる。糖質の摂取を減らし、脂肪の分解でできるケトン体を多く産生する食事はがん細胞の増殖を阻害し、死滅させる効果がある。
ケトン食でケトン体を増やす治療法の他に、最近は体内でケトン体に変換されるケトン体前駆物質を食事から摂取させる研究が報告されています。ケトン食を実施しなくても、糖質を普通に摂取しても、ケトン体前駆物質を食事から摂取することで、がん細胞の増殖を抑えることを目的としています。
以下のような論文があります。
Ketone supplementation decreases tumor cell viability and prolongs survival of mice with metastatic cancer.(ケトン体の補給はがん細胞の生存率を低下させ、転移がんのマウスの生存期間を延長する)Int J Cancer. 2014 Feb 26. doi: 10.1002/ijc.28809. [Epub ahead of print]
【要旨】
がん細胞は遺伝子変異とミトコンドリアの機能異常によってグルコースの消費量が顕著に増加している。がん細胞は正常細胞と異なり、ケトン体をエネルギー源として利用できないことが知られている。
さらに、培養がん細胞を使った実験で、ケトン体はがん細胞の増殖や生存を阻害することが示されている。
がん細胞における解糖系亢進というワールブルグ効果は増殖の早い転移がんに顕著に認められる。そこで、食餌にケトン体を加えて与えると、生体内においてがんの転移を阻害する作用が期待できる。
高度に転移性の性状をもつVM-M3細胞をケトン体のβヒドロキシ酪酸を添加した培養液で培養して細胞増殖や生存率を測定した。
オスのVMマウスに、ホタル・ルシフェラーゼで標識して発光するように改変した転移性のがん細胞(VM-M3)を移植し、体内でケトン体(βヒドロキシ酪酸とアセト酢酸)に変わる1,3-ブタンジオール(1,3-butanediol)またはケトンエステル(ketone ester)を食餌に添加して、腫瘍組織の増殖に対する影響を検討した。腫瘍の増殖は生体内蛍光イメージ法(in vivo bioluminescent imaging)で評価し、生存期間、腫瘍増殖速度、血糖値、血中βヒドロキシ酪酸値、体重を測定した。
培養細胞を使ったin vitroの実験では、グルコース濃度が高い条件でも、ケトン体の投与によってVM-M3細胞の増殖と生存は減少した。
移植腫瘍の実験モデルでの検討では、食餌からのケトン体の補給はVM-M3を移植して全身に転移した状態のマウスの生存期間を延ばし、1,3-ブタンジオールの投与で51%、ケトンエステルの投与で69%の生存期間の延長を認め、これは統計的に有意な差であった(p<0.05)。
ケトン体の投与は、血糖値のレベルやカロリー制限とは独立して培養細胞(in vitro)および移植腫瘍(in vivo)の実験モデルで抗腫瘍効果を示した。
将来の臨床試験へ向けて、ケトン体の前駆物質の補給によるがん治療の有効性と安全性を動物実験でさらに検討する必要がある。
この論文は南フロリダ大学の高圧生体医学研究所(Hyperbaric Biomedical Research Laboratory at the University of South Florida)のドミニク・ダゴスチノ博士(Dr. Dominic D’Agostino)の研究室からの報告です。
この研究グループは今回と同じ悪性度の高い転移性のがんを移植するマウスの実験モデルで、ケトン食と高圧酸素療法を組み合わせた治療で生存期間を延ばすことを報告しています。(詳しくは
こちらへ)
ケトン食はエネルギー産生の栄養素を糖質から脂質にシフトさせ、脂質の代謝によってできるケトン体の産生を増やす食事です。
正常な細胞は、エネルギー源が糖質(グルコース)からケトン体に代わっても容易に適応できます(ケトン体をエネルギー源として利用できる)。しかし、がん細胞はケトン体を利用するというエネルギー産生における適応能力が欠けています。したがって、糖質摂取が減ってグルコースの利用ができなくなると、がん細胞が選択的にダメージを受けることになります。
この論文では、直接的にケトン体を食餌から摂取させる方法で実験して、グルコース濃度が高い状態でもケトン体自身に抗腫瘍効果があることを示しています。
穀物のデンプンが消化管で分解されてグルコースとして吸収されてエネルギー源となるように、体内でケトン体になってエネルギー源となるような食品が開発されればケトン食も楽になります。
この研究で使用されている1,3-ブタンジオールやケトンエステルは人間が食べられるようなものではなく(味と価格から)、まだケトン体そのものを食事から摂取することは現実的ではありません。β-ヒドロキシ酪酸も原料として入手は可能ですが、1日100gを食べると1ヶ月で数十万円になるような状況ですので、まだ現実的ではありません。
中鎖脂肪酸中性脂肪(中鎖脂肪酸トリグリセリド)を多く摂取するケトン食の方が現時点では現実的です。つまり、現時点では低糖質食にケトン体の産生を増やす中鎖脂肪酸を多く摂取するのが最も実施できる方法と言えます。
多くの研究で、血中のケトン体濃度を高めるほど抗腫瘍効果が高まることが報告されています。
その当たりの考察はこの論文のイントロダクション(Introduction)と考察(Discussion)を読めば納得できると思いますので、この論文のイントロダクションと考察の部分の抜粋を以下に記載しておきます。
【インドロダクションの日本語訳】
約1世紀前、「がん細胞は酸素が十分に存在する状況でも酸素を使わずに乳酸を生成する解糖系が亢進している」という特徴的な代謝異常をオットー・ワールブルグ博士が発見し、この現象はワールブルグ効果として知られている。
このワールブルグ効果によってがん細胞はグルコースの取込みが非常に亢進しており、これを利用したのがグルコースを標識した18F-フルオロデオキシグルコースの取込みでがん組織を画像化するFDG-PET検査の原理になっている。
従来の毒性のある抗がん剤治療に代わって、代謝異常をターゲットにした新しいがん治療法が検討されている。
がん細胞の生存と増殖におけるグルコースへの依存度が高いことががん細胞の弱点になっている。
絶食やカロリー制限や低糖質ケトン食はがん細胞のグルコース利用を制限することによってがん細胞の増殖速度を低下させることが多くの動物実験や臨床試験で確認されている。
このような食事療法は、グルコースへの依存度が高いがん細胞の代謝環境を、がん細胞の増殖に都合の悪い代謝環境に変更させることになる。
これらの食事療法の抗腫瘍効果は血中を循環するグルコースの量を減らすことによってがん細胞へのエネルギー供給を減らすことが主な作用機序と考えられてきた。しかし、最近の研究結果より、血中ケトン体の上昇自体に抗腫瘍効果が認められることが示されている。
最近、Fine博士の研究グループが、進行した転移がんの患者において、糖質を制限したケトン食が、がんの増殖や進展を抑制し、腫瘍を縮小させる効果があることを報告している。
この研究では血糖値の低下は認めず、グルコースの利用の阻害が抗腫瘍効果の直接の原因ではないことを示している。興味深いことに、この食事療法による抗腫瘍効果は血中のケトン体の量が最も関係しており、ケトン体が多く産生された場合ほど、腫瘍の縮小や安定の効果が得られている。
主なケトン体はアセト酢酸とβ-ヒドロキシ酪酸で、アセト酢酸から非酵素的に分解してアセトンが生成されるが、アセトンは呼気から排出される。
培養がん細胞を使った実験では、ケトン体のアセト酢酸は増殖の早いヒト大腸がんと乳がん細胞の増殖とATP産生を阻害したが、正常な線維芽細胞の増殖は阻害しなかった。
同様に、β-ヒドロキシ酪酸は形質転換したリンパ芽球細胞、Hela細胞、悪性黒色腫細胞の増殖を用量依存的に阻害した。
神経芽細胞腫に対しては、βヒドロキシ酪酸とアセト酢酸は生存率を低下させ、アポトーシスを誘導したが、正常線維芽細胞には増殖抑制作用は示さなかった。
ケトン体は肝臓と赤血球以外の細胞でエネルギー源として利用される。(注:肝臓はケトン体を合成するがエネルギー産生に利用するための酵素がない。赤血球はミトコンドリアが無いのでケトン体は代謝できない)
しかし、がん細胞はケトン体をエネルギー源として利用することができない。その理由は、多くのがん細胞ではミトコンドリアの数が少なく、ミトコンドリアの構造的異常も多く、その他様々な原因でミトコンドリアの機能が低下しており、ケトン体をエネルギー源として利用できないためである。
ケトン体はミトコンドリアで代謝されてエネルギー(ATP)を産生するので、ミトコンドリアの機能が低下しているがん細胞ではケトン体を十分に利用できない。
実際、グルコースの枯渇によって誘導されるグリオーマの細胞死をケトン体は阻止できない。(つまり、グリオーマ細胞はケトン体を利用できない)
このようにがん細胞におけるミトコンドリアの異常が、がん細胞がケトン体をエネルギー源として利用できない理由と考えられるが、培養細胞を使った実験でグルコースが正常の濃度存在するのにケトン体を添加するとがん細胞の増殖が抑制される理由を説明できない。
これは、ケトン体自身にがん細胞の増殖や生存を阻害する直接的な作用を有する可能性を示唆している。
例えば、次のような可能性がある。
(1) ケトン体は解糖系を阻害するので、がん細胞の主要なエネルギー産生系が低下する。
(2) がん細胞は活性酸素の産生が多い環境で生存できるが、レドックス(酸化還元)状態のわずかな変化にも非常に感受性が高く反応する。ケトン体は正常細胞に対してはミトコンドリアでの活性酸素の産生を減らし、内因性の抗酸化活性を高めるが、がん細胞に対してはそのような作用は認めない。そのため、がん細胞の近くの正常細胞におけるケトン体の代謝は、がん細胞の生存にとって不利なレドックス環境を作り出すことによって、がん細胞の増殖を阻害している可能性がある。
(3) ケトン体はモノカルボン酸トランスポーター(monocarboxylate transporters:MCT)を使って細胞内に取り込まれる。このMCTはがん細胞内に多く産生される乳酸を細胞外に排出するトランスポーターでもある。MCT活性の阻害や乳酸の排出阻害はがん細胞の増殖と生存を著明に阻害する。ケトン体はモノカルボン酸トランスポーターを競合的に阻害することによってがん細胞からの乳酸の排出を阻害することによってがん細胞の増殖と生存を阻害する可能性がある。
(4) 最近 Verdin らのグループは、βヒドロキシ酪酸には内因性のヒストン脱アセチル化酵素阻害剤 としての作用があることを報告している。絶食やカロリー制限やケトンエステルによるケトン体の補給で容易に達しうる数ミリモルの濃度でヒストン脱アセチル化酵素阻害作用を示すので、がん遺伝子やがん抑制遺伝子の発現に影響してがん細胞の増殖や生存を抑制する可能性がある。
このように、ケトン体はがんの代謝をターゲットにした様々な特徴的な作用を示すことが報告されている。
ワールブルグ効果は増殖速度の早いがん細胞や転移性のがん細胞のおいて特に強く発現している。
転移というのは、がん細胞がもとの場所(原発巣)から離れた別の部位に腫瘍を形成することで、がんによる死亡の90%以上は、がんが転移することによって起こっている。がんの治療成績がなかなか良くならない最も大きな理由は、全身に転移したがんに対する有効な治療法が無いためであり、またそのような治療法や治療薬の開発に有用な実験モデルがないためである。
本研究で用いたVM-M3モデルはがんの自然の進展やがん細胞の浸潤や転移の研究に有用な実験モデルである。元のVM-M3主要はVM/Dkマウスに自然発生した脳腫瘍で、培養細胞として樹立され、ホタル・ルシフェラーゼ遺伝子を導入してその蛍光によって生体内で腫瘍の増大を観察できるように改変されたがん細胞である。
VM-M3細胞はマクロファージやミクログリアの性質を兼ね備えたヒトの膠芽腫に特徴的な性質を持っている。皮下に移植すると、形態学的に組織球のような形態に変化し、肝臓や肺や腎臓や脾臓や脳や骨など全身に転移する。
VM-M3細胞は免疫システムが正常なマウスにおいて自然に転移し、抗がん剤治療によって転移や増殖が抑制される。このようにVM-M3実験モデルはがんの転移のモデルとして有用であるので本実験で用いた。
ケトン体が培養がん細胞の増殖を抑制することは多くの研究で示されている。しかし、生体内におけるがん細胞の増殖に食餌性のケトン体の補給ががん細胞の増殖にどのような作用を示すのかまだ検討されていない。
糖質制限によるケトン食を行わなくても、ケトン体の前駆物質である1,3-ブタンジオール(食品添加物および血糖降下物質として市販されている)を食餌に添加することによって、肝臓でβヒドロキシ酪酸に変換されて体内のケトン体レベルを高めることができる。
ケトンエステルはアセト酢酸とβヒドロキシ酪酸の量を用量依存的に高めることができ、通常のケトン食や治療用の絶食よりもケトン体を高めることができる。
1,3-ブタンジオールおよびケトンエステルを経口投与するとラットにおいて240分間以上、血中ケトン体レベルを高めることができる。
ケトン体は抗腫瘍効果を示し、またがん細胞の転移はがんの治療における最も困難な障害であるので、VM-M3細胞株を用いたがん転移の実験モデルで、ケトン体の補充療法の有効性を検討した。
【考察の日本語訳(抜粋)】
全てのがん細胞ではないにしても、ほとんどのがん細胞では解糖系が亢進しているというワールブルグ効果を示している。がん細胞の代謝異常をターゲットにしたがん治療は有効な治療法となりうるので、がん細胞における代謝の特徴を明らかにすることは重要である。
がん細胞ではミトコンドリアの異常によってエネルギー産生や代謝の過程において様々な欠損が存在し、そのため、ケトン体をエネルギー源として有効に利用できない。
この研究において、ケトン体の補給はVM-M3細胞の増殖能と生存率を低下させることが示された。他の培養がん細胞の実験系でも同様の結果が得られており、今回の結果は今までの報告をさらに支持するものである。
したがって、我々は、ケトン体の前駆体を食餌から投与することは生体内のがん細胞に対しても同様に増殖を抑制することができると推測した。
実際に、ケトン体の前駆物質である1,3-ブタンジオールおよびケトンエステルを食餌に混ぜて投与すると、転移したVM-M3移植腫瘍をもつマウスの生存期間をそれぞれ51%と69%延長させた。
これらのデータはケトン体の補給という治療法が実施可能で有効ながん治療であることを示しており、臨床での利用の可能性を確かめるために、さらに他の動物実験モデルなどで検討する必要がある。
急速にケトン体を補給すると血糖値が低下する。長期に渡って補給すると体重が減少する。正常なマウスおよびがん細胞を移植されたマウスの両方において、高糖質の食餌を与えていても、ケトン体を供給するとケトン症を維持することができる。
今回の実験では、正常なVm/DkマウスとVM-M3がん細胞を移植されて7日後のマウスにおいて、1.3-ブタンジオールとケトンエステルを食餌に混ぜて投与すると、血中のケトン体の濃度を12時間以上にわたって著明に高めることができることが示された。
以前は、がん治療における食事療法の研究はワールブルグ効果をターゲットにした糖質制限やカロリー制限が主な対象になっていた。
カロリー制限は様々ながんの実験モデルにおいて、がんの進行を遅くする効果が示されている。
食事で誘導されたケトン症はしばしば食欲を低下させ、そのためにカロリー摂取が減り、体重が減少する。そのため、ケトン体の補給による抗腫瘍効果は間接的にカロリー制限が関与している可能性がある。
興味深いことに、カロリー制限は血糖値を低下させ血中ケトン値を上昇させるが、カロリー制限マウスは対照群と比べて腫瘍の進展を遅くし生存期間を延ばす傾向は認められたが統計的な有意差は認められなかった。
ケトン食の抗腫瘍効果の多くは上昇したケトン体によるものであることが幾つかの実験結果から示されている。
恐らく、外来性の食事からのケトン体の補充やケトン食によるケトン体の上昇は、カロリー制限などで起こる脂肪酸の燃焼によって誘導される内因性のケトン体産生よりも、がん治療法としてより効果が高いと予想される。
さらに、ケトン体の補給はカロリー制限よりも筋肉量の維持においてより効果が高いので、健康状態を高める目的ではカロリー制限よりもケトン体の補給の方がメリットがあると思われる。
カロリー制限のマウスは腫瘍進行までの期間や生存期間を延ばす傾向を示し、体重減少は生存期間と相関していた。したがって、ケトン体の補給による抗腫瘍効果が間接的にカロリー制限の効果が関与している可能性は示唆されるが、ケトン体の補給による抗腫瘍効果の全てを説明することは困難である。それはケトン体を補給されたマウスの生存期間の延長はカロリー制限のマウスよりも顕著に長いからである。
しかも、1,3-ブタンジオールは生存期間を51%延長させたが、血糖値はコントロールと比べて差がなかった。これは、ケトン体補給による抗腫瘍効果はグルコースの利用の低下によるもので無いことを示している。
ケトンエステルの投与は1,3ブタンジオール投与群に比べて69%の生存期間の延長を認めた。
注目すべき点は、ケトンエステルを投与された群では1,3ブタンジオール投与群より血糖値と体重はより減少し、血中ケトン体はより高値を示した。これは、間接的なカロリー制限と、1,3ブタンジオール投与よりもケトンエステル投与の方がより効果が高いことを示している。
培養VM-M3細胞を使ったin vitroの実験では、5mMのβヒドロキシ酪酸を培養液に添加すると、25mMのグルコースの入った培養液でもVM-M3細胞の増殖を抑制し生存率を低下させた。
実際に、ケトン体の添加は、VM-M3細胞の増殖と生存率の抑制において、グルコースの濃度を3mMに制限するのと同じレベルの効果を認めた。
これらの結果は、ケトン体が糖質制限やカロリー制限とは独立にがん細胞の増殖を抑制するというFine博士やその他のグループのin vitroおよびin vivoでの研究結果を支持している。
Listanti博士のグループは腫瘍組織に存在する線維芽細胞(tumor-associated fibroblasts)がケトン体を産生してがん細胞にエネルギー源として供給しているという実験結果を報告している。これらの報告において、著者らはケトン体合成の律速酵素を遺伝子改変で過剰発現させた不死化した線維芽細胞と、ケトン体を利用できる酵素を過剰発現するように遺伝子改変した乳がん細胞を一緒に培養する実験系で検討している。
しかし、この現象は著者らによって作られた実験系で起こっていることであり、このような現象が自然の生体内で起こっているという証拠はない。
前述のように、多くのがん細胞はケトン体をエネルギー源として有効に利用できないことを多くの研究結果が強く示している。
多くのがん細胞は、ケトン体を利用する際に必要な酵素であるサクシニルCoA 3-ケト酸CoAトランスフェラーゼ(succinyl CoA 3-ketoacid CoA transferase)を発現していない。培養がん細胞の研究で、がん細胞はケトン体を利用できないことが報告されている。
また、ケトン体の産生はほとんどが肝臓で行われることは広く知られている。線維芽細胞がグルコースからケトン体を産生する代謝系は知られていない。
自然の細胞環境においてこの現象を支持する証拠が無い以上、がん細胞がエネルギー源としてケトン体を有効に利用できないという事実は正しいということになる。
ケトン食は放射線治療と抗がん剤治療の両方の抗腫瘍効果を増強することが報告されている。
ケトン体を食事として補給することはケトン食によって誘導される生理的なケトン症と同じような効果を示す。がんの標準治療とケトン体補給とを組み合わせることは標準治療とケトン食との併用と同様の効果が期待でき、ケトン体の補充療法はたとえ普通の食事を行っていても効果が期待できる。
さらに、ケトン体は神経細胞を保護する効果があることが知られている。
ケトン体はミトコンドリアにおける活性酸素の産生を減らし、内因性の抗酸化力(抗酸化酵素と活性酸素消去物質)を増強することによって正常細胞を酸化傷害から守る作用がある。
放射線治療と抗がん剤治療はがん組織において活性酸素の産生を高めることによって抗腫瘍効果を発揮するが、同時に正常組織にもダメージを与える。ケトン体は正常細胞における酸化ストレスを軽減する作用があり、がんの標準治療の副作用を軽減する効果がある。
我々のデータは、ケトン体を補給する治療は安全で実現可能で、かつ費用対効果の高いがん補助療法となりうることを示唆している。したがって、この治療法を前臨床試験や臨床試験で検討する必要がある。
β-ヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害することによって、エピジェネティックな遺伝子発現調節作用によって抗酸化力の増強や寿命延長効果があることは
322話で解説しています。
で紹介しています。
体内で直ぐにケトン体(アセト酢酸かβ-ヒドロキシ酪酸)になるケトン前駆物質が安価に入手できるようになれば、このケトン前駆物質を砂糖やデンプンのように食事に添加して、体内のケトン体の濃度を高めるがん治療が実現できるかもしれません。しかし、現時点では、1,3-ブタンジオールやケトンエステルを1日100g以上摂取する場合の安全性は確立されておらず、この摂取量では極めて高額な費用になるので現実的ではありません。そのうち、安全で安価なケトン体前駆物質が開発される可能性はあります。
現時点では、肝臓で代謝されてケトン体を迅速に産生し、安全性が確立されている中鎖脂肪酸トリグリセリド(MCTオイル)を摂取して、肝臓でケトン体を産生させる方が安価で安全です。
参考文献
Starvation in man. New Eng J Med 282:668-675, 1970年
Ketoacids? Good medicine? Trans Am Clin Climatol Assoc. 114:149-61, 2003年
Ketone supplementation decreases tumor cell viability and prolongs survival of mice with metastatic cancer.Int J Cancer. 2014 Oct 1;135(7):1711-20.


画像をクリックするとサイトに移行します。