20220331
1月は往ぬる
2月は逃げる
3月は去る
というけれどホントだねぇ。
・世界のブースター接種率

・ワクチン先進国のブースター接種率
Our World in Data
・ワクチン先進国の感染者数(100万人あたり)
Our World in Data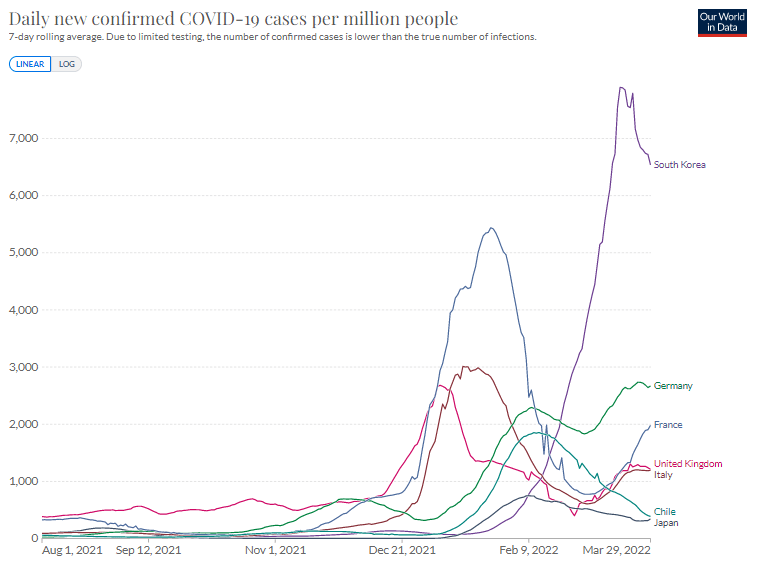
目指せ ワクチン先進国
ワクチン先進国 
世界一の座もあと一息だ 

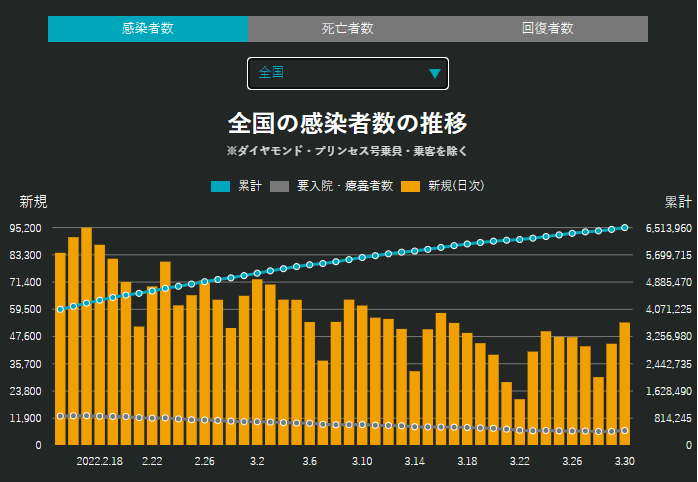
増えだした。
政府とマスコミは3回目接種を急げというだろう。
家畜国民は何も考えずにブースターを打つだろう。
ADE(抗体依存性感染増強)と免疫抑制で感染者と死亡者は増え続け、止まらなくなるだろう。
かくして、ニッポンは世界のワクチン大規模接種の実験場になるだろう。
鹿Dr.が動画の中で解説した論文をDeepLを使って翻訳します。
免疫学についてはずぶの素人なので、翻訳できたとしても内容はほとんど理解できませんが、勉強しながらやっていきます。
実験的自己免疫性脳脊髄炎治療のための非炎症性mRNAワクチン
自己免疫疾患治療の目標は、全身的な免疫抑制を引き起こすことなく自己反応性T細胞を制御することである。
そのため、自己免疫疾患治療薬の安全かつ効率的な送達が重要な課題となっている。
このような状況下において、薬学的に明確に定義された抗原を非炎症的に使用することができる。
ここでは、ナノ粒子を形成した1メチルシュードウリジン修飾メッセンジャーRNA(m1Ψ mRNA)を全身に送達することを明らかにする。
脾臓のCD11c+抗原提示細胞において、共刺激信号がない場合でも、疾患関連自己抗原をコードする抗原提示が行われることがわかった。
多発性硬化症のいくつかのマウスモデルにおいて このようなm1Ψ mRNAを投与すると、病気が抑制されることがわかった。
この治療効果は エフェクターT細胞が減少し、制御性T細胞(Treg細胞)集団が発達することである。
注目すべきは、これらのTreg細胞が強い傍観者免疫抑制を実行し、その結果、同族および非同族の自己抗原によって引き起こされる疾患を改善することである。
自己免疫疾患の治療のための抗原特異的な寛容化は、自己免疫を選択的に抑制する可能性がある。
正常な免疫機能を低下させることなく過去数十年間、DNA、合成ペプチド、組み換えタンパク質、コーティングされたナノ粒子、
または免疫調節細胞療法を用いた自己免疫抗原の送達など、様々なアプローチが研究されてきた。
しかし、臨床応用はまだなので、ほとんど、否定的か結論に至っていないものばかりである。
ヒトを対象とした試験で成果を上げ初期の臨床試験が行われているのはごく少数のアプローチに過ぎない。
その障害のひとつは、患者の自己反応性免疫細胞のレパートリーが多様であるため、自己免疫疾患がポリクローナルに複雑化することである。
個人差があるため、患者の自己抗原性免疫プロファイルに合わせた個別化治療か、あるいは傍観者寛容を媒介として、
広範な免疫抑制を行わずに自己免疫リンパ球の同定と非認知を抑制する治療が必要となる。
末梢性免疫寛容の生理学的誘導および維持は、CD86などの共刺激分子の低レベルの表面発現を伴うリンパ系抗原提示細胞(APC)による自己抗原の提示に基づいている。
我々は、自然の免疫寛容のメカニズムを模倣した治療法を開発しようとした。
最近、我々はmRNAをコード化したワクチン抗原(mRNA-LPX)をリンパ組織常在のCD11c+ APCに送達するためのリポソーム製剤を紹介した。
mRNAワクチン接種は、Toll様受容体(TLR)シグナル伝達時にAPCから放出される
高レベルのインターフェロン-α(IFN-α)によって駆動される強力な1型Tヘルパー(TH1)細胞応答を誘導する。
我々は、このようなヌクレオシドで修飾精製された mRNA(m1Ψ mRNA)を用いて、
自己免疫疾患標的抗原を非炎症状態でCD11c+ APCにin vivo送達することにより、
リンパ系組織における全身性の寛容な抗原提示が可能になる、との仮説を立てた。
(つづく)
今日はここまでとします。
専門用語がわからないので、翻訳が合っているのか違っているのかぜんぜんわからん。
ラピュタ語を解読したムスカ大佐のようにはいかないな~ 。
。
追記 2022.04.13
>自己免疫疾患治療の目標は、全身的な免疫抑制を引き起こすことなく自己反応性T細胞を制御することである。
これがポイントかもしれませんね。
つまりスパイクタンパクだけ免疫寛容するということです。
そうであれば全身の免疫低下にならないので問題ないです。
Youさん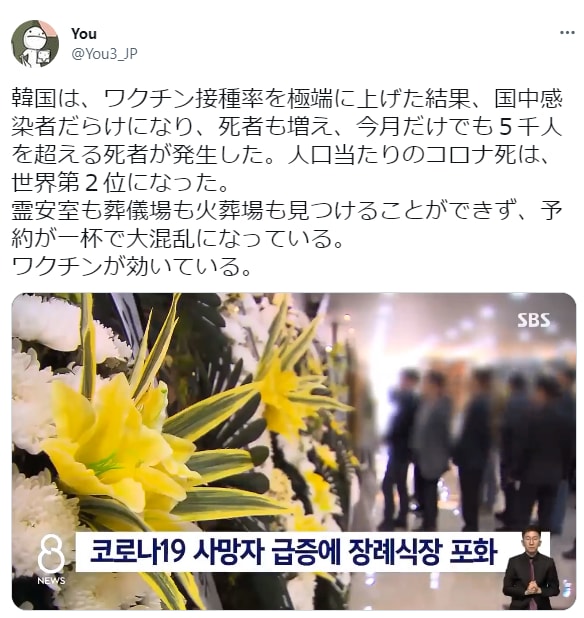
Youさん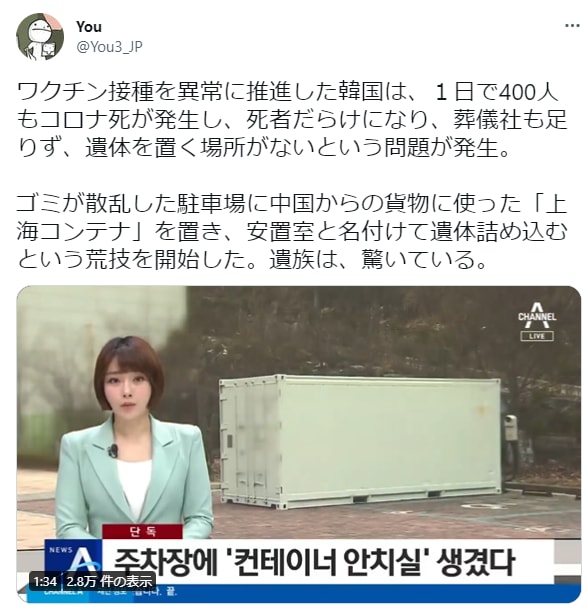
・新規感染者数(100万人あたり)
Our World in Data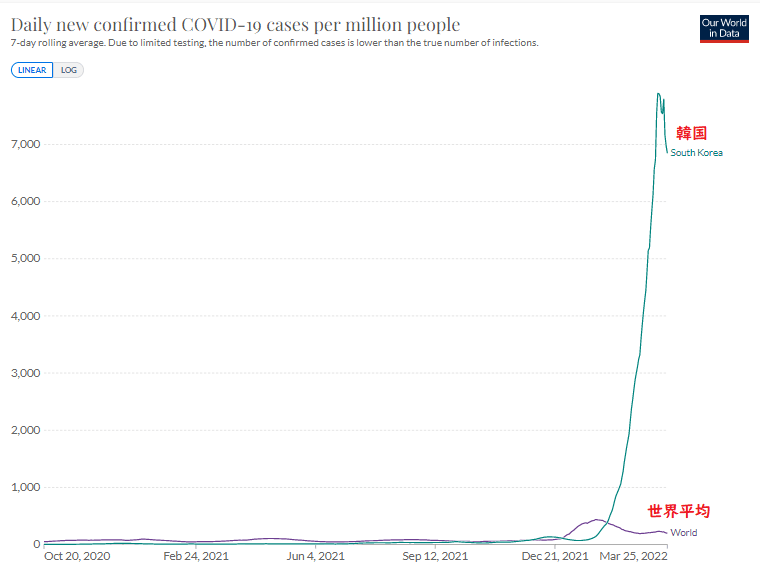
・新規死亡者数(100万人あたり)
Our World in Data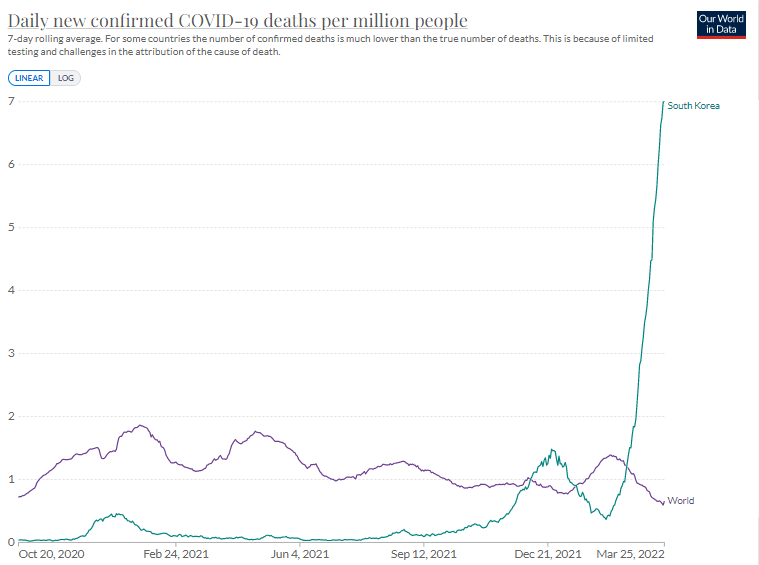
・2回ワクチン接種率
Our World in Data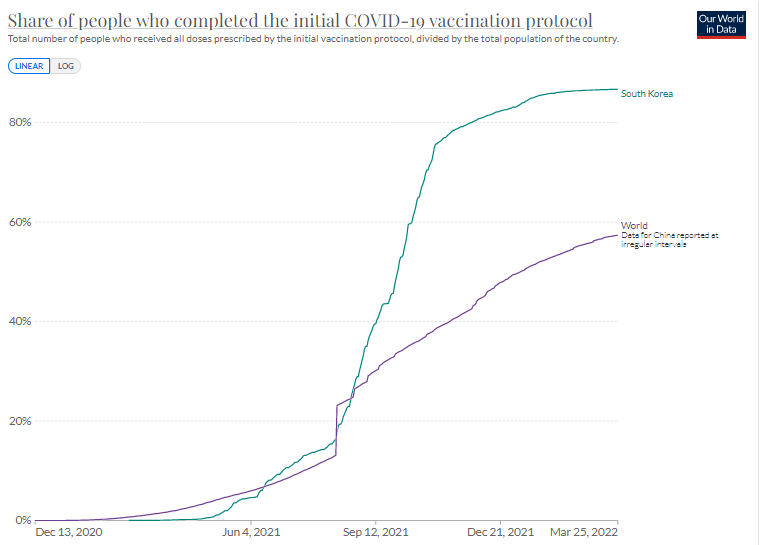
・ブースター接種率
Our World in Data
日本は1カ月遅れで韓国のあとを追っている。


Amazonで買いました。ちょうど半分読んだところです。
たいへん読みやすいです。私のような素人が読むには手ごろだと思います。
もっとも、読みやすさと解りやすさとは違います。
中身が詰まっているのですぐには頭に入りません。
記憶力が劣化しているので読んだはしから忘れます。
5回くらい読めば一通り理解できるのではないかと思っています。
Role of the antigen presentation process in the immunization mechanism of the genetic vaccines
against COVID-19 and the need for biodistribution evaluations
COVID-19に対する遺伝子ワクチンの免疫機構における抗原提示過程の役割と生体内分布評価の必要性
受付:2022年1月21日|改訂:2022年3月8日|受理: 2022年3月13日
従来のワクチンのメカニズムは、あらかじめ不活化(熱処理など)または弱毒化(最適でない増殖条件での複数回の継代など)されたウイルスを接種することで成り立っている。
このように急性感染を引き起こす能力を失ったウイルスは、免疫系に外来病原体としての認識を与え、特異抗体やメモリーTリンパ球の産生を促進する。
COVID-19に対する遺伝子ワクチンとして、EUで使用が許可されたアデノウイルスワクチン(AstraZeneca社、Janssen社製)とmRNAワクチン(Pfizer/BioNTech社、Moderna社製)は、
ヒト細胞がウイルス抗原を生成するための遺伝情報をコード化したもので、ヒトがウイルス抗原を生成するためには、このコード化された遺伝情報が必要である。
より正確には、前述のワクチンは、ヒト細胞のタンパク質合成機構に、SARS- CoV- 2のウイルスカプシドのスパイクタンパク質を翻訳させるよう誘導する。
リボソームによって翻訳されたスパイクタンパク質は、ゴルジ装置で処理され、2つの形態で免疫系に提示される。
ⅰ)タンパク質全体として細胞膜上に表示され、B細胞やTヘルパー細胞に認識される(図1A)、
ⅱ)主要組織適合複合体I(MHC I)にロードされたフラグメントの形態で、CD8+Tリンパ球に内因性抗原が提示される(図1B)。
免疫系は外来抗原を認識し、炎症反応を開始し、その後B細胞による特異的な抗体産生に至る。
ヒト細胞において、抗原提示過程はMHC IおよびIIによって行われ、この機構は細胞媒介免疫に不可欠である。
MHC Iは、すべての有核細胞の膜に存在するタンパク質複合体で、細胞内タンパク質のプロテアソーム分解により生成された内因性抗原の断片をCD8+リンパ球に提示する(図1C)。
この機構により、免疫システムは、細胞がウイルスや変異タンパク質を合成していることを検出するために、体内のすべての有核細胞のタンパク質合成活性を常に監視している。
MHC IIは、マクロファージ、単球、B細胞、樹状細胞などの専門的な抗原提示細胞(APC)の膜上にあり、体内で摂取された外来抗原の断片をCD4+リンパ球に提示する(図1D)。
場合によっては、炎症シグナルの結果として、内皮細胞にもMHC II分子が見出されることがある。
CD8+またはCD4+リンパ球が、ウイルス遺伝子(例:感染による)、突然変異遺伝子(例:癌による)、または外来遺伝子(例:移植による)を発現している細胞を検出すると、
MHCに結合し、異常細胞の破壊につながる免疫反応を活性化する。
従来のワクチンは、一般にヒトの細胞にウイルスタンパク質を作らせないため、ヒトの細胞はタンパク質合成活性に由来するウイルス抗原にさらされることはない。
それに対して、COVID- 19に対する遺伝子ワクチンは、ヒトの細胞にスパイクタンパク質を産生させ、
遺伝物質を取り込んでタンパク質合成を開始したすべての細胞に及ぶ自己免疫反応に本質的に依存する。
筆者の知る限り、緊急用として承認されたCOVID-19ワクチンのいずれについても、これまでヒトに対してそのような評価は行われていない。
Pfizer/BioNTechのBNT162b2ワクチンに関しては、三角筋に注射され、主に腋窩リンパ節に排出される。
しかし、ファイザーが日本の規制当局のために実施した薬物動態試験によると、LNPは脾臓、肝臓、下垂体、甲状腺、卵巣などの組織で蓄積され、
ネズミの標的外分布を示すことが分かっている。
同様に、欧州医薬品庁(EMA)の評価報告書では、Pfizer/BioNTech社およびModerna社が使用したLNPは、ネズミの肝臓などの臓器に標的外の分布を示すことが報告されている。
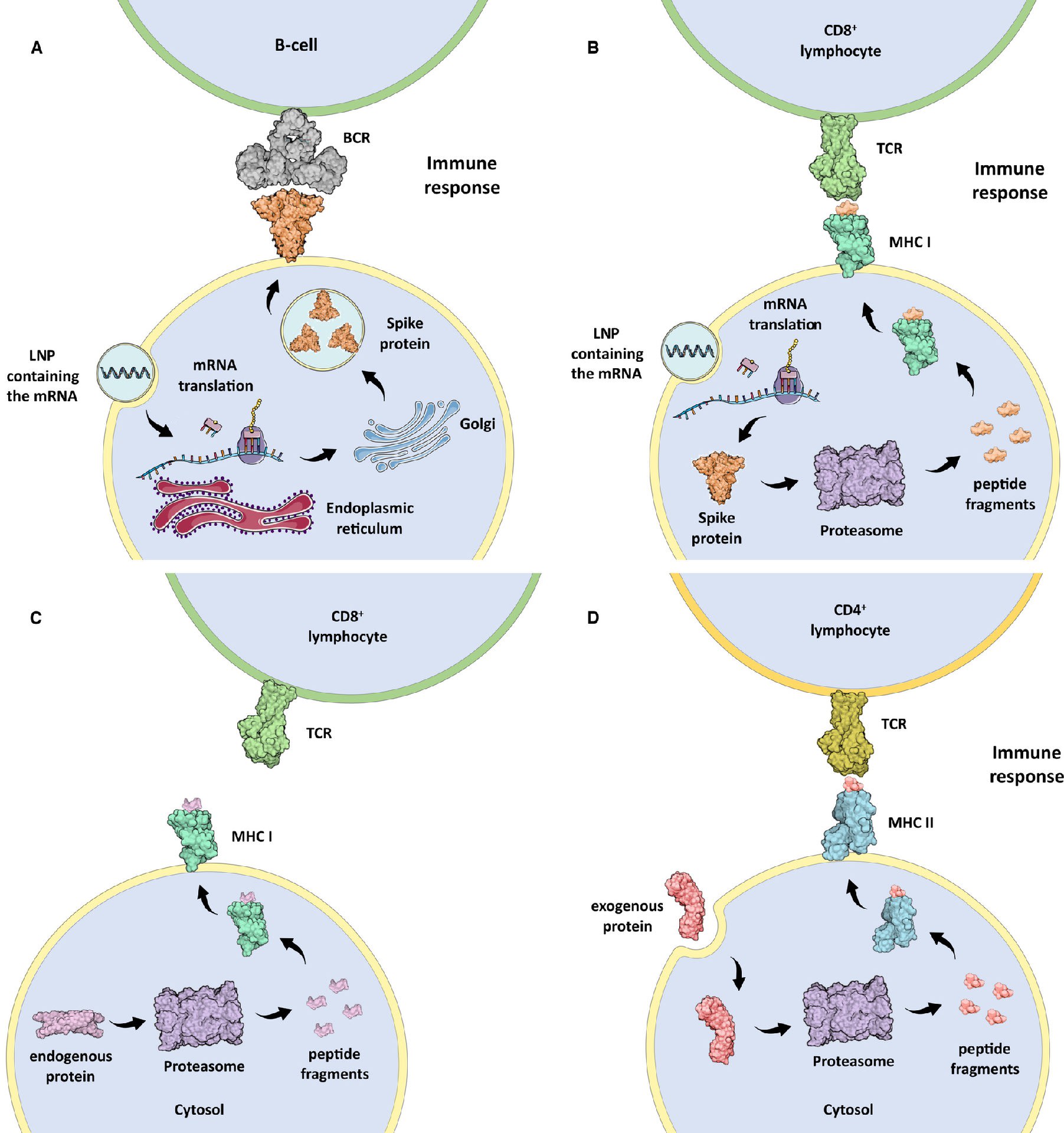
図1. (A)mRNAを含む脂質ナノ粒子(LNP)を摂取し、SARS- CoV- 2スパイクタンパク質を翻訳し、B細胞のB-細胞受容体(BCR)に提示するヒトの細胞。
(B)ヒト細胞が、mRNAを含むLNPを取り込み、スパイクタンパク質を翻訳し、MHC I抗原提示プロセスを介してCD8+リンパ球のT細胞受容体(TCR)に提示する様子。
(C)MHC Iは、内因性タンパク質のプロテアソーム分解により生じたペプチドをCD8+リンパ球のT細胞受容体(TCR)に提示する。
(D)CD4+リンパ球のT細胞レセプター(TCR)に外来性タンパク質のプロテアソーム分解から派生したペプチドを提示するMHC II。
もう一つの有害な毒性源は、スパイクタンパク質そのものであることが判明している。
この研究では、RNA-1273 Modernaワクチンの接種者から採取した血漿を長時間にわたって測定した結果、接種から数日後には、切断されたS1サブユニットと同様に、
かなりの量のスパイクタンパク質が血漿中に検出されることが判明した。
筆者らは、接種の数日後に起こるT細胞の活性化によって引き起こされる細胞性免疫応答が、スパイクタンパク質を提示する細胞の死滅につながるという仮説を立てている。
スパイクタンパク質が血流に放出されるということは、APCによってウイルスタンパク質が体内に取り込まれるため、MHC IIを介した抗原提示プロセスにも関与することになる(図1D)。
これらの研究では、血栓症、血小板減少、心筋炎、心膜炎、不整脈、神経系障害、その他の変化など、ワクチン接種後の重篤な副作用を報告している。
なお、前述の副作用のいくつかは、情報公開法(FOIA)の手続きの一環として公開されたファイザー社が2020年12月14日から2021年2月28日までに記録した死亡および有害事象のデータを
提供する機密の承認後累積分析で既に報告されていたものである。
結論として、LNPを摂取してウイルスタンパク質を翻訳する(mRNAワクチンの場合)、
あるいはアデノウイルスに感染してウイルスプロテインを発現・翻訳する(アデノウイルスベースのワクチンの場合)すべてのヒト細胞は、
必然的に免疫系に脅威と認識されて殺されることを強調しておく必要がある(図1)。
このメカニズムに例外はない。
その結果生じる損傷の度合いと健康への影響は、関与する細胞の量、組織の種類、そしてその後の自己免疫反応の強さによって異なる。
例えば、LNPに含まれるmRNAが心筋細胞に取り込まれ、その細胞がスパイクタンパク質を産生した場合、結果として生じる炎症は、
関与した細胞数に比例して心筋の壊死につながる蓋然性が高い。
したがって、COVID- 19に対するワクチンの正確な生体内分布を決定し、脅威となり得る組織を特定するために、ヒトでの薬物動態の評価が不可欠である。
www.DeepL.com/Translator(無料版)で翻訳しました。
この問題については、当ブログでは2021年6月の記事に書いていて特別目新しい情報ではありません。
スパイクタンパクが張り付いた細胞が細胞性免疫の攻撃を受けないよう免疫抑制機構がコードされていて、
それこそがmRNAワクチン技術の中核なのです。