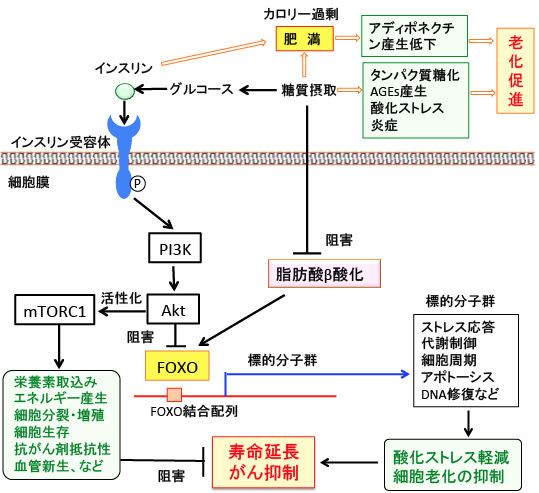
図:糖質の過剰摂取はタンパク質の糖化やAGEs(糖化最終生成物)の産生を引き起こし、炎症や酸化ストレスを高めて、細胞や組織の老化や機能低下を促進する。グルコースはインスリンの分泌を促進し、インスリンは脂肪の合成を促進し肥満を引き起こす。肥満はアディポネクチンの産生を減らす。インスリンはPI3K/Aktシグナル伝達系を活性化し、転写因子のFOXOを抑制して酸化ストレスに対する抵抗性を低下させる。AktはmTORC1の活性を高めることによってさらに老化を進行させる。
374)糖質を止めれば健康になる理由(その③):インスリンは寿命を短くする
【インスリンは脂肪の合成を促進する】
食物から摂取したグルコース(ブドウ糖)が消化管から吸収されて血液中のグルコース濃度(血糖値)が上昇すると、膵臓のランゲルハンス島のβ細胞からインスリンが分泌されます。
筋肉細胞と脂肪細胞では、インスリンで刺激されると細胞質内に貯蔵されているグルコーストランスポーター4(GLUT4)が細胞膜に移動してグルコースの取込みを亢進します。
さらにインスリンは解糖系酵素のヘキソキナーゼ、ホスホフルクトキナーゼ、ピルビン酸キナーゼの発現を亢進し、グルコースの分解を促進します。肝臓ではグルコースからグリコーゲンの合成を促進し、脂肪組織では脂肪の合成が促進されます。
このようにインスリンはグルコースの分解とグリコーゲンや脂肪の合成の両方を高めることによって血糖を下げます。グルコースの分解は生体エネルギーであるATPを産生するためです。グリコーゲンと脂肪の合成は余ったカロリーを貯蔵するためです。
インスリンは糖代謝やエネルギ−産生に重要な働きを行っています。インスリンの分泌を良くして、グルコースを筋肉組織や脂肪組織に取込ませ、グルコースの利用を促進することは大切です。
高糖質食でインスリンの分泌量が増えても、摂取カロリーが過剰でなければ、肥満にはなりません。しかし、摂取カロリーが消費カロリーを上回れば、余ったカロリーは脂肪に変換されて体脂肪として蓄積し、肥満になります(下図)。

図:インスリンは血糖値の上昇を感知して膵臓のランゲルハンス島のβ細胞から分泌され、グルコースの取込みや代謝を促進して血糖値を下げる。インスリンは脂肪組織での脂肪の合成を促進するので、糖質を多く摂取して摂取カロリーが過剰になると肥満になる。
【肥満になるとインスリンの効き目が弱くなる】
インスリンの働きに影響する様々な生理活性物質が脂肪細胞から分泌されており、肥満によって体脂肪が増えるとインスリンの働きが低下します。これをインスリン抵抗性と言います。
肥満になって脂肪組織が増大すると、脂肪組織にマクロファージなどの炎症細胞が浸潤し、TNF-αやIL-6などの炎症性サイトカインの産生が増えます。炎症性サイトカインというのは炎症の部位でマクロファージなどの細胞から産生されるタンパク質です。
これらの炎症性サイトカインは脂肪細胞からのアディポネクチンの産生を減少させます。
アディポネクチンは脂肪細胞から分泌される善玉ホルモンのようなタンパク質で、肝臓や筋肉細胞のアディポネクチン受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。
したがって、肥満になってアディポネクチンの産生が減ると、インスリン抵抗性が亢進し、動脈硬化や糖尿病の発生を促進します。
また、炎症性サイトカインは活性酸素の産生を高めるので酸化ストレスが増強します。アディポネクチンは抗炎症作用があり、TNF-αやIL-6は炎症を増悪します。
インスリンの働きが弱くなると、それを補うために体はインスリンの分泌量を増やして血中のインスリン濃度を高めて代償しようとします。すると益々脂肪の合成が増加するという悪循環を形成します(下図)。
この段階ではインスリンの分泌増加によってまだ血糖があまり高くないので糖尿病とは診断されませんが、そのうちインスリンを分泌するラβ細胞が疲弊して十分なインスリンが分泌されなくなると、高血糖状態が持続して糖尿病と診断されます。

図:グリセミック指数の高い食事で食後の血糖値が上昇するとインスリン分泌が増加する。インスリンは脂肪合成を促進するので肥満を引き起こす。肥満になって内蔵脂肪が増えると、脂肪組織から分泌される炎症性サイトカイン(TNF-αやIL-6)が増え、アディポネクチンの量が減る。その結果、インスリンの働きが低下し(インスリン抵抗性)、それを補うためにインスリンがさらに多量に分泌されて高インスリン血症になる。高インスリン血症はさらに肥満を促進するので悪循環を形成し、ますます症状が悪化する。炎症性サイトカインの産生増加は炎症を増悪させ酸化ストレスを高める。炎症と酸化ストレスとインスリン分泌の増加は動脈硬化や耐糖能異常を来してメタボリック症候群の原因となり、さらに老化を促進し、がんの発生や進展を促進する。
【インスリン抵抗性がメタボリック症候群を引き起こす】
メタボリック症候群というのは、内臓脂肪型肥満に高血糖・高血圧・脂質異常症のうち2つ以上を合併した状態を言います。
国際糖尿病連合の基準では、腹囲男性90cm、女性80cm以上が必須で、かつ1)血圧130/85mmHg以上、2)中性脂肪150mg/dL以上、3)HDLコレステロールが男性40mg/dL、女性50mg/dL未満、4)血糖100mg/dL以上、の4項目のうち2項目以上がある場合にメタボリック症候群と診断されます。
日本の診断基準は少し違います。日本肥満学会の基準は、腹囲男性85cm、女性90cm以上が必須で、かつ1)血圧130/85mmHg以上、2)中性脂肪150mg/dL以上またはHDLc40mg/dL未満、3)血糖110mg/dL以上の3項目中2項目以上がある場合となっています。
メタボリック症候群は内臓脂肪の蓄積によって脂肪組織におけるアディポネクチンの産生が減少し、インスリン抵抗性が起こることが基礎になっています。インスリン抵抗性によって血中インスリン濃度が高い状態(高インスリン血症)が持続することが肥満や動脈硬化の進展を促進します。
最近の研究では、グルコースとフルクトースを一緒に多く摂取すると、肥満やメタボリック症候群が起こりやすいことが示されています。つまり、砂糖や異性化糖(高フルクトース・コーンシロックなど)の過剰摂取が最も危険だと考えられています。
そして、糖質の摂取を減らし、食後の血糖の上昇を減らしてインスリン分泌を低下させる食事が、メタボリック症候群の改善に有効であることが多くの研究で明らかになっています。
【アディポネクチンを増やすと寿命が延びる】
脂肪細胞の働きは単に脂肪を蓄えるだけでなく、様々なアディポカイン(アディポサイトカイン)という生理活性のある蛋白質を分泌し、個体の恒常性維持や代謝の調節に大きく関わっています。
アディポネクチンはアディポカインの一つで、肝臓や筋肉細胞の受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。アディポネクチンには寿命を延ばす作用やがんを予防する作用が指摘されています。
慶應義塾大学医学部老年内科のグループが、百寿者(100歳を超える高齢者)のデータを集めて解析しています。百寿者のボディマス指数(BMI)は19.2±3.3で、対照(平均年齢55.4歳)のBMIは23.0±2.9で、当然のことながら、超高齢者では筋肉や脂肪の量が少なく、痩せている人が多いことが判ります。さらに、体脂肪が減ると産生が増加するアディポネクチンの量が、若い人の約2倍もあるという結果が得られています。
具体的には、100歳以上の女性(百寿者)66人とBMIが同じレベルの若い女性66人の血液中のアディポネクチンの量を比較したところ、百寿者のアディポネクチンの平均値は20.3 μg/mlで、若い女性の平均値10.8 μg/ml より約2倍高い数字を示したのです。
【アディポネクチンはがんを予防する】
アディポネクチンは寿命を延ばす作用と同時に、がんを抑制する作用があります。一般的に、加齢とともにがんの発生率は増加しますが、90歳を超える超高齢者では、がんの発生率が低下することが明らかになっています。
このように超高齢者でがんが少なくなる理由の一つとして、「アディポネクチンが高い人が超高齢まで生きる事ができ、アディポネクチンはがんを予防する効果があるので、超高齢者はがんが少ない」あるいは「超高齢になると、食事摂取量の低下や体脂肪の減少などでアディポネクチンの産生が増えるので、がんの発生や進展が抑制される」という推測がなされています。
多くの疫学研究で、血清アディポネクチンの濃度とがんの発生率が逆相関することが示されています。例えば、血清アディポネクチンの濃度と様々ながんの発生率を検討した2002年から2011年までに発表された45編の研究論文をレヴューした総説論文があります(ISRN Oncol. 2012;2012:982769.)。
この論文によると、血清アディポネクチンの濃度が高いほど、乳がん、前立腺がん、子宮内膜がん、大腸がん、食道がん、膵臓がんなど多くのがんの発生率が減少することが示されています。
また、アディポネクチンはがん抑制遺伝子のLKB1を活性化し、その下流のシグナル伝達系にあるAMPK(AMP活性化プロテインキナーゼ)の活性化とmTOR(mammalian target of rapamycin:哺乳類ラパマイシン標的蛋白質)の活性阻害によって、がん細胞の増殖や転移を防ぐ作用があることが報告されています。
そして、アディポネクチンは糖尿病や動脈硬化やメタボリック症候群を予防し、寿命を延ばす作用があります。
したがって、アディポネクチンの産生を増やすことは、長寿とがん予防の両方を達成するために極めて重要と言えます。
体脂肪を減らせば、アディポネクチンを増やすことができます。肥満者でも、食事のグリセミック負荷を減らすとアディポネクチンが増えることが報告されています。糖質摂取を減らしてインスリンの分泌を減らすと、脂肪組織における炎症状態が低下するためだと推測されています。
【インスリンシグナル伝達系の変異が寿命を延ばす】
老化を促進し寿命を短くする体内因子として、慢性炎症や酸化ストレス、成長ホルモン、インスリン、インスリン様成長因子-1、性ホルモンなどが知られています。
慢性炎症は活性酸素やフリーラジカルの産生を増やして酸化ストレスを増大し、遺伝子変異や免疫力低下や諸臓器機能の低下を招いて老化やがんを促進します。
高血糖状態が炎症や酸化ストレスを高めることは
373話で解説しました。つまり、血糖が高い状態が続くと老化を促進します。
成長ホルモン、インスリン、インスリン様成長因子-1、性ホルモンというのは体の成長や成熟に必要な因子で、中年以降に体の老化が進むのはこれらの成長因子やホルモンが低下するためだと考えられています。
したがって、アンチエイジング(抗老化、抗加齢)の領域では、このようなホルモンや成長因子を補充して、体を若返らせようとする治療が行われています。そのため、これらの因子が寿命を短くすることに荷担することは不思議に思われるかもしれません。しかし、成長を促進し若々しさを保つような因子が、寿命を短くすることが明らかになっているのです。
線虫やショウジョウバエを使って寿命に関わる遺伝子の研究が行われています。すなわち、線虫やショウジョウバエの突然変異系統(ミュータント:変異体)の中から寿命が延びた変異体を見つけ、どの遺伝子に突然変異が起きているかを解析すれば、寿命に関連する遺伝子を見つけることができます。そのような研究によって寿命に関わる遺伝子が多数見つかっていますが、見つかった線虫やショウジョウバエの遺伝子の哺乳類の相同体を解析すると、それがインスリやインスリン様成長因子-1(IGF-1)の受容体やそのシグナル伝達系に関与する遺伝子だということが明らかになったのです。
例えば、線虫の遺伝子でins-7とdaf-2と名付けられた遺伝子に突然変異がある変異系統の線虫は寿命が延びていました。そして、これらの遺伝子は哺乳類では、それぞれインスリンとインスリン受容体に相当するものでした。そして、インスリン受容体の下流に存在するシグナル伝達系に関与する遺伝子の突然変異も寿命を延長することが明らかになったのです。
【インスリンはインスリン様成長因子-1を活性化してがんと老化を促進する】
このような線虫やハエの研究結果をもとに、遺伝子改変マウスを使った研究が行われています。例えば、成長ホルモンが過剰に発現しているマウスはインスリン様成長因子-1(IGF-1)の濃度が上昇し、寿命が短くなり、がんの発生率が高まることが報告されています。
体の成長を促進する成長ホルモンは肝臓に働きかけてIGF-1を分泌させ、このIGF-1が標的組織の細胞分裂を刺激することによって体の成長を促進します。したがって、多くの臓器や組織の細胞にIGF-1の受容体があり、それらの細胞から発生するがん細胞の多くがIGF-1受容体を持っています。そのため、多くのがん細胞はIGF-1によって増殖を刺激されます。
逆に、成長ホルモンが産生できない成長ホルモン欠損マウスや成長ホルモン受容体が欠損したマウスを作成すると、これらの成長ホルモンの働かないマウスではがんの発生率が減少し寿命が延びることが示されました。ネズミに30~40%のカロリー制限を行うとIGF-1濃度が30~40%減少し、がんの発生率が低下し、寿命が延びました。
つまり、体の成長に必要な成長因子やインスリンやIGF-1は、がんの発生や進展を促進し、さらに寿命を短くすることに荷担することが明らかになっています。
インスリンは肝臓におけるIGF-1結合蛋白の産生を抑制し、フリーのIGF-1を増やします。IGF-1はインスリンと構造が似ており、それらの受容体も似ているため、インスリンとIGF-1は相互に交叉反応します。したがって、インスリンの分泌を促進するグリセミック負荷の高い食事(糖質の多い食事)は、インスリン/IGF-1シグナル伝達系を活性化し、寿命を短くし、がんの発生を促進することになります。
人間でも、100歳以上の超長寿者では、成長ホルモンやインスリン/IGF-1シグナル伝達系の働きが低下するような遺伝子変異を持った人が多いという報告があります。100歳以上まで生存した人(百寿者)の子孫と、比較的若く亡くなった人の子孫を比較すると、百寿者の子孫の方がIGF-1の血中濃度が低かったという報告もあります。
IGF-1の低い人ほどがんによる死亡率が低いという報告や、IGF-1の低下しているほうが長寿であるという報告もあります。またIGF-1の働きを阻害するIGF-1結合蛋白の高い人のほうが長生きであるという報告もあります。
高齢者男性で、血中のIGF-1の濃度が高い人はがんを発生するリスクが高いという疫学研究の結果が米国から報告されています。この研究では、50歳以上の男性633人を対象に、IGF-1値を測定したのち18年間の追跡調査を行った結果、試験開始時にIGF-1値が100ng/mlを超えていた男性のがん死亡のリスクはIGF-1値が低かった男性のほぼ2倍であったということです。(J Clin Endocrinol Metab. 95(3):1054-1059. 2010年)
その他の研究でも、血清IGF-I濃度が高いほど、前立腺がん、乳がん、肺がん、大腸がん、膵臓がんの発生率が高くなることが示されています。
【脂肪酸のβ酸化が亢進すると寿命が延びる】
インスリンは脂肪酸の分解(β酸化)を抑制しますが、
脂肪酸のβ酸化が亢進すると寿命が延びることが報告されています。(
318話参照)
ショウジョウバエの突然変異系統(ミュータント:変異体)を使って、寿命に関連する遺伝子の研究が行われています。ある遺伝子が過剰発現していることによって寿命が延長したショウジョウバエの突然変異系統を解析して、寿命延長効果のある遺伝子が幾つか見つかっています。
その中に、脂肪酸のβ酸化に関連する遺伝子が認められてます。つまり、脂肪酸のβ酸化に関与する遺伝子が過剰に発現したショウジョウバエの突然変異系統は正常と比べて寿命が延びるという結果です。
さらに、脂肪酸のβ酸化が亢進すると、酸化ストレスや飢餓に対する抵抗性が高まっていることが明らかになっています。β酸化の亢進したハエでは、除草剤のパラコートを使った酸化障害やエサを減らすことによる飢餓によって死亡する率が減少することが示されています。このような効果のメカニズムとしてFOXOシグナル伝達系が活性化されていることが示されています。(Oxid Med Cell Longev. 2012; 2012: 854502. )
FOXOは栄養飢餓時に活性化される転写因子で、ストレス応答、代謝制御、細胞周期、アポトーシス、DNA修復などに関連する多くの遺伝子の発現誘導を促します。がん抑制遺伝子としての性格ももっており、FOXOの活性化は抗がん作用があります。カロリー制限や糖質制限やAMPK活性化などによる寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています。
脂肪酸のβ酸化の亢進がどのようなメカニズムでFOXOを活性化するかは現時点では不明です。しかし、何らかの機序で、脂肪酸の燃焼(β酸化)の亢進はFOXOの活性化を介して寿命延長と抗がん作用を発揮する可能性が示唆されます。
インスリンが結合して活性化されたインスリン受容体はホソホイノシチド3-キナーゼ(PI3K)というリン酸化酵素を活性化し、これがさらにAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。Aktのターゲットの一つがFOXOで、AktはFOXOの転写活性を抑制します。つまり、インスリンはAktを活性化し脂肪酸のβ酸化も抑制する結果、FOXOの活性が低下する可能性が示唆されています(下図)。

図:糖質を摂取するとインスリンが分泌され、インスリン受容体が活性化されるとホスホイノシチド3-キナーゼ(PI3K)/Aktシグナル伝達系が活性化される。AktはFOXO(Forkhead box O)という転写因子の活性を阻害する。糖質摂取およびインスリンは脂肪酸のβ酸化を阻害する。脂肪酸のβ酸化自体がFOXOを活性化することが報告されている。FOXOが活性化されると酸化ストレスが軽減され細胞老化が抑制され、がんの抑制や寿命延長の効果を発揮する。
【インスリンはmTORC1を活性化して老化を促進する】
インスリンによって活性化されるセリン・スレオニンキナーゼのAktのターゲットの一つに哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)というタンパク質複合体があります。
mTORC1はインスリンの他に、成長ホルモンやインスリン様成長因子-1(IGF-1)などの様々な成長因子や過剰な栄養によって活性化され、タンパク質や脂肪の合成を促進し、細胞の増殖や体の成長を促進する作用があります。
マウスを使った実験では、mTORC1の活性を遺伝子改変や阻害剤(ラパマイシンなど)で抑制すると、老化関連疾患の発生が遅くなり、寿命が延びることが報告されています。
例えば、遺伝子改変技術によってmTORタンパク質を生存に最低限必要な約25%しか生成できないマウスを作成すると、このマウスは正常のマウスに比べて寿命が約20%延びることが明らかになりました。mTORC1の活性を阻害するラパマイシンという薬が寿命を延ばすことがマウスの実験で明らかになっています。
また、ハエから人間を含めて哺乳類までほとんどの生物種において、オスはメスよりも大きくて強いが、寿命はメスより短いことが知られています。その理由として、オスの方がmTORC1の活性が高いことが挙げられています。(
362話参照)
mTORC1が活性化されるとタンパク質や脂質の合成が亢進し、体が大きく屈強になります。これは若いオスにとっては生存競争に有利になります。しかし、mTORが活性化されると老化が促進されるので、寿命を犠牲にしなければならないということになります。オスは強さ(屈強さ)を得るために寿命を犠牲にしているということです。(
Aging (Albany NY). 2012 Dec;4(12):899-916.)
mTORCはがん細胞の増殖を促進します。したがって、オスの方がメスよりもがんの発生率が高く、寿命も短いことの説明がmTORC1の活性がオスの方が高いということで説明できると考えられています。
また、人間でも、背の高い人は寿命が短いことが疫学研究で示されています。プロのスポーツ選手、特に体重や筋肉を増やすようなスポーツ選手は老化や発がんを促進する可能性が高いという指摘もあります。
老化は成長の延長です。成長した段階でmTORC1の活性を低下させるようにスイッチを切り替えるとその個体の寿命を延ばすことができるのですが、生き物はそこまで進化していないのかもしれません。あるいは、生殖年齢に達した後は、そのまま老化を促進させる方が種の繁栄には都合が良い(若い世代に生きる場所と食料を与える方が種の繁栄には有利)ので、敢えて、成長に関わる因子がそのまま老化を促進し、生殖の終わった個体の死を早めているのかもしれません。
成長が終了したあともmTORC1の働きが過剰に続くと細胞や組織の老化が促進されます。したがって、生殖年齢を過ぎれたあとは、糖質を制限しインスリンの分泌を減らすことは老化を抑制し寿命を延ばすのに有効だと言えます。
【糖質とインスリンは様々なメカニズムで老化を促進する】
糖質はエネルギー源として重要な栄養素であり、インスリンは体の成長を促進する上では重要なホルモンです。しかし、成長が終わったあとの生物にとって、糖質の過剰摂取と、それによるインスリンの分泌促進は様々なメカニズムで老化を促進し、寿命を短くする方向で作用します(トップの図)。
糖質の過剰摂取は炎症と酸化ストレスを高めます。タンパク質の糖化やAGEs(糖化最終生成物)の産生によって、細胞や組織の老化や機能低下を促進します。(
372話参照)
糖質摂取はインスリンの分泌を促進します。インスリンは脂肪の合成を促進し、肥満を引き起こします。肥満はさらに炎症状態を高め、アディポネクチンの産生を減らし、インスリン抵抗性を高めてさらに高インスリン血症を亢進します。このようなインスリンの高い状態は肥満をさらに亢進し動脈硬化を促進しメタボリック症候群を引き起こします。
インスリンはPI3K/Aktシグナル伝達系を活性化し、転写因子のFOXOを抑制して酸化ストレスに対する抵抗性を低下させ、mTORC1の活性を高めることによってさらに老化を進行させます。
このように、成長が終了したあとは、糖質とインスリンは体の老化を進めて寿命を短くすると言えます。
新刊紹介:

糖質摂取を減らすと老化を遅らせ、病気を防ぎ、健康寿命を延ばせる理由を解説しています。
(内容の詳細はこちらへ)