がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
375)糖質を止めれば健康になる理由(その④):インスリンはがんを促進する
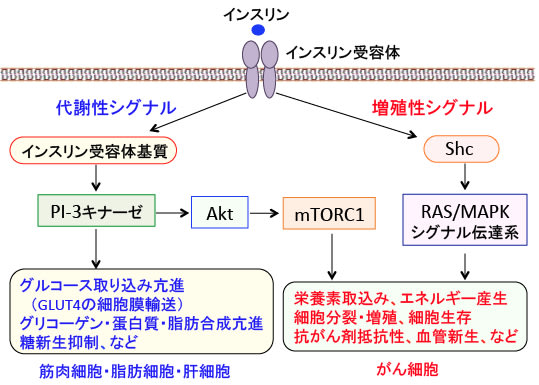
図:インスリンはインスリン受容体を介して多彩な生理作用を発揮するが、大別すると代謝性シグナルと増殖性シグナルに分けられる。インスリン受容体のチロシンキナーゼ活性が活性化されると、インスリン受容体基質(IRS)がリン酸化される。リン酸化されたIRSはPI-3キナーゼを活性化し、グルコーストランスポーター4(GLUT-4)の細胞質から細胞膜への輸送を促進し、グルコースの取込みが促進される(筋肉と脂肪細胞)。さらにグリコーゲンの合成(筋肉と肝臓)、脂肪合成(脂肪細胞)、タンパク質合成(筋肉)などの代謝が促進される。一方増殖性シグナルでは、インスリン受容体の活性化はShcをリン酸化し、RAS-MAPK経路を活性化する。さらにPI-3キナーゼによるAktの活性化はmTORC1を活性化してがん細胞の増殖を促進する。
375)糖質を止めれば健康になる理由(その④):インスリンはがんを促進する
【肥満ががんの発生と進展を促進する】
多くの疫学研究から、大腸がん、乳がん、膵臓がん、子宮体がん、腎臓がん、胆のうがん、肝臓がんなど多くのがんの発生率が肥満によって増えることが示されています。
さらに、肥満ががん治療後の再発率を高め生存期間を短くすることも多くの報告で明らかになっています。肥満ががんの発生や進展を促進する理由の第一は、インスリンの血中濃度が高くなるからです。
インスリンの働きに影響する様々な生理活性物質が脂肪細胞から分泌されており、肥満によって体脂肪が増えるとインスリンの働きが低下します。脂肪組織から分泌されるアディポネクチンという蛋白質にはインスリンの働きを高める作用がありますが、内蔵脂肪が増えると分泌量が減り、アディポネクチンの血中濃度が低下するとインスリン抵抗性(インスリンの作用低下)が高まります。
インスリンの働きが弱くなると、それを補うために体はインスリンの分泌量を増やして血中のインスリン濃度を高めて代償しようとします。この段階ではインスリンの分泌増加によってまだ血糖があまり高くないので糖尿病とは診断されませんが、そのうちインスリンを分泌するランゲルハンス島から十分なインスリンが分泌されなくなると、高血糖状態が持続して糖尿病と診断されます。
米国のある疫学研究では、糖尿病と診断された人よりも、糖尿病の前段階(プレ糖尿病)の人の方が発がんリスクが高いという報告があります。これは発がんリスクを高める原因として高インスリン血症の存在の重要性を示唆しています。つまり、肥満や運動不足による糖尿病予備軍では、インスリン抵抗性による高血糖を抑えるためにインスリンが過剰に分泌され、発がんを促進すると考えられています。
【がん細胞はグルコースの取込みが増えている】
グルコースはATPの産生や細胞の構成成分(核酸や細胞膜など)を作る材料になります。したがって、増殖活性の高いがん細胞ではグルコースの必要量が高く、グルコースの取込みが亢進しています。
がん細胞でグルコースの取込みが多いことはPET(Positron Emission Tomography:陽電子放射断層撮影)検査でも示されています。これはフッ素の同位体で標識したグルコース(18F-fluorodeoxy glucose)を注射して、この薬剤ががん組織に集まるところを画像化する検査法で、正常細胞に比べてグルコースの取り込みが非常に高いがん細胞の特性を利用した検査法です。
グルコースは細胞膜にあるグルコース・トランスポーター(グルコース輸送担体)を使って細胞膜を通過します。グルコースは水溶性なので、細胞膜をそのままでは通過できないためです。
グルコース・トランスポーターには幾つかの種類があり、組織の違いなどによって種類の異なるトランスポーターが使われます。
脂肪細胞と筋肉細胞(骨格筋と心筋)ではインスリン感受性のグルコース・トランスポーター4(GLUT4)が使われます。GLUT4は細胞内に貯蔵されていて、インスリンが細胞に作用するとGLUT4が細胞膜上へと浮上してグルコースを取り込みます。
GLUT4はインスリン以外にもAMP活性化プロテインキナーゼ(AMPK)によっても細胞膜に移動します。AMPKはGLUT4遺伝子の転写や翻訳を促進してGLUT4の量を増やす作用もあります。
AMPKはアディポネクチンや糖尿病治療薬のメトホルミンや運動で活性化されます。これが、アディポネクチンやメトホルミンや運動が筋肉内へのグルコースの取込みを促進して血糖を下げるメカニズムになっています。
血糖が下がれば、インスリンの分泌も低下します。これが、アディポネクチンやメトホルミンや運動ががんの予防に有効である理由の一つです。
一方、グルコース・トランスポーター1(GLUT1)は、多くの細胞でグルコースの取り込みに関わっており、多くのがん細胞でGLUT1の発現が増えていることが明らかになっています。GLUT1はインスリンの有無とは関係なく細胞膜に存在してグルコースを取込みます。
がん細胞ではグルコースの細胞内取り込みを行うGLUT1の量が正常細胞に比べて非常に多くなっており、これらのトランスポータの発現量が多いがん細胞ほど、増殖速度が早く、予後が悪いという研究結果も報告されています。
【インスリン受容体からのシグナル伝達系が阻害されてインスリン抵抗性になる】
筋肉細胞と脂肪細胞ではインスリン感受性のグルコース・トランスポータ−4(GLUT4)によってグルコースの取込みが行われます。つまり、インスリンは骨格筋と脂肪組織におけるグルコースの取込みを亢進することによって血糖を低下させます。
さらにインスリンは、グルコースを分解する解糖系酵素を活性化し、筋肉細胞でのタンパク質の合成や脂肪組織での脂肪の合成を促進します。
また、肝細胞ではグリコーゲンの合成促進や糖新生の抑制などがインスリンの作用で調節されています。肝細胞でのグルコースの取込みはインスリンの作用を受けないGLUT2によって行われるので、インスリンと関係なくグルコースを取り込みます。
インスリンの標的臓器(骨格筋、脂肪組織、肝臓)では、インスリンは細胞膜に存在するインスリン受容体に結合して、細胞内のシグナル伝達系を活性化して様々な作用を行います。
すなわち、インスリン受容体にインスリンが結合するとインスリン受容体のチロシンキナーゼ部分が活性化し、インスリン受容体基質-1(IRS-1)というタンパク質のチロシン残基がリン酸化されます。リン酸化されたIRS-1はさらに他のタンパク質を活性化し、連鎖的な細胞内の情報伝達が行われます。
筋肉と脂肪細胞では、IRS-1がPI-3キナーゼを活性化してGLUT4の細胞膜への輸送を促進し、グルコースの取込みが促進されます。
インスリン抵抗性というのは、筋肉細胞や脂肪細胞においてインスリン受容体からのシグナル伝達が障害され、その結果、インスリン依存性のGLUT4の細胞膜への輸送が低下してグルコースの取込みが低下している状態です。そのため、インスリンの分泌を増やして代償するため高インスリン血症になります。
炎症性サイトカインのTNF-αはIRS-1の活性化を阻害することによってインスリン受容体からのシグナル伝達を阻害します。
肥満になると肥大した脂肪組織からTNF-αの産生が増えます。また、慢性炎症状態でもTNF-αが増えます。したがって、肥満や慢性炎症はインスリン抵抗性を高めることによってインスリンの血中濃度を高めます。これが、肥満や慢性炎症ががんの発生や進展を促進する理由の一つになっています。
【多くのがん細胞にインスリン受容体が発現している】
筋肉細胞や脂肪細胞や肝細胞のようにインスリンの標的細胞でインスリン受容体が多く発現しているのは当然のことです。しかし、がん細胞の場合は、インスリンの標的組織でない細胞から発生したがんでも、多くのがん細胞でインスリン受容体が多く発現していることが知られています。
例えば、肺がん、大腸がん、乳がん、前立腺がん、甲状腺がんなど、血糖調節とは全く関係ない組織から発生したがん細胞でインスリン受容体の発現が過剰に増えていることが報告されています。
がん細胞のグルコース取込みに関与するグルコース・トランスポーター1(GLUT1)の発現にはインスリンの作用は必要ありません。したがって、がん細胞にインスリン受容体が多く発現している理由はグルコース取込み亢進以外にあることになります。多くの研究で、インスリンががん細胞の増殖促進や細胞死(アポトーシス)の抑制など、がんを悪化させる様々な作用が明らかになっています。
インスリン受容体の主な基質としては、グルコース取り込みやグリコーゲン合成、タンパク質や脂肪の合成などといったインスリンの代謝作用を下流に伝えるインスリン受容体基質(IRS)ファミリーと、インスリンの増殖作用を下流に伝えるShc蛋白があります。インスリン受容体によってShcがリン酸化されるとRAS-MAPK経路というシグナル伝達系が活性化されます。このRAS-MAPK経路は細胞の増殖を促進するシグナル伝達系です。
多くのがん細胞でインスリン受容体が発現しており、インスリンによってインスリン受容体からShcが活性化されRAS-MAPK経路が活性化されると、がん細胞の増殖が促進されます。
また、インスリン受容体基質から活性化されるIP-3キナーゼはAktというタンパク質を活性化します。Aktはセリン・スレオニンリン酸化酵素で、活性化したAktは細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。Aktのターゲットの一つがmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)というタンパク質で、このmTORC1はがん細胞のタンパク質や脂肪の合成を高め、増殖を促進します(トップの図)。
肥満やメタボリック症候群における高インスリン血症が、がんの発生や進行を早めることは多くの疫学研究や動物実験などで証明されています。空腹時のインスリン濃度が高いと大腸腺腫や大腸がんの再発率が高くなること、前立腺がんや乳がんでは血中インスリン濃度が高いほど予後が不良であることなど、高インスリン血症が多くのがんの再発や進展を促進することが報告されています。その理由は、インスリン受容体の活性化が細胞増殖と生存のシグナル伝達系であるPI-3キナーゼ/Akt/mTORC1とRAS/MAPK経路を活性化するからです。
【インスリンはインスリン様成長因子-1の活性を高める】
インスリンは肝臓におけるインスリン様成長因子-1結合蛋白やステロイドホルモン結合グロブリンの産生を減らすことによって、インスリン様成長因子-1(IGF-1)や性ホルモンの活性が高まります。インスリンは卵巣におけるアンドロゲンの産生を高める作用もあります。さらに、脂肪組織はエストロゲンの産生部位でもあり、アロマターゼ活性によってエストロゲンの産生が高まります。
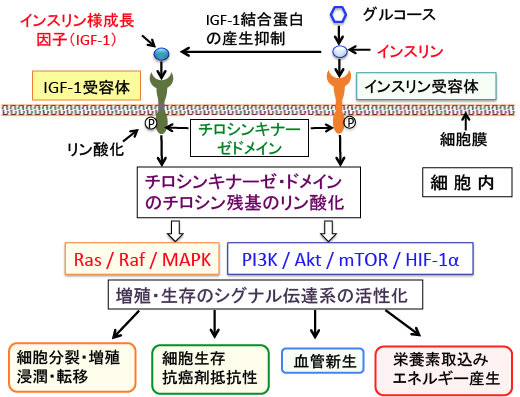
IGF-1はがん細胞の増殖や血管新生や転移を促進する作用があります。体の成長を促進する成長ホルモンは肝臓に働きかけてインスリン様成長因子-1(IGF-1)を分泌させ、このIGF-1が標的組織の細胞分裂を刺激します。したがって、多くの臓器や組織の細胞にIGF-1の受容体があり、それらの細胞から発生するがん細胞の多くがIGF-1受容体を持っています。
IGF-1は70個のアミノ酸からなり、インスリンと似た構造をしています。IGF-1受容体とインスリン受容体も類似しており、インスリンがIGF-1受容体にも結合してIGF-1と同じように細胞の増殖を促進することが知られています。インスリンとIGF1はそれぞれの受容体に結合して細胞を刺激すると、細胞増殖と代謝を促進するシグナル伝達経路(PI3K/Akt/mTOR/HIF-1α経路とRas/Raf/MAPK経路)を活性化して栄養素の取り込みやエネルギー産生を高め、細胞増殖や血管新生や転移を促進し、抗がん剤抵抗性を高めます(下図)。
効果を認めたこの5例は、進行を続けた4例と比較して、血中のケトン体の量が3倍くらい高かったという結果でした。腫瘍増殖の抑制を認めた5例と進展した4例の間には、カロリー摂取や体重減少の程度には差を認めませんでしたが、ケトン症のレベルは血清インスリンの濃度と逆相関の関係にありました。(Nutrition 28(10): 1028-35, 2012年)
つまり、約250万年前から農耕が始まる1万年前まで、氷河期を繰り返す時期のために糖質の少ない低糖質・高蛋白質の食事を強いられてきたため、筋肉や脂肪組織でのグルコースの取込みを制限するためにインスリンが効きにくい体質が進行したと考えられています。
糖質を十分に摂取できない時期にはインスリン抵抗性は生存に有利でした。
しかし、農耕が始まって糖質の多い食事になり、近代になって精製した糖が過剰に摂取されるようになると、インスリンが効きにくい状況(インスリン抵抗性)は不利に働くようになって、肥満やメタボリック症候群やがんが増える結果になったというように考えられています。(詳細は次回)
| « 374)糖質を止めれば健康になる... | 376)人類は狩... » |





