がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
381)寿命を延ばすがん治療(その①):2-デオキシ-D-グルコース

図:2−デオキシ-D-グルコース(2-DG)はグルコースの2位の水酸基(OH)が水素原子(H)に置換したグルコース類縁体で、グルコースと同じようにグルコーストランスポーター(GLUT)を通って細胞内に入る。グルコースはヘキソキナーゼでグルコース-6-リン酸に変換されてさらに解糖系酵素で分解されてATP産生へ使われ、あるいはペントースリン酸回路で核酸やNADPHの合成に利用される。一方、2−DGはヘキソキナーゼで6位がリン酸化されて2-デオキシ-D-グルコース-6-リン酸(2-DG-6-PO4)に変換されるが、2-DG-6-PO4はその先の解糖系酵素で代謝できない。細胞質内で蓄積した2-DG-6-PO4はヘキソキナーゼをフィードバック阻害するので、解糖系でのグルコース代謝が阻害されてATP産生や核酸やNADPHの産生が低下する。2−DGはカロリー制限と類似の老化抑制、寿命延長、がん抑制効果を示すカロリー制限模倣化合物(Calorie restriction mimetics)の一つとして、老化とがんの両方の研究分野で有用性が指摘されている。
381)寿命を延ばすがん治療(その①):2-デオキシ-D-グルコース
【毒ガスからスタートした抗がん剤の開発】
最初の抗がん剤はナイトロジェンマスタードで、第一次世界大戦に化学兵器として使われたマスタードガスのイオウ原子を窒素に置き換えた化合物です。
DNAをアルキル化することによって核酸の合成を阻害して細胞の増殖を抑えます。白血病や悪性リンパ腫の治療薬として効果を認められましたが、その作用機序から明らかなように細胞分裂を行っている正常細胞も死滅させるため、強い副作用を引き起こします。
その後毒性を弱めたナイトロゲンマスタード誘導体が開発され、シクロフォスファミドやメルファランといった抗がん剤が現在も使用されています。これらはアルキル化剤という抗がん剤に分類されています。
ナイトロジェンマスタードが最初にがん患者に使用されたのは1946年です。 1950年代以降のがん治療法の研究領域では、「がんはいかなるコストを払っても抹殺すべき」という考えが主流で、「がん細胞を死滅させる細胞毒を見つけて抗がん剤にする」ような研究が重視されました。したがって、細胞毒性の強い抗がん剤が多く開発され、現在も使用されています。
しかし、細胞分裂を阻害して増殖しているがん細胞を死滅させようとする抗がん剤の最大のデメリットは、正常細胞にもダメージを与えて強い副作用を引き起こすことです。骨髄細胞(白血球や赤血球や血小板)や皮膚や消化管粘膜や毛根細胞など絶えず細胞分裂を行っている正常細胞もダメージを受けるため様々な副作用を発症します。
【副作用の強いがん治療は老化を促進する】
一般的に、正常細胞に毒性の強い抗がん剤は、正常な細胞のDNAやタンパク質や細胞膜にダメージを与えるので、基本的には細胞や組織の老化を促進し、寿命を短くする可能性があります。二次的に別のがん(2次がん)を発症させるリスクや、免疫機能が傷害されると感染症を引き起こすリスクも高くなります。
治療が終了して10年以上経てば、抗がん剤や放射線治療による老化促進や寿命短縮という悪影響はほとんど消えます。タバコも吸い続ければ発がんリスクを高めますが、禁煙して10年以上たてば、それまで蓄積した喫煙によるリスクはほぼ無くなるという見解と同じです。ダメージを受けた組織や臓器の機能も数ヶ月から数年で元に回復します。
しかし、最近は何年間も抗がん剤治療を受けている患者さんが増えています。昔は、進行がんで抗がん剤治療を受けても、短期間で効かなくなって終了することが多かったのですが、最近は使える抗がん剤の種類が増え、治療法も進歩し、再発や転移がんでも抗がん剤や放射線治療を受けながら長い期間がん治療を受けている患者さんが増えています。このような場合、抗がん剤の副作用による諸臓器の機能低下や組織の老化促進が問題になってきます。
この問題の対処法として2つのアプローチがあります。
一つは、抗がん剤や放射線治療による諸臓器の機能低下や組織の老化を防ぐために、漢方治療やある種のサプリメントの利用です。抗がん剤や放射線治療の治療効果を妨げずに、それらの治療による組織の酸化傷害や機能低下を軽減する方法はがんの補完治療として有用です。
適切な漢方治療、メラトニン、ω3系不飽和脂肪酸(DHAやEPA)、L-カルニチン、ミルクシスルに含まれるシリマリン、乳酸菌などのプロバイオティクスなど有効性と安全性のエビデンスのある方法は多数あります。
もう一つの方法は、老化抑制と寿命延長の両方の効果のあるがん治療法を利用することです。その可能性について、最近は多くの研究が報告されています。
【老化抑制とがん抑制には共通点が多い】
分子標的薬の中にはがん細胞の増殖と同時に老化の進行を遅らせる作用をもったものがあります。その理由は、がん治療のターゲットになっているシグナル伝達系と老化に関連する因子に共通のものが多くあるからです。
老化の研究者はがん治療で開発された分子標的薬は抗老化治療の宝庫だと言っています。つまり、老化予防や寿命延長の効果を持ったがん治療が可能ということです。
正常細胞に様々なダメージを与える通常の抗がん剤治療は老化や寿命に対してマイナスに作用しますが、老化や寿命に対してプラスの作用をもつ抗がん剤で治療すれば、それは理想のがん治療になります。
老化を遅らせ寿命を延ばす最も確実な方法はカロリー制限です。カロリー制限とは、栄養障害を起こさずに食事からの摂取カロリーを30~40%程度減らす食事を行うことで、カロリー制限には老化を遅延して寿命を延ばし、老化関連疾患の発症を遅らせる効果が認められています。カロリー制限ががんの発生を抑制することも明らかになっています。
このカロリー制限による老化遅延や寿命延長やがん抑制のメカニズムには長寿遺伝子と言われるサーチュインなど様々な因子の関与が指摘されていますが、その因子の中に、インスリン、インスリン様成長因子-1(IGF-1)、PI3K/Aktシグナル伝達系、mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)、AMP活性化プロテインキナーゼ(AMPK)、転写因子のFOXO(Forkhead box O)などがあります。そして、これらはがんの予防や治療における重要なターゲットになっています。
例えば、カロリー制限はATPの量を減らすことによってAMPKを活性化します。インスリン/IGF-1シグナル伝達系で活性化されるPI3K/Ak/mTORC1は老化を促進しがん細胞の増殖を促進します。AMPKはこのシグナル伝達系を抑制します。
ネズミに30~40%のカロリー制限を行うとIGF-1濃度が30~40%減少し、がんの発生率が低下し、寿命が延びるという結果が報告されています。
線虫の研究では、カロリーを制限しなくても、カロリー摂取で応答するインスリンの信号伝達系に欠陥がある変異体は普通にエサを食べていても長生きすることが明らかになっています。
細胞には古くなったタンパク質を分解してリサイクルするオートファジー(自食作用)というメカニズムがあります。飢餓状態になったときに、自分の細胞を分解して栄養源にするのが本来の目的ですが、細胞内の老化したタンパク質を除去する作用もあります。
一時的飢餓あるいは軽度の飢餓はオートファジー亢進を通じて細胞内をきれいにして、細胞を若返らせる効果があり、さらにがんを予防することもできます。オートファジーの抑制は細胞内に異常タンパク質や不良ミトコンドリアが蓄積することが引き金になって細胞のがん化が促進されるからです。
カロリー制限は完全な絶食ではなく、普通の食事の60%程度のカロリーに抑えるのですが、この程度の弱い飢餓でもオートファジーが誘導されます。
インスリンやインスリン様成長因子-1(IGF-1)によって活性化されるmTORC1はオートファジーを抑制することによって細胞の老化とがん化を促進する作用が指摘されています。
FOXOは「Forkhead box O」の略で、DNA結合ドメインFOX(Forkhead box)をもつForkheadファミリーのサブグループ“O”に属する転写因子で、栄養飢餓時に活性化されます。
FOXOはインスリン-PI3K-AKTシグナルによって負に制御されています。つまり、PI3K-AKTシグナルが活性化されるとAKTによって直接的にリン酸化され、FOXOの核外移行を促進することでその転写活性は抑制されます。一方、栄養飢餓状態ではPI3K-AKTの不活性化に伴いFOXOの活性化が誘導されることになります。つまり、カロリー制限による寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています(下図)。

図:様々な増殖刺激によってPI3k/Aktシグナル伝達系が活性化されるとFOXO(Forkhead box O)という転写因子の活性が抑制される。FOXO転写因子が活性化されると酸化ストレスが軽減し、細胞老化が抑制される。Aktの活性化はmTORC1を活性化してがん細胞の増殖を促進する。したがって、PI3k/Aktシグナル伝達系を抑制すると、FOXO転写因子の活性化とmTORC1の抑制の2つの機序で寿命延長とがん抑制の効果が得られることになる。
以上のように、インスリン/IGF-1シグナル伝達系で活性化されるPI3K/Ak/mTORC1の抑制、AMPKの活性化、FOXOの活性化は、がん細胞の発生や増殖を抑制する作用があり、しかも老化を抑制し寿命を延ばす作用があります。
したがって、これらをターゲットにしたがん治療は副作用のない理想的ながん治療法なり得ると言えます。
がん治療で開発された分子標的薬が抗老化治療薬の候補として研究されています。
がんの場合は、そのシグナル伝達系に次々に変異や異常が発生してくるので、治療に抵抗性になってくる可能性があります。
しかし老化予防の目的ではそのような耐性はできないので、これらのがん治療薬をそのまま抗老化薬に使用すると有効性が維持できるというメリットがあると考えられています。
このような薬を低用量で服用すると老化を遅延させ寿命を延ばせると考えられています。薬による寿命延長は線虫やショウジョウバエやマウスなどでは実証されています。霊長類ではカロリー制限による老化遅延と寿命延長は実証されていますが、薬での実験はまだ出ていません。
老化予防は究極のがん予防法と言われています。つまり、がんは老化性疾患の一つであり、老化の過程を抑制することはがんの発生を予防することになります。このような薬ががん予防薬(循環器疾患の予防や寿命延長にも効果がある)として期待されています。
(そのような目的で、糖尿病治療薬のメトホルミンを老化予防効果と寿命延長効果を期待して服用している人は多くいます。DNAの構造の解明でノーベル賞を受賞したジェームズ・ワトソンも抗老化の目的でメトホルミンを服用しているとある講演で言っています。356話参照)
がんになって寿命を延ばすためには、がんと老化の両方に関与しているシグナル伝達系や因子をターゲットにすれば良いといえます。
【カロリー制限と類似の作用を示す2-デオキシ-D-グルコース】
カロリー制限による寿命延長の研究を行っている米国国立老化研究所(National Institute on Aging)のジョージ・ロス(George Roth)博士の研究グループは、カロリー制限と同じ効果を真似る薬の開発において、2-デオキシ-D-グルコース(2-Deoxy-D-glucose:以下2-DG)の可能性を研究していました。
カロリー制限と同じ効果(抗老化や寿命延長効果)を示す薬をCalorie restriction mimetics (CRM:カロリー制限模倣化合物)と言います。
CRMには抗糖尿病薬のメトホルミン、赤ワインに含まれるレスベラトロール、ポリアミンの一種のスペルミジンなども知られていますが、2-DGはCRMとして最初に研究された物質です。現在でも抗老化の観点からの研究は行われています。
2-DGは、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換された物質(グルコース誘導体)です。
2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター:GLUT)を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。
リン酸化されて2-DG-6リン酸になるとGLUTを通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内で蓄積します。
蓄積した2-DG-6リン酸はヘキソキナーゼをフィードバック阻害するので、正常のグルコースの代謝も阻害されます。
グルコース代謝が阻害されてATP量が減少するとAMP活性化プロテイン・キナーゼ(AMPK)が活性化され、活性化されたAMPK はmTORC1(哺乳類ラパマイシン標的タンパク質)を抑制します。mTORC1は老化と発がん過程の両方を促進する働きがあるので、mTORC1の抑制は抗老化と抗がんの両方の効果になります。(下図)
(mTORC1が老化を促進することは362話参照)
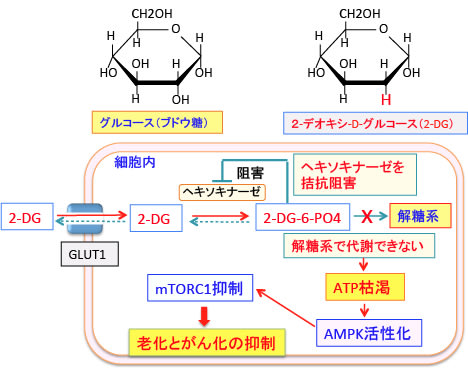
図:2-デオキシ-D-グルコース(2-DG)はグルコースと同様に細胞内に取り込まれ、ヘキソキナーゼで2-DG-6-リン酸(2-DG-6-PO4)に変換されるが、それから先の解糖系酵素で代謝できないので、2-DG-6-PO4でストップしてATP産生ができない。蓄積した2-DG-6-PO4はヘキソキナーゼをフィードバック阻害するので、正常なグルコースの解糖系での代謝も阻害される。その結果、細胞内のATPが減少し、AMP活性化プロテイン・キナーゼ(AMPK)が活性化される。活性化したAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質)を抑制するので、細胞の老化とがん化を抑制することになる。
普通に食事を摂取しても2-DGによってグルコースの代謝を抑制すれば、たくさん食べても太らずにすむし、カロリー制限と同じメカニズムで老化予防に有効ではないかというのが、2-DGの抗老化作用のメカニズムです。線虫の実験では、2-DGが寿命を顕著に延長する結果が得られています。
しかし、ラットの実験では2-DGを大量に長期間投与すると心筋細胞の空砲化と死亡率の上昇などの毒性が確認されています。(Toxicol Appl Pharmacol 243(3): 332-9, 2010年)
つまり、動物にとっては老化予防や寿命延長の目的では2−DGは現実的とは言えないようです。
ただし、てんかんやがんの治療目的においては、臨床効果の方が毒性より上回っていると考えられ、人間での臨床試験が行われています。
また、適量を使用すれば、毒性が出ずに抗老化作用や健康作用が期待できる可能性は残されています。最近も2-DGの抗老化作用に関する研究は幾つも報告されています。
例えば、2-デオキシ-D-グルコースがケトン体の産生を高めて神経細胞におけるミトコンドリアでのエネルギー産生を高めることによってアルツハイマー病を改善する作用が動物実験で確認されています。以下のような論文があります。
2-deoxy-D-glucose treatment induces ketogenesis, sustains mitochondrial function, and reduces pathlogy in female mouse model of Alzheimer's dosease. (メスマウスのアルツハイマー病の実験モデルで、2-デオキシ-D-グルコースはケトン体産生を誘導し、ミトコンドリアの機能を維持し、アルツハイマー病の病状を改善する)PLos ONE 6(7): e21788, 2011
アルツハイマー病が発症する前に神経細胞のミトコンドリアでのエネルギー産生が低下することが報告されており、2-DGはケトン体の産生を増やすことが知られています。この論文では、マウスのアルツハイマー病の実験モデルに2-DGを投与すると、神経細胞のミトコンドリアでのエネルギー産生が増え、ベータアミロイドの沈着などアルツハイマー病の病変が軽減することが報告されています。 カロリー制限やケトン食がアルツハイマー病の治療に有効であることは多くの研究で指示されています。2-DGはカロリー制限と同様な作用を示し、ケトン体の産生を増やす点で抗老化作用が期待されています。
このように解糖系でのグルコースの代謝を2−DGで抑制するとカロリー制限と同じように抗老化作用が期待できます。さらに、2-DGはがん細胞の増殖を抑制する作用があります。
【グルコースの取込みが多いがん細胞は増殖活性が高い】
一般的にグルコースの取込みの多いがん細胞ほど増殖が早く、悪性度が高く、予後が悪いと言えます。
取り込まれたグルコースがエネルギー産生と細胞を構成する成分の合成に使われるからで、グルコースの取込みが多いことは増殖活性が高いことを意味します。
したがって、がん細胞におけるグルコースの取込みや解糖系での代謝を阻害すると、がん細胞の増殖活性を低下させることができます。
また、抗がん剤治療や放射線治療にグルコースの取込みや解糖系を阻害する治療を併用すると、抗がん剤や放射線治療の効き目を高めることができます。
がん細胞が抗がん剤や放射線でダメージを受けても、エネルギー(=ATP)と細胞成分を作る材料、すなわちグルコースが十分に供給されておれば、ダメージを修復して増殖を続けることができます。しかし、がん細胞におけるグルコースの取込みや利用を阻害すれば、ダメージを修復することができません。
グルコースの取込みやエネルギー産生過程を阻害する方法は、抗がん剤や放射線に対するがん細胞の感受性を高める効果が期待でき、がん治療の重要なターゲットになっています。(下図)

図:(上)がん細胞はグルコーストランスポーター1(GLUT1)の発現量が多く、グルコースの取込みと代謝(解糖系とペントース・リン酸経路)が亢進してATP産生と細胞を構成する物質(細胞膜や核酸など)の合成が亢進している。抗がん剤や放射線照射によって細胞がダメージを受けても、グルコースの取込みと代謝の亢進によって、ダメージを修復して増殖活性を維持できる。
(下)グルコースの取込みや代謝が阻害されると、ダメージの修復に必要なATPも物質合成も行えなくなる。そうなると抗がん剤や放射線で受けたダメージを修復できないので、細胞死をきたすことになる。
【2-DGで解糖系を阻害するとがん細胞は死滅する】
2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。
リン酸化されて2-DG-6リン酸になるとGLUT1を通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内でどんどん蓄積します。
2-DG-6リン酸はヘキソキナーゼを阻害するので、正常のグルコースの代謝も阻害されます。
2-DGを取り込んでエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーター(GLUT1)の発現がさらに増え、2-DGの取り込みをさらに増やすことになります。したがって、がん細胞には正常細胞に比べてより多くの2-DGが取込まれ、エネルギー産生と物質合成の阻害による影響はがん細胞で大きくなります。
つまり、糖質制限やケトン食のときに2-DGを併用すると、2-DGが優先的にがん細胞に取り込まれ、解糖系やペントース・リン酸経路を阻害して、がん細胞を内部から崩壊させることができるのです。
2-DGががん細胞の増殖を抑制する効果が指摘されたのは1950年代です。「細胞のエネルギー源であるグルコースの誘導体を取り込ませれば、がん細胞の増殖を抑制できる」というアイデアは、もう60年も前に研究されており、グルコースの誘導体の抗腫瘍活性が検討され、2-DGに強い抗腫瘍効果があることが証明されています。
しかし、2-DGを使ったがん治療は、その後あまり注目されなかったようです。その理由の一つは、前述のように、がんの治療においては、「強い毒性をもった化合物を使ってがん細胞を一掃するような治療法」が1950年代以降は主流になっていたからだと思われます。
そのため、「エネルギー産生経路を阻害してがん細胞の増殖を低下させる」というようなアイデアは注目されなかったのかもしれません。
しかし、ワールブルグ効果が再評価されるようになり、がん細胞のエネルギー産生と物質合成を阻害する方法として、2-DGにも注目が集まるようになり、多くの動物実験で抗腫瘍効果が証明され、人間での臨床試験も実施されるようになったということです。
【2-DGは正常細胞を抗がん剤や放射線のダメージから保護する】
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害するので、がん細胞の増殖速度を低下させる効果があります。
がん細胞のエネルギー産生や物質合成の経路を阻害すると、抗がん剤や放射線に対するがん細胞の感受性が高まります。
2-デオキシ-D-グルコース(2-DG)は抗がん剤や放射線に対するがん細胞の感受性を高めるだけでなく、抗がん剤や放射線による正常細胞のダメージを軽減する効果があるという報告があります。以下のような報告があります。
Protection of normal cells and tissues during radio- and chemosensitization of tumors by 2-deoxy-D-glucose. (2-デオキシ-D-グルコースはがん組織の放射線感受性と抗がん剤感受性を高め、正常細胞と組織のダメージを軽減する)J Cancer Res Ther. 2009 Sep;5 Suppl 1:S32-5.
【要旨】 正常組織への毒性はがん治療における重要な制限因子の一つである。正常組織や重要臓器に対するダメージが大きくなるため、抗がん剤や放射線照射の用量を増やすことができない。そのため治療効果も弱くなる。グルコース類縁体の2-デオキシ-D-グルコース(2-DG)は、解糖系を阻害してATP産生を阻害する作用があり、がん細胞に対する抗がん剤や放射線治療の感受性を高めることが、多くのがん細胞種において認められている。さらに、正常細胞に対しては、放射線や抗がん剤からのダメージを軽減することが報告されている。この総説では、正常細胞や正常組織を抗がん剤や放射線から保護する2-DGの作用機序を考察し、このグルコース類縁体ががん治療において有用な補助療法である根拠を示す。
がん細胞は正常細胞に比べてグルコース(ブドウ糖)の取込みが多く、ATP産生や細胞分裂するための物質合成に大量のグルコースを必要としています。したがって、グルコースの取込みや利用を妨げれば、ATP産生や物質合成が低下し、抗がん剤や放射線治療の効き目が高くなります。
がん細胞はグルコーストランスポーターを多く発現しているので、2-DGの取込みも多く、2-DGによるグルコース代謝の阻害作用が著明に現れます。
培養細胞を使った実験や動物にがん細胞を移植した動物実験で、2-DGを投与すると抗がん剤や放射線治療の治療効果が高まることが多くの実験系で確認されています。
さらに動物実験で、2-DGが脳や心臓に対する抗がん剤や放射線のダメージを軽減する作用が認められています。その作用機序についてはまだ十分に解明されていませんが、AMP活性化プロテインキナーゼ(AMPK)の活性化やオートファジーの阻害など複数のメカニズムが示唆されています。以下のような論文があります。
Caloric restriction mimetic 2-deoxyglucose antagonizes doxorubicin-induced cardiomyocyte death by multiple mechanisms.(カロリー制限と同様の作用がある2-デオキシグルコースはドキソルビシンによる心筋細胞死を複数のメカニズムで阻止する)J Biol Chem. 2011 Jun 24;286(25):21993-2006.
【要旨】
食事からのカロリー摂取を減らすカロリー制限が心血管系の健康状態を良くすることが知られている。グルコース類縁物質の2-デオキシ-D-グルコースはカロリー制限と同様の作用を示すことが複数の動物実験で報告されている。しかしながら、2-DGが心機能に有益な作用を示すかどうかはまだ不明である。
この研究では、抗がん剤で副作用として心筋障害を引き起こすドキソルビシンの投与で引き起こされる心筋細胞死に対して2-DGが抑制作用を示すかどうかを検討した。
新生児ラットの心筋細胞を0.5mMの2-DGで処理すると、ドキソルビシンで誘導される心筋細胞のダメージや細胞死を顕著に抑制した。
2-DGは細胞内ATP量を17.9%低下させたが、ドキソルビシンによって引き起こされる著明なATP枯渇は阻止し、これが2-DGによる心筋細胞死の抑制に寄与していると考えられた。
さらに、2-DGはAMP活性化プロテインキナーゼ(AMPK)の活性を高めた。
AMPKシグナルの阻害剤(compound Cまたは干渉RNA)を投与すると、2-DGの心筋細胞保護作用は阻止された。
逆に、薬や遺伝子的方法でAMPK活性を増強すると、ドキソルビシンの心筋細胞障害は抑制された。2-DGとAMPK活性化剤を併用すると相加効果は認めなかった(注:両方とも同じ機序でドキソルビシンによる心筋障害を抑制するので、併用しても相加や相乗効果は得られないということ)
さらに2-DGはオートファジー(自食作用)を誘導するが、このオートファジーは細胞内タンパク質の分解であり、その活性化は細胞の状況によって良い場合(細胞障害から保護する)と悪い場合(細胞障害を悪化する)がある。
2-DGはオートファジーを活性化するが、ドキソルビシンによって引き起こされる細胞障害性のオートファジーは阻止した。
以上のことから、カロリー制限と同様な作用を示す2-DGはドキソルビシンで誘導される心筋細胞のダメージや細胞死を阻止することが明らかになり、その作用機序としては、ATP量の維持、AMPKの活性化、ドキソルビシンによって誘導されるオートファジーの阻害など複数のメカニズムが関与していることが示唆された。
このように、2-DGはがん細胞の抗がん剤感受性や放射線感受性を高め、正常細胞に対しては抗がん剤や放射線のダメージから守る作用があります。
また、抗がん剤や放射線治療に2-DGを併用すると抗腫瘍免疫を誘導できることが報告されています(341話参照)
また、がんや感染症に対する免疫応答で重要な記憶キラーT細胞(memory CD8+T cell)の働きを高めるという報告もあります。以下のような論文があります。
Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function.(解糖系の阻害はCD8+ Tリンパ球の記憶と抗腫瘍作用を亢進する)J Clin Invest. 2013 Oct 1;123(10):4479-88.
抗原と出会う前のT細胞はナイーブT細胞といわれ、この状態では特に何も仕事をしません。
樹状細胞による抗原提示によって活性化されると、ナイーブT細胞は増殖してエフェクターT細胞という仕事をする細胞になります。エフェクター細胞は、病原体やがん細胞を攻撃します。エフェクター細胞の多くは死滅しますが、一部がメモリーT細胞として残り、長期にわたって体内に維持され、抗原に出会うと直ぐにエフェクター細胞(細胞傷害性T細胞)になって、抗原特異的な免疫応答を起こします。
2-DGはこのメモリーT細胞の数を増やし、抗腫瘍免疫を高めるという報告です。T細胞のエネルギー産生は、増殖の盛んなエフェクターT細胞では解糖系への依存が高く、増殖活性の低いナイーブT細胞とメモリーT細胞では解糖系への依存は低く、脂肪酸の燃焼によるエネルギー産生に依存しているという特徴があり、そのため、解糖系を阻害する2-DGは免疫記憶を高めるというメカニズムです。
以上のように、2-DGは様々なメカニズムで抗腫瘍作用を示し、特に抗がん剤や放射線治療との併用で、抗腫瘍効果を高めるだけでなく、正常細胞を保護する作用もあるので、がん治療の補完として利用価値は高いと言えます。適切な量を使用すれば抗老化にも有効かもしれません。
画像をクリックするとサイトに移行します。
| « 380)オピオイ... | 382)寿命を延... » |





