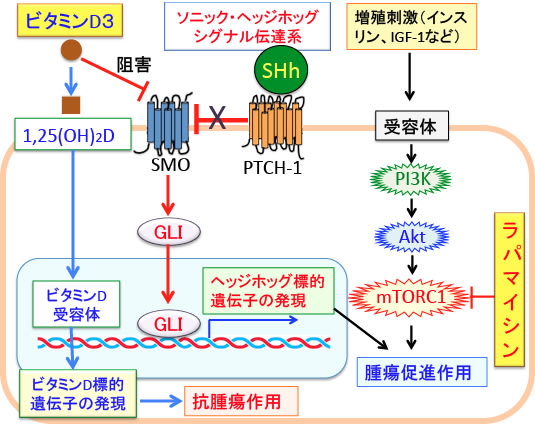
図:ビタミンD3(コレカルシフェロール)は肝臓と腎臓で活性型の1,25ジヒドロキシビタミンD3(1,25(OH)2D)に変換され、ビタミンD受容体に結合してビタミンD標的遺伝子の発現を亢進して、がん細胞に対して増殖抑制・分化誘導・アポトーシス誘導などの抗腫瘍作用を示す。ソニック・ヘッジホッグ・シグナル伝達系とPI3K/Akt/mTORC1シグナル伝達系はがん細胞の増殖や浸潤を促進し、抗がん剤抵抗性を引き起こすなどの腫瘍促進作用を示す。ビタミンD3はSmoothened(SMO)を阻害することによってソニック・ヘッジホッグシグナル伝達系を阻害し、ラパマイシンはmTORC1を直接阻害する。したがって、ビタミンD3(コレカルシフェロール)とラパマイシンはそれぞれの抗腫瘍効果を相乗的に増強する。
395)ビタミンD3とラパマイシンの相乗効果
【ビタミンD3はmTORC1活性を阻害する】
ビタミンD3が循環器疾患やがんを含めて全死因死亡率を低下させることは前回(394話)解説しました。
全死因死亡率を低下させるということは寿命を延ばすことになります。
寿命を延ばす最も確実な方法はカロリー制限ですが、このカロリー制限と同じ効果(抗老化や寿命延長効果)を示す薬をCalorie restriction mimetics (CRM:カロリー制限模倣化合物)と言い、
CRMには2-デオキシ-D-グルコース(381話)、D-グルコサミン(387話)、抗糖尿病薬のメトホルミン(384話)、mTORC1阻害剤のラパマイシン(383話)、赤ワインに含まれるレスベラトロール、ポリアミンの一種のスペルミジン、生薬成分のベルベリンなどが知られています。
そして、最近はビタミンDも寿命を延ばす物質のリストに入っています。
寿命を延ばすメカニズムとしては、解糖系の阻害やmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性抑制などがあります。
ビタミンDは、血清カルシウム濃度の恒常性や骨代謝における作用が主な働きだと考えられていますが、最近の研究によって、細胞の増殖や分化や細胞死(アポトーシス)や免疫機能など多彩な生理活性の制御に重要な役割を担っていることが明らかになっています。
ビタミンDがmTORC1の活性を抑制する作用も報告されています。
これは、活性型ビタミンD3(1,25(OH)2ビタミンD3)がビタミンD受容体を介するメカニズムでDDIT4(DNA-damage-inducible transcript 4)という遺伝子の発現を亢進し、このDDIT4がTuberous Sclerosis Complex 1/2(TSC1/2)を活性化し、これがRheb(Ras homolog enriched in the brain)を阻害してmTORC1の活性を抑制するという作用機序です。(下図)
ラパマイシンはmTORC1を直接阻害するのですが、ビタミンD3はDDIT4とTSC1/2とRhebを介して間接的にmTORC1の活性を抑制する作用があるという報告です。全ての細胞に当てはまるわけではありませんが、一部のがん細胞(前立腺がん細胞など)では活性型ビタミンD3がmTORC1の抑制に関与している可能性が報告されています。

図:インスリンやインスリン様成長因子-1(IGF-1)などの増殖刺激はPI3K/Akt/mTORC1シグナル伝達系を活性化して、がん細胞の増殖や浸潤や転移を促進し、抗がん剤抵抗性を亢進する。ラパマイシンはmTORC1の活性を直接阻害する。ビタミンDはビタミンD受容体を介する遺伝子転写活性によってDDIT4(DNA-damage-inducible transcript 4)タンパク質の発現を亢進し、このDDIT4はTuberous Sclerosis Complex 1/2(TSC1/2)を活性化し、これがRheb(Ras homolog enriched in the brain)を阻害してmTORC1の活性を抑制するというメカニズムが報告されている。
【ビタミンD3はヘッジホッグ・シグナル伝達系を阻害する】
胚発生や成長の過程に関与する遺伝子やシグナル伝達系は、細胞の増殖や移動や分化の制御に重要な役割を果たしています。したがって、このような遺伝子やシグナル伝達系の異常は、がん細胞の発生や進行にも関与しています。つまり、がん遺伝子やがん抑制遺伝子の候補になります。
このような胎生期とがん発生過程に共通に関わっているシグナル伝達系の一つにヘッジホッグ・シグナル伝達系があります。
ヘッジホッグ・シグナル伝達系は、ショウジョウバエからヒトに至るまで進化的に保存されており、胎生期における組織や臓器の発生や成長において、細胞の増殖や分化や組織形成など多くの過程に重要な働きを行っています。
成長した組織においては、組織幹細胞の維持や、傷害を受けた組織の修復や再生に重要な役割を担っています。
ソニック・ヘッジホッグは細胞内で合成されてから分泌され、その細胞自身(オートクリン)あるいは近くの細胞(パラクリン)の細胞膜にあるPatched-1 (PTCH-1)に結合することによってこのシグナル伝達系が活性化されて、細胞の増殖や移動や分化などの調節を行います。
ヘッジホッグ(Hedgehog)というのはハリネズミのことで、ヘッジホッグ遺伝子の機能を失ったショウジョウバエの胚が小さな歯のような突起物が密集しており、ハリネズミに似ていることからこのような名前になっています。
哺乳類のヘッジホッグにはソニック・ヘッジホッグ(Sonic Hedgehog)、インディアン・ヘッジホッグ(Indian Hegdehog)、デザート・ヘッジホッグ(Desert Hedgehog)の3種類がありますが、最も研究されているのは全身に発現が見られるソニック・ヘッジホッグ・シグナル伝達系です。
インディアン・ヘッジホッグ(インドはりねずみ)とデザート・ヘッジホッゴグ(エチオピアはりねずみ)は実在するハリネズミの種類から命名されていますが、ソニック・ヘッジホッグはセガ・ジェネシスのキャラクターのソニック・ザ・ヘッジホッグから名付けられています(下図)。つまり、ソニックヘッジホッグタンパク質は研究者の洒落で命名されたタンパク質です。

ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある12回膜貫通型の受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグが結合することによって開始されます。
PTCH-1は7回膜貫通型のGiタンパク質共役受容体のSmoothened (SMO)を阻害する作用がありますが、PTCH-1にソニック・ヘッジホッグが結合するとPTCH-1のSMOを阻害する作用が失われます。その結果、SMOが活性化され、活性化したSMOによって転写因子のGLIが活性化されてヘッジホッグ標的遺伝子の発現が活性化されることになります。(下図)
つまり、PTCH-1は発がんを抑制するがん抑制遺伝子であり、SMOはがん化を促進するがん遺伝子の作用を持っています。

図:ソニック・ヘッジホッグ(SHh)が無いときは、PTCH-1(Patched-1)がSMO(Smoothened)を阻害しているので、このシグナル伝達系は作動しない。ソニック・ヘッジホッグ(SHh)が存在すると(産生されると)、SHhがPTCH-1に結合し、SMOの阻害は解除され、SMOは下流のシグナル伝達系を介して転写因子のGLIを活性化し、ヘッジホッグ標的遺伝子を活性化する。
基底細胞がん、髄芽腫、悪性リンパ腫、白血病、卵巣がん、乳がん、膵臓がん、肺がん、肝臓がん、胃がん、結腸直腸がん、前立腺がん、膀胱がんなど多くのがん細胞種において、ヘッジホッグ・シグナル伝達系の異常な活性化が観察されています。
人間のがんの30%以上にヘッジホッグシグナル系の亢進が認められるという報告もあります。
基底細胞がんや髄芽腫ではほぼ100%の腫瘍にヘッジホッグ系に異常が認められ、膵臓がんでは70%以上に異常が認められると報告されています。
ヘッジホッグシグナル伝達系の活性亢進は、がんの発生過程だけでなく、より浸潤性の高いがん細胞への変化や抗がん剤治療への抵抗性を引き起こしています。
したがって、この経路を阻害すると、がん細胞の増殖や転移を抑制し、抗がん剤治療が効きやすくなることが予想できます。特にmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性とヘッジホッグ・シグナル伝達系の2つの経路を同時に阻害すると、抗腫瘍効果が相乗的に高まることが多くの研究で示されています(後述)。
ビタミンD3はヘッジホッグ・シグナル伝達系を阻害する作用が報告されています。以下のような報告があります。
Vitamin D3 triggers antitumor activity through targeting hedgehog signaling in human renal cell carcinoma.(ビタミンD3はヒト腎臓がん細胞においてヘッジホッグ・シグナル伝達系を介する機序で抗腫瘍活性を引き起こす)Carcinogenesis. 33(11): 2084-93, 2012年
【要旨】
人間の淡明細胞型腎細胞がん(clear cell renal cell carcinoma)は、近年における分指標的薬の進歩にもかかわらず、多くは治療抵抗性である。腎臓の臓器発生の過程で活性化するシグナル伝達系の幾つかは、腎細胞がんの発生過程で再び活性化される。そのようなシグナル伝達系の一つがソニック・ヘッジホッグ-Gliシグナル伝達系である。
興味深いことに、活性型ビタミンD3の前駆体であるコレカルシフェロール(cholecalciferol)が、ソニック・ヘッジホッグ-Gliシグナル伝達系を強力に阻害する作用を有することが報告されている。そこでこの研究では、細胞培養による実験系(in vitro)と移植腫瘍を用いた動物実験系(in vivo)において、淡明細胞型腎細胞がんに対するビタミンD3(コレカルシフェロール)の前臨床的な有効性を検討した。
淡明細胞型腎細胞がんの複数の細胞株と、淡明細胞型腎細胞がん患者から採取した腫瘍組織と正常組織において、ビタミンD3受容体とビタミンD3の代謝酵素の発現状況と、コレカルシフェロール投与による効果を検討した。
さらに、淡明細胞型腎細胞がん細胞を移植したマウスの実験系を用いて、コレカルシフェロールのがん細胞の増殖抑制や縮小効果を検討した。その有効性や副作用については週に1回の観察をもとに評価し、さらに血液検査やCT検査によって評価した。
ヒトの淡明細胞型腎細胞がんでは、ビタミンD3受容体とビタミンD3を活性型に変換する代謝酵素の発現量が顕著に低下していた。
コレカルシフェロールの投与は、ソニック・ヘッジホッグ-Gliシグナル伝達系を阻害して、がん細胞の増殖を抑制し、細胞死を増加した。
がん細胞を移植したマウスの実験系では、コレカルシフェロールの投与により、がん組織の発生が阻止され、がん組織が増大してから投与した場合はがん組織を縮小した。
ビタミンD3投与による副作用(石灰化やカルシウムの再吸収)は認めず、安全性には問題なかった。
これらの結果より、淡明細胞型腎細胞がん細胞ではビタミンD3受容体も、ビタミンD3を活性型に変換する代謝酵素も欠損していたが、ビタミンD3の投与は、淡明細胞型腎細胞がん細胞におけるソニック・ヘッジホッグ・シグナル伝達系の再活性化を阻止する強力な治療法であり、その結果、腫瘍を縮小させる効果がある。つまり、コレカルシフェロールはヒトの淡明細胞型腎細胞がんにおいて有効性の高い治療法かもしれない。
淡明細胞型腎細胞がんではビタミンD3の受容体も活性型に代謝する酵素も発現が無いという結果ですが、他の多くのがん細胞ではビタミンD受容体は発現しており、活性型ビタミンD3の 1,25(OH)2ビタミンD3ががん細胞の増殖を抑制し分化を誘導する作用を持つことが多くの研究で証明されています。
さらに、ビタミンD3自体にソニック・ヘッジホッグ・シグナル伝達系を阻害する作用が明らかになっています。そのメカニズムはSmoothened(SMO)の働きを阻害するためと言われています。
ビタミンD3の活性型であるカルシトリオール(1,25(OH)2D3)もSMOに作用してソニック・ヘッジホッグ・シグナル伝達系を阻害する作用が報告されています。
つまり、紫外線で皮膚で作成されたビタミンD3や食品やサプリメントで摂取されたビタミンD3は、それ自体でソニック・ヘッジホッグ・シグナル伝達系を阻害して抗腫瘍作用を示し、さらにビタミンD3が活性化された1,25(OH)2ビタミンD3(カルシトリオール)はビタミンD3受容体を介した転写活性によってがん細胞の増殖抑制や分化誘導を引き起こします。(下図)
がん治療において、数千国際単位から数万国際単位の高濃度のビタミンD3の補充は、試してみる価値はあるように思います(
394話参照)。米国では1カプセルが10000 IU以上の製剤も普通のサプリメントとして販売されています。

図:ビタミンD3(コレカルシフェロール)は肝臓で25位が水酸化されて25(OH)ビタミンD3となり、さらに腎臓で1位が水酸化されて1,25(OH)2ビタミンD3となって活性型となる。1,25(OH)2ビタミンD3はビタミンD受容体(VDR)と結合し、9-シス-レチノイン酸(9-シス-RA)と結合したレチノイドX受容体(RXR)とヘテロダイマーを形成して遺伝子のプロモーター領域のビタミンD応答配列に結合してビタミンDの標的の遺伝子の転写を促進する。ビタミンDの標的遺伝子の発現を誘導することによって、ビタミンDはカルシウム代謝の制御や細胞増殖抑制、分化誘導、アポトーシス誘導などの生理活性を示す。一方、ビタミンD3と1,25(OH)2ビタミンD3はSmoothened(SMO)の活性を阻害する作用によってソニック・ヘッジホッグ・シグナル伝達系を阻害する。
(レチノイドX受容体とビタミンD受容体の関係については370話と371話を参照)
【mTORC1阻害剤とビタミンDの相乗効果】
次のような論文があります。
Inhibition of mTORC1 by RAD001 (everolimus) potentiates the effects of 1,25-dihydroxyvitamin D(3) to induce growth arrest and differentiation of AML cells in vitro and in vivo.(RDA001(エベロリムス)によるmTORC1の阻害は、培養細胞と動物実験の実験系において急性骨髄性白血病の増殖抑制と細胞分化を誘導する1,25ジヒドロキシ・ビタミンD3の効果を増強する)Exp Hematol. 38(8):666-76. 2010年
【要旨】
目的:活性型ビタミンDである1,25-ジヒドロキシ・ビタミンD3(1,25(OH)2D3)による分化誘導療法は急性骨髄性白血病の治療に有用である。我々は以前の研究において、Gemini-23-yne-26,27-hexafluoro-ビタミンD3が乳がん細胞株MCF-7細胞の増殖を阻害し、そのメカニズムとして哺乳類ラパマイシン標的タンパク質(mTOR)シグナル伝達系の阻害と関連していることを明らかにした。そこで、この研究では、急性骨髄性白血病における1,25(OH)2D3とラパマイシン誘導体のRAD001(エベロリムス)の相互作用を検討した。
材料と方法:U937細胞の増殖と分化に対するRAD001と1,25(OH)2D3の作用は、コロニー形成法と細胞膜抗原CD11bの発現量と飲食能(endocytic capability)で評価した。Akt/mTOR複合体-1(mTORC1)シグナル伝達系と細胞周期関連タンパク質に対するRAD001と1,25(OH)2D3の作用はウェスタンブロット法で検討した。
p21(waf1)遺伝子のプロモータ−活性に対するRAD001と1,25(OH)2D3の作用は、リポーター遺伝子アッセイ法と免疫沈降法で検討した。
生体内(in vivo)におけるRAD001と1,25(OH)2D3の作用は、U937細胞を移植したマウスの実験系で検討した。
結果:急性白血病細胞の増殖停止と細胞分化誘導を引き起こす1,25(OH)2D3の効果は、ラパマイシン誘導体のRAD001によって増強され、その増強作用はmTORC1の基質であるS6Kタンパク質と4E-BP1タンパク質の発現抑制と関連していた。
さらに、1,25(OH)2D3によって誘導されるp21(waf1)遺伝子の転写活性はRAD001によって顕著に増強された。この作用は、U937細胞において、ヒストンH3のアセチル化のレベルとp21(waf1)遺伝子のプロモーター領域に結合したビタミンD受容体の量の増加と関連していた。
さらに、ヌードマウスにU937細胞を移植した実験モデルで、1,25(OH)2D3は移植腫瘍の増殖を抑制したが、この増殖抑制作用をRAD001(1日おきに3mg/kgを投与)は顕著に増強した。
結論:活性型ビタミンD3の1,25(OH)2D3とmTORC1阻害剤の同時投与は急性骨髄性白血病の治療法として有望かもしれない。
p21(waf1)は細胞周期の進行を阻害するタンパク質で、このタンパク質が誘導されることは細胞増殖の阻害を意味します。p21(waf1)はp21Cip1とも呼ばれます。
活性型ビタミンD3の1,25(OH)
2D3がビタミンD受容体と結合すると、
9-cisレチノイン酸が結合した
レチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成し、ビタミンD標的遺伝子のプロモーター上流に存在する特異的エンハンサー配列である
ビタミンD応答配列(vitamin D response element: VDRE)に結合し、ビタミンDの標的遺伝子の発現を誘導します。
(レチノイドX受容体とビタミンD受容体の関係については370話と371話を参照)
p21Cip1 遺伝子のプロモーター上流にビタミンD応答配列が存在し、ビタミンD受容体による直接的な遺伝子制御でp21Cip1遺伝子が発現誘導されることが明らかになっています。
ビタミンD応答配列はp27Kip1にもあります。
p21waf1(あるいはp21Cip1)とp27Kip1の2つのタンパク質は細胞周期のG0/G1停止を引き起こすサイクリン依存性キナーゼ阻害因子です。
つまり、ビタミンD3は受容体を介した遺伝子転写活性を制御することによって、細胞の増殖や分化や細胞死(アポトーシス)を調節しています。このビタミンDの抗腫瘍効果をmTORC1阻害剤が増強するという研究結果です。
ビタミンD3とラパマイシンあるいはラパマイシン誘導体を併用すると抗腫瘍効果を高めることができるという結論です。
ビタミンD3およびその活性型の1,25(OH)2ビタミンD3はビタミンD受容体を介するメカニズムの他に、mTORC1の活性やヘッジホッグ・シグナル伝達系を阻害することによってがん細胞の増殖を阻害します。
mTORC1は細胞周期の進行を促進する作用やタンパク質の合成を亢進する作用があり、がん細胞の増殖を促進する方向で働きます。したがって、mTORC1の直接的阻害剤のラパマイシンおよびラパマイシン誘導体はビタミンD3の抗腫瘍効果を増強することができます。これが、ビタミンD3とラパマイシンの併用によるがん治療の根拠になります。
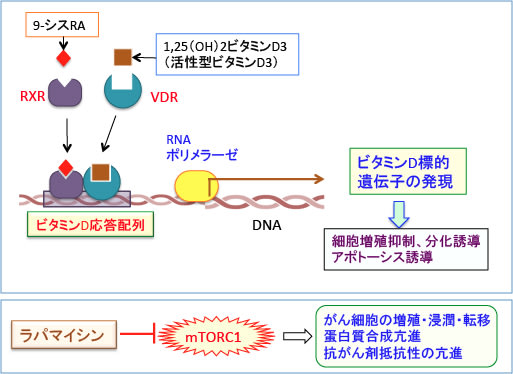
図:活性型ビタミンD3(1α,25(OH)2ビタミンD3:Calcitriol)と結合したビタミンD受容体(VDR)は9-シス-レチノイン酸に結合したレチノイドX受容体(RXR)とヘテロ二量体を形成してビタミンD標的遺伝子の上流にあるビタミンD応答配列に結合し、標的遺伝子の転写が亢進する。ビタミンD標的遺伝子の発現はがん細胞の増殖を抑制し、細胞分化を誘導し、細胞死(アポトーシス)を亢進する。一方、ラパマイシンはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性を阻害することによって、がん細胞の増殖を抑制し、抗がん剤抵抗性を抑制する。したがって、ビタミンD3とラパマイシン(あるいはラパマイシン誘導体)の併用は相乗的な抗腫瘍効果が期待できる。
【膵臓がんのがん幹細胞ではmTORとヘッジホッグ経路が活性化している】
がん幹細胞はがん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境中に存在し、周りの細胞から分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
がん幹細胞の自己複製や増殖を制御しているシグナル伝達系としてヘッジホッグ(Hedgehog)、mTOR、Notch、Wnt-β-Cateninなどがあります。
膵臓がんのがん幹細胞ではmTORの活性とヘッジホッグシグナル伝達系の活性が非常に亢進しており、これらの経路を阻害すると抗がん剤治療の効果が高まるという報告があります。
Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer.(ヒト膵臓がんの腫瘍形成性がん幹細胞を消滅させる標的治療の組合せ)Gastroenterology. 137(3):1102-13. 2009年
【要旨】
研究の背景と目的:膵臓がんは、腫瘍形成性のがん幹細胞の存在により、抗がん剤治療に対して非常に強い抵抗性を示し、ジェムザール治療中もがん幹細胞は生き延び、数を増やしている。ソニック・ヘッジホッグ・シグナル伝達系と哺乳類ラパマイシン標的タンパク質(mTOR)は、いずれもがん幹細胞の自己複製に必須であるため、膵臓がん治療の新たなターゲットとして期待できる。
方法:膵臓がんの培養細胞を使った実験系と動物移植腫瘍を使った実験系を用いて、腫瘍形成性がん幹細胞に対するソニック・ヘッジホッグ阻害剤(cyclopamine/CUR199691)とmTOR阻害剤(ラパマイシン)の効果を検討した。
結果:ソニック・ヘッジホッグ阻害剤のシクロパミン(cyclopamine)もラパマイシン(rapamycin)もそれぞれ単独ではがん幹細胞の数を減らすことはできなかった。また、それぞれを単独で抗がん剤治療と併用した場合もがん幹細胞の数を減らすことはできなかった。ソニック・ヘッジホッグ阻害とmTOR阻害と抗がん剤の3つを同時に併用した場合にのみ、がん幹細胞の数が検出できないレベルまで減少することが、培養細胞を使ったin vitroの実験と移植腫瘍を用いた動物実験(in vivo)の両方で認められた。これら3種類を組み合わせた治療によって、ヒト由来の膵臓がん細胞を移植されたマウスは生存期間が顕著に延長した。
結論:ソニック・ヘッジホッグとmTORの両方のシグナル伝達系の阻害を通常の抗がん剤治療と併用することによって膵臓がんのがん幹細胞を消滅させることが可能になる。この治療法をさらに検討することは、治療が困難で予後が極めて不良な膵臓がんの新たな治療法の開発につながる。
この実験で使用されているシクロパミン(cyclopamine)は米国に自生するバイケイソウという植物からみつかった天然有機化合物で、ヘッジホッグシグナル伝達系を阻害する作用があり、この誘導体ががん治療薬として開発されています。(バイケイソウを食べた羊から生まれた子羊に単眼症などの奇形が多く発生し、その原因物質としてシクロパミンが同定され、これがヘッジホッグ経路を阻害するために胚発生過程の臓器形成に異常が生じて奇形が起こることが明らかになっている)
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。がん細胞や肉腫細胞の多くにおいてmTORが活性化されており、mTORの阻害はがん細胞や肉腫細胞の増殖を抑制し、抗がん剤や放射線治療の効き目を高める効果や細胞死(アポトーシス)を誘導する効果が示されています。すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。
mTORもがん幹細胞の自己複製や増殖や抗がん剤耐性に関与していることが報告されています。
実験系(膵臓がんの細胞株の違いに基づく)によっては、ラパマイシンによるmTORの阻害だけでも膵臓がん細胞の増殖を抑える効果が認められています。
がん幹細胞は、成熟したがん細胞に比べて抗がん剤や放射線に抵抗性が強いため、治療後の再発の原因となっています。がん幹細胞を死にやすくすることががん治療の効果を高めることができるのですが、がん幹細胞は様々なメカニズムで死ににくくなっており、一つの方法だけでは限界があるようです。
この論文でも、抗がん剤治療+ソニック・ヘッジホッグ阻害も抗がん剤治療+mTOR阻害もがん幹細胞を減らすことができなかったという結果です。しかし、抗がん剤治療+ソニック・ヘッジホッグ阻害+mTOR阻害の3つを組み合わせると、膵臓がんのがん幹細胞を消滅できたという結果です。
膵臓がんに対するジェムザールの効果は極めて低いのですが、mTOR阻害とソニック・ヘッジホッグ阻害の2つを併用すると奏功率を高めることができるかもしれません。
つまり、mTOR阻害剤のラパマイシンあるいはラパマイシン誘導体とソニック・ヘッジホッグ・シグナル伝達系阻害剤のビタミンD3や半枝連・白花蛇舌草・ベツリン酸(
363話参照)などの併用は膵臓がんの抗がん剤治療に併用する価値はあるかもしれません。
394話の内容と今回の内容から、
健常人では1日1000~2000 IUのビタミンD3の摂取は病気を予防し寿命を延ばす効果が期待できると言えます。がん治療中のがん患者さんは1日2000~4000 IUのビタミンD3のサプリメントを摂取する方が良いというエビデンスは十分にあると言えます。
進行がんの患者さんは、1日10,000~40,000 IUのビタミンDとレチノイド(イソトレチノイン)とラパマイシン(1日5mg程度)を併用すると、ビタミンD受容体を介した転写活性化のメカニズムと、ヘッジホッグ・シグナル伝達系とmTORC1活性の阻害を介したメカニズムで、抗腫瘍効果が期待できる可能性があります。
米国では1カプセルが10,000 IU以上のビタミンD3のサプリメントが安価に販売されています(1ヶ月分で数千円)。イソトレチノインはニキビの治療薬として有名ですが、ニキビ以外の多くの疾患に適応外使用されており、がん治療でも使用されています(次回解説)。これも比較的安価で1ヶ月分が1~2万円程度です。
ラパマイシンもジェネリックなどを使うと1ヶ月で数万円程度です。
ビタミンD3+イソトレチノイン+ラパマイシンの組合せは進行がんの代替医療として効果が期待できるように思います。
◎ ビタミンD3とイソトレチノインとラパマイシンとメトホルミンの相乗効果についてはこちらへ:


画像をクリックするとサイトに移行します。

ビタミンD3のサプリメント:
1カプセル1000 IU/250錠(6300円)
米国:DaVinci Laboratories of Vermont
購入ご希望の方は銀座東京クリニックにお問い合わせください。