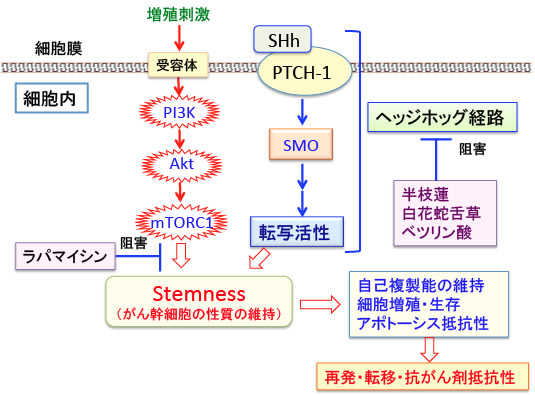
図: PI3K/Akt/mTOR経路とヘッジホッグ(Hedgehog)経路は、自己複製能や不均等分裂などのがん幹細胞(Cancer Stem Cell)の性質を維持する上で重要は役割を果たしている。PI3K/Akt/mTOR経路は増殖因子や栄養によって活性化され、セリン・スレオニンキナーゼのmTORを活性化して様々なタンパク質をリン酸化して活性化することによって細胞の増殖を促進する。ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグ(SHh)が結合することによって開始され、smoothened(SMO)を介してシグナルが伝達され、転写因子の活性化によって細胞の増殖や分化を制御する。この2つの経路を阻害するとがん幹細胞の増殖を抑え、抗がん剤感受性を高めることが報告されている。mTORの阻害剤としてラパマイシンやラパマイシン誘導体がある。ヘッジホッグ経路の阻害剤としては医薬品として開発されたものもあるが、抗がん生薬として古くからがん治療に使用されている半枝蓮や白花蛇舌草や植物に含まれるベツリン酸などのトリテルペノイド類にヘッジホッグ経路の阻害作用が報告されている。
363)mTORとヘッジホッグ経路とがん幹細胞:ラパマイシンと半枝蓮と白花蛇舌草の相乗効果
【がんは遺伝子変異の蓄積によって発生する】
私たちの体は様々な機能や形態をもった細胞から成り立っていますが、全ての細胞も元を正せば一つの受精卵が分裂して増えていったものです。たった一つの受精卵が分裂を繰り返し、ある細胞は心臓を作り、ある細胞は脳を作り出します。
このように体の臓器や組織を作っていく過程で、個々の細胞が特徴的な機能や形態を獲得していくことを「分化」といいます。肝細胞や心筋細胞や神経細胞などへ分化していった細胞が集まって、肝臓や心臓や脳などの臓器が形成されるのです。
体を構成する細胞は分化により形態や機能が異なっても、すべて同じ遺伝情報を持っています。
遺伝子(遺伝情報を担う構造単位で、通常1つの蛋白質を作り出すことができる)の情報は細胞の核の中にある染色体のDNA(デオキシリボ核酸)に書き込まれています。
DNAは2本のロープがより合わさったような二重らせん構造になっており、そこには4種類の塩基という物質(アデニン、グアニン、シトシン、チミン)が、文字列のように延々と一列に並んでおり、その配列を読み取って体に必要な蛋白質を作り出しています。
遺伝子(DNA)の情報がmRNA(メッセンジャーRNA)に転写され、さらに蛋白質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います(下図)。

一つの細胞核に含まれる染色体の一組をゲノムといい、ヒトの場合1ゲノムは46個(22対の常染色体と1対の性染色体)の染色体があります。
1ゲノム中には合計約30億塩基対の塩基配列情報が記録されており、これに含まれる遺伝子の数は22000個程度であることが明らかになっています。
約22000個ある遺伝子のうち、細胞の分化や増殖や細胞死の調節に関わる遺伝子に異常(DNA変異や発現異常など)が起こって、無制限な増殖や周囲組織への浸潤や遠隔臓器へ転移して全身に広がる性質を獲得した異常細胞ががん細胞です。
DNA(デオキシリボ核酸)の遺伝情報には、細胞を形作り機能させるための蛋白質の作り方と、その発現の量や時期を調節するために必要なマニュアルが組み込まれています。したがって、この遺伝子情報に誤りが生じるとその細胞の働きに異常が生じます。
例えば、正常な細胞であれば、止めどなく分裂増殖を繰り返すということはありません。それは遺伝子(DNA)の情報によって、分裂増殖のペースや限度がコントロールされているからです。
しかし、この細胞増殖をコントロールしている遺伝子(がん遺伝子やがん抑制遺伝子)に異常が生じると細胞は際限なく分裂を繰り返すがん細胞となるのです。
誤りを起こす原因は、DNAに傷がついて間違った塩基に変換したり、遺伝子が途中で切れたりするためです。これをDNAの「変異」と呼び、DNA変異を引き起こす物質を変異原物質とよびます。
環境中には、たばこ・紫外線・ウイルス・添加物など変異原物質が充満しています。変異原物質は、活性酸素のように体内でのエネルギー産生や物質代謝や慢性炎症の過程でも作られます(下図)。
変異原物質の共通の性質は強い化学反応性を持ち、フリーラジカルを生成する点にあります。フリーラジカルとは反応性の高まって他の物質を酸化する原子や分子のことです。化学反応性に富むため、DNAと反応してDNA変異を生じさせるのです。一方、抗酸化剤やラジカル消去剤が、がんの発生や進展に対して抑制効果があるのは、フリーラジカルによるDNA変異の機会を減らすからです。
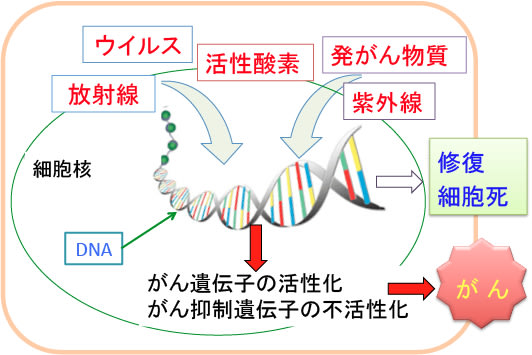
図:放射線やウイルスや活性酸素や発がん物質や紫外線などによって遺伝子(DNA)に変異が生じると、その変異は修復されるか細胞死(アポトーシス)が誘導されて除去される。遺伝子変異の除去が十分に行われなければ、次第に細胞(組織幹細胞)に遺伝子変異が蓄積し、がん遺伝子の活性化やがん抑制遺伝子の不活性化によって細胞はがん化する。
【組織の幹細胞の遺伝子変異の蓄積ががん細胞を発生させる】
発がんに関係している遺伝子(がん遺伝子やがん抑制遺伝子)は多数見つかっており、そのうちの数個から十個程度の遺伝子に変異が蓄積した時に、正常な増殖制御を行ううえでの限界が訪れ、がん細胞が発生すると考えられています。
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。
組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。
組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています(下図A)。成人では1日に約1兆個の幹細胞が細胞分裂を行っています。
例えば、大腸粘膜組織の幹細胞は陰窩の最底部、基底膜直上に存在しており、自己複製によって幹細胞を維持すると同時に、不均等分裂によって分化した粘膜上皮細胞を作り出しています。粘膜上皮細胞に分化した細胞は、消化管内腔側に向かって移動し、数日で細胞死(アポトーシス)を起こして消化管内に脱落します。
胃や食道や小腸でも、粘膜上皮の底部付近に幹細胞が存在し、粘膜上皮細胞が供給されています(下図B)。

図(A)組織の細胞には幹細胞と成熟した体細胞が存在する。幹細胞は組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出している。
(B)消化管粘膜組織の幹細胞は陰窩の最底部に存在しており、自己複製によって幹細胞を維持すると同時に、不均等分裂によって分化した粘膜上皮細胞を作り出している。粘膜上皮細胞に分化した細胞(体細胞)は、消化管内腔側に向かって移動し、数日で細胞死(アポトーシス)を起こして消化管内に脱落する。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができ(自己複製能)、またいろいろな細胞に分化できる(多分化能)という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。
体細胞のDNAに変異が発生しても、これはがん細胞にはなりません。例えば大腸の粘膜上皮細胞は1週間程度で死滅して新しい細胞に置き換わっているため、このような短寿命の体細胞にがん化するほどの複数の変異が蓄積することは考えにくいと言えます。
つまり、短期間でアポトーシスによって死滅する運命の成熟(=分化)した体細胞に遺伝子変異が生じても、がん細胞に変化するとは考えにくいのです。細胞ががん化するためには、複数のがん遺伝子やがん抑制遺伝子の異常が蓄積する必要があるからです。
そこで、「組織に持続的に存在する幹細胞の遺伝子に変異が蓄積することによってがん細胞が発生する」と考えられています。
実際に、がん組織の中には正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞 (cancer stem cells)と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成していることが明らかになっています。
すなわち、無限に自己複製を行うがん幹細胞ががん組織中に少数存在し、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっているのです。多くの場合、このがん幹細胞の起源は通常の組織幹細胞と考えられています。すなわち、組織幹細胞に遺伝子変異が蓄積して、がん幹細胞になるというわけです。

図:がん組織の中には正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞 (cancer stem cells)と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成している。
すなわち、無限に自己複製を行うがん幹細胞ががん組織中に少数存在し、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている。
多くの場合、このがん幹細胞の起源は通常の組織幹細胞と考えられている。すなわち、組織幹細胞に遺伝子変異が蓄積してがん幹細胞になり、がん幹細胞は自己複製すると同時に不均等分裂によって成熟がん細胞を増やすことによってがん組織が成長する。
【再発や転移はがん幹細胞が原因】
従来は、がん組織に存在する全てのがん細胞が無限の自己複製能(分裂能)を有し、がん組織を形成する能力を獲得していると考えられてきました。しかし最近の考え方は、無限の分裂能を有しがん組織を形成できるのはがん幹細胞だけであり、大部分のがん細胞は、限定された分裂能を有するか、あるいはすでに分裂能を失っていると考えられています。
病理検査でがん組織を顕微鏡でみると、がん細胞が細胞死(アポトーシス)を起こしているのを多数見つけることができます。がん細胞の増殖速度や悪性度によってその程度は異なるのですが、がん組織には細胞分裂の像とアポトーシスの像の両方を多数認めます。
がん細胞が無限の自己複製能を持つと考えられていた頃は、がん組織の中のアポトーシスは、がん組織の中で栄養や酸素の供給が不足しているので死滅しているためと考えられていました。もちろん、栄養や酸素の供給が不十分なためにアポトーシスを起こしている細胞も多いかもしれませんが、実際は、多くの成熟したがん細胞は限定された分裂能しか持たない(あるいはすでに分裂能を失っている)ので、時期がくると死滅している場合も多いようです。
また、がん組織を構成しているがん細胞の全てが、周囲組織への浸潤や離れた部位へ転移できるわけではありません。
ある程度進行したがん患者の血液中にはがん細胞が見つかることがあり、これを
Circulating tumor cell(「血中循環がん細胞」や「循環血中腫瘍細胞」と訳されている)といいます。この血中を循環しているがん細胞の多くは、転移を形成することなく自然に死滅していることが知られています。
つまり、この血中循環がん細胞は体内のどこかに存在するがん幹細胞から供給されて血中を循環しているのですが、がん幹細胞でなければ転移巣を形成することは無いのです。(血中循環がん細胞については
第145話を参照)
(血中循環がん細胞を用いて抗がん剤感受性を検査する方法も行われていますが、血中を循環しているがん細胞は成熟がん細胞でがん幹細胞でないので、この方法で抗がん剤感受性を検査しても意味がないということになります。)
また、がん幹細胞は抗がん剤や放射線治療に抵抗性であり、抗がん剤や放射線治療によって腫瘍が縮小しても、死滅しているのは分化したがん細胞だけで、がん幹細胞は生き残ることが多いことが指摘されています。
治療によって大部分のがん細胞を除いても、ごく少数のがん幹細胞が生き残っていれば再発が起こりうることになり、これが、抗がん剤治療後にしばしば再発が起きる理由だと考えられています。
現行の抗がん剤治療のほとんどは、分化したがん細胞を標的として開発されており、がん幹細胞に対してはあまり効果が無い可能性が指摘されています。
抗がん剤治療によって腫瘍が縮小しても、多くは一時的な縮小であって、がん幹細胞が生き残っているかぎり、いずれ再増殖してきます。臨床的な奏功率(腫瘍の縮小率)が生存期間の延長に必ずしも結びつかないのは、通常の抗がん剤治療ではがん幹細胞が治療に抵抗して生き残るからだと言えます。
成熟したがん細胞が限定した分裂能しか有しないのであれば、これらは放置しておいても自然に死滅することになります。しかし、がん幹細胞が生き残っていれば、がん組織は増大し、転移も広がることになります。つまり、がん幹細胞を効率的に死滅できないとがんは治せないということになります(下図)。
図:がん組織は成熟がん細胞と少数のがん幹細胞から構成される。抗がん剤や放射線治療で成熟がん細胞は死にやすいががん幹細胞は死ににくい性質を持つので生き残る。生き残ったがん幹細胞から成熟がん細胞が産生されるので、治療後に再燃や再発が起こる。がん幹細胞を死滅できればがん組織を消滅できる。
がん幹細胞が分化したがん細胞よりも抗がん剤や放射線治療に対する感受性が低い理由は数多くあります。
例えば、がん幹細胞は抗がん剤の排出能力や解毒能力が高いことが指摘されています。つまり、細胞内の薬剤を排出するABC(ATP-binding cassette) transporterが高発現しているために抗がん剤が効きにくいことや、活性酸素などのフリーラジカルを消去する活性(グルタチオンやNrf2活性など)が高いために抗がん剤や放射線治療が効きにくいことが報告されています。
さらに、がん幹細胞はダメージを受けたDNAを修復する能力が高くなっているので、抗がん剤や放射線で遺伝子がダメージを受けても簡単には死ににくい性質を持っています。
また、がん幹細胞は、正常組織幹細胞と同様に特別な微小環境(ニッチ)内で休眠状態として存在しているため、増殖する細胞を標的とする従来のがん治療は効果が弱いと考えられます。従来の抗がん剤の主流を占める殺細胞薬(cytotoxic agent)は、細胞分裂している細胞を選択的に死滅させるため、休止期のがん幹細胞を死滅させることができないためです。
【がん幹細胞とmTORとヘッジホッグ経路】
がん幹細胞はがん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境中に存在し、周りの細胞から分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
細胞のシグナル伝達は極めて複雑であり、がん細胞におけるシグナル伝達系の異常も極めて多彩で複雑であるため、単純にはまとめることができません。
この事実が、がん治療が極めて困難な根本的な理由になっています。細胞の増殖や分化の異常を制御することが困難だからです。
自転車のように駆動やブレーキの制御の仕組みが単純であれば、故障しても簡単に修理できます。
しかし、人間の細胞や組織の増殖や分化の制御には何百とか何千種類ものタンパク質が複雑に相互に作用しながら関わっているので、がん細胞の異常増殖を抑制するのに、数カ所を阻害したり活性化するような方法では限界があります。
しかし、主要な経路を阻害すればある程度の抗腫瘍効果が期待できるので、がん幹細胞の維持や増殖や生存に関与しているシグナル伝達系をターゲットにした薬ががん治療に使われることになります。
がん幹細胞の自己複製や増殖を制御しているシグナル伝達系としてヘッジホッグ(Hedgehog)、mTOR、Notch、Wnt-β-Cateninなどがあります。
膵臓がんのがん幹細胞ではmTORの活性とヘッジホッグシグナル伝達系の活性が非常に亢進しており、これらの経路を阻害すると抗がん剤治療の効果が高まるという報告があります。
以下のような報告があります。
Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer.(ヒト膵臓がんの腫瘍形成性がん幹細胞を消滅させる標的治療の組合せ)
Gastroenterology. 137(3):1102-13. 2009年
【要旨】
研究の背景と目的:膵臓がんは、腫瘍形成性のがん幹細胞の存在により、抗がん剤治療に対して非常に強い抵抗性を示し、ジェムザール治療中もがん幹細胞は生き延び、数を増やしている。ソニック・ヘッジホッグ(sonic hedgehog)シグナル伝達系と哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin:mTOR)は、いずれもがん幹細胞の自己複製に必須であるため、膵臓がん治療の新たなターゲットとして期待できる。
方法:膵臓がんの培養細胞を使った実験系と動物移植腫瘍を使った実験系を用いて、腫瘍形成性がん幹細胞に対するソニック・ヘッジホッグ阻害剤(cyclopamine/CUR199691)とmTOR阻害剤(ラパマイシン)の効果を検討した。
結果:驚くべきことに、ソニック・ヘッジホッグ阻害剤のシクロパミン(cyclopamine)もラパマイシン(rapamycin)もそれぞれ単独ではがん幹細胞の数を減らすことはできなかった。また、それぞれを単独で抗がん剤治療と併用した場合もがん幹細胞の数を減らすことはできなかった。ソニック・ヘッジホッグ阻害とmTOR阻害と抗がん剤の3つを同時に併用した場合にのみ、がん幹細胞の数が検出できないレベルまで減少することが、培養細胞を使ったin vitroの実験と移植腫瘍を用いた動物実験(in vivo)の両方で認められた。最も重要なことは、これら3種類を組み合わせた治療によって、ヒト由来の膵臓がん細胞を移植されたマウスは生存期間が顕著に延長したことである。
結論:ソニック・ヘッジホッグとmTORの両方のシグナル伝達系の阻害を通常の抗がん剤治療と併用することによって膵臓がんのがん幹細胞を消滅させることが可能になる。この治療法をさらに検討することは、治療が困難で予後が極めて不良な膵臓がんの新たな治療法の開発につながる。
(解説)
ソニック・ヘッジホッグ (Sonic hedgehog) は、ヘッジホッグファミリーに属するタンパク質の一つです。ヘッジホッグ経路は胚発生の過程で細胞増殖や分化や臓器の形成などの制御に重要な役割を果たしています。
ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグが結合することによって開始されます(下図)。

図:ソニック・ヘッジホッグが無いときは、PTCH-1(Patched-1)がSMO(Smoothened)を阻害しているので、このシグナル伝達系は作動しない。ソニック・ヘッジホッグ(SHh)が存在すると(産生されると)、SHhがPTCH-1に結合し、SMOの阻害は解除され、SMOは下流のシグナル伝達系を介して転写因子のGLi1を活性化し、ヘッジホッグ標的遺伝子を活性化する。
Hedgehogというのはハリネズミのことで、ヘッジホッグ遺伝子の機能を失ったショウジョウバエの胚が小さな歯のような突起物が密集しており、ハリネズミに似ていることからこのような名前になっています。
このヘッジホッグシグナル経路は、様々ながんの発生や進展にも関与していることが明らかになっており、特にがん幹細胞の自己複製能の維持に重要な役割を担っています。つまり、ヘッジホッグ・シグナル伝達系に関与するタンパク質の遺伝子の変異や発現亢進が組織幹細胞に起こるとがん幹細胞になってがんが発生するということです。
そのため、ヘッジホッグシグナル経路の阻害剤ががん治療薬として開発されており、すでに認可されているものもあり、多くの薬の臨床試験が行われています。
この実験で使用されているシクロパミン(cyclopamine)は米国に自生するバイケイソウという植物からみつかった天然有機化合物で、ヘッジホッグシグナル伝達系を阻害する作用があり、この誘導体ががん治療薬として開発されています。(バイケイソウを食べた羊から生まれた子羊に単眼症などの奇形が多く発生し、その原因物質としてシクロパミンが同定され、これがヘッジホッグ経路を阻害するために胚発生過程の臓器形成に異常が生じて奇形が起こることが明らかになっている)
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。がん細胞や肉腫細胞の多くにおいてmTORが活性化されており、mTORの阻害はがん細胞や肉腫細胞の増殖を抑制し、抗がん剤や放射線治療の効き目を高める効果や細胞死(アポトーシス)を誘導する効果が示されています。すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。
mTORもがん幹細胞の自己複製や増殖や抗がん剤耐性に関与していることが報告されています。
実験系(膵臓がんの細胞株の違いに基づく)によっては、ラパマイシンによるmTORの阻害だけでも膵臓がん細胞の増殖を抑える効果が認められています。
がん幹細胞は、成熟したがん細胞に比べて抗がん剤や放射線に抵抗性が強いため、治療後の再発の原因となっています。がん幹細胞を死にやすくすることががん治療の効果を高めることができるのですが、がん幹細胞は様々なメカニズムで死ににくくなっており、一つの方法だけでは限界があるようです。
この論文でも、抗がん剤治療+ソニック・ヘッジホッグ阻害も抗がん剤治療+mTOR阻害もがん幹細胞を減らすことができなかったという結果です。しかし、抗がん剤治療+ソニック・ヘッジホッグ阻害+mTOR阻害の3つを組み合わせると、膵臓がんのがん幹細胞を消滅できたという結果です。
膵臓がんに対するジェムザールの効果は極めて低いのですが、mTOR阻害とソニック・ヘッジホッグ阻害の2つを併用すると奏功率を高めることができるかもしれません。
【半枝蓮と白花蛇舌草のソニック・ヘッジホッグ経路阻害作用】
ソニック・ヘッジホッグ経路の阻害剤ががん治療薬として開発されています。ヘッジホッグ阻害薬として、進行性の基底細胞がんに認可されているvismodegib(Erivedge)カプセルがありますが、1ヶ月分が100万円を超えるので、簡単には使えません。
その他、フェースIやIIのレベルで開発中の薬が数多くあるようですが、認可されてもかなり費用がかかるので、日本で保険適用されるまでは簡単には使えないかもしれません。
そこで、文献を検索すると、がんの漢方治療で最も多く使われる抗がん生薬の半枝蓮と白花蛇舌草にヘッジホッグ伝達系を阻害する作用が報告されています。以下のような論文があります。
Scutellaria barbata D. Don Inhibits Tumor Angiogenesis via Suppression of Hedgehog Pathway in a Mouse Model of Colorectal Cancer. (結腸直腸がんのマウスの実験モデルにおいて、半枝蓮はヘッジホッグ伝達系系を阻害することによって腫瘍血管の新生を阻害する)
Int J Mol Sci. 13(8): 9419–9430. 2012年
【要旨】
腫瘍組織の成長に必要な血管新生(angiogenesis)はソニック・ヘッジホッグ・シグナル伝達経路によって厳密に制御されているが、このソニック・ヘッジホッグ経路は多くの種類のがんで異常が起こっていることが知られている。
したがって、ソニック・ヘッジホッグ・シグナル伝達系の調節を介した血管新生の阻害はがんの化学療法のターゲットとして注目されている。
半枝蓮(Scutellaria barbata D. Don)は中国伝統医学において結腸直腸がんを含めて様々ながんの治療に用いられてきた。半枝蓮のエタノール抽出エキスには、培養大腸がん細胞にアポトーシスを誘導する作用や、ニワトリ受精卵胚漿尿膜実験モデル(chick embryo chorioallantoic membrane model)において血管新生を阻害する作用があることを、我々は報告してきた。
半枝蓮の抗腫瘍効果のメカニズムをさらに明らかにする目的で、今回の実験では、大腸がんの移植腫瘍の実験モデルを用いて、生体内での腫瘍の増殖や血管新生に対する半枝蓮エタノール抽出エキスの効果を検討した。
実験の結果、半枝蓮エタノール抽出エキスは、大腸がんを移植したマウスの体重増加に影響することなく、腫瘍組織の体積を減少させることが明らかになった。
さらに、半枝蓮エタノール抽出エキスは腫瘍組織におけるソニック・ヘッジホッグ伝達経路の主要なメディエーターの発現を抑制し(注:がん組織内のSHH, PTCH-1, SMO, Gli-1のmRNAとタンパクレベルを低下させた)、その結果腫瘍血管の新生を阻害した。
さらに、ソニック・ヘッジホッグ伝達経路の重要なターゲット遺伝子であり、血管新生を強力に刺激する血管内皮細胞増殖因子A(vascular endothelial growth factor A)の発現を半枝蓮エタノール抽出エキスは阻害した。
これらの実験結果は、半枝蓮ががん治療において有効性を示すメカニズムの一つに、ソニック・ヘッジホッグ伝達経路の阻害を介した腫瘍血管の新生阻害の関与を示唆している。
Hedyotis diffusa Willd extract suppresses Sonic hedgehog signaling leading to the inhibition of colorectal cancer angiogenesis.(白花蛇舌草エキスはソニック・ヘッジホッグ・シグナル伝達系を抑制し結腸直腸がんの血管新生を阻害する)Int J Oncol. 42(2):651-6. 2013年
【要旨】
ソニック・ヘッジホッグ・シグナル伝達系は血管新生の過程を促進し、結腸直腸がんを含めて多くのヒト悪性腫瘍の進行を促進する作用がある。したがって、このシグナル伝達系は抗がん剤開発の有望なターゲットとして注目されている。
白花蛇舌草(Hedyotis diffusa Willd)は伝統中国医学において頻用される薬草で、中国では多くのがんの治療に古くから使用されている。
最近、我々は、白花蛇舌草エキスがSTAT3シグナル伝達系を抑制することによって、培養細胞やマウスに移植した結腸直腸がんの増殖を阻害することを報告した。
さらに、培養細胞を用いたin vitroにおける実験系で白花蛇舌草の血管新生阻害作用を報告している。
白花蛇舌草の抗腫瘍活性のメカニズムをさらに明らかにする目的で、大腸がんをマウスに移植した動物実験モデルを用いて、腫瘍血管の新生に対する白花蛇舌草エタノール抽出エキスの生体内での作用を評価し、その分子メカニズムを検討した。
実験の結果、白花蛇舌草エタノール抽出エキスは、がん組織内の微小血管の密度(intratumoral microvessel density)を顕著に低下させ、生体内における腫瘍血管の新生を阻害する活性が示された。
白花蛇舌草エタノール抽出エキスは移植したがん組織においてソニック・ヘッジホッグ・シグナル伝達系の主要なメディエーターの発現を著明に減少させ、がん組織におけるソニック・ヘッジホッグ伝達系の活性を抑制することが示された。
白花蛇舌草エタノール抽出エキスはソニック・ヘッジホッグ・シグナル伝達系のターゲット遺伝子である血管内皮細胞増殖因子-A(VEGF-A)とその特異的受容体のVEGFR2の発現を阻害した。
以上の結果から、白花蛇舌草はソニック・ヘッジホッグ・シグナル伝達系を介した血管新生を阻害することによって、生体内で結腸直腸がんの増殖を阻害するというメカニズムが示された。
半枝蓮(はんしれん)は学名をScutellaria barbataと言う中国各地や台湾、韓国などに分布するシソ科の植物です。アルカロイドやフラボノイドなどを含み、抗炎症・抗菌・止血・解熱などの効果があり、中国の民間療法として外傷・化膿性疾患・各種感染症やがんなどの治療に使用されています。
白花蛇舌草(ビャッカジャゼツソウ:Oldenlandia diffusaあるいはHedyotis diffusa Willd)は本州から沖縄、朝鮮半島、中国、熱帯アジアに分布するアカネ科の1年草のフタバムグラの根を含む全草を乾燥したものです。抗菌・抗炎症作用があり、漢方では清熱解毒薬として肺炎や虫垂炎や尿路感染症など炎症性疾患に使用されます。さらに最近では、多くのがんに対する抗腫瘍効果が注目され、多くの研究が報告されています。
この2つはがんの漢方治療で最も頻用される抗がん生薬で、組み合わせて使うと相乗効果があることが経験的に知られています。
この2つの論文は同じ研究グループからの報告です。福建中医学院(Fujian University of Traditional Chinese Medicine)のAcademy of Integrative Medicine Biomedical Research Centerのグループです。
検討した生薬が違うだけで、実験系や論文の内容や考察も似ており、結論の出し方に強引さも感じるので、半枝蓮と白花蛇舌草の2つの薬草の抗がん作用のメカニズムとしてソニック・ヘッジホッグ経路の阻害が本当に重要なのかは疑問もあるのですが、マウスにエキスを経口で与えて抗腫瘍効果が得られており、その服用量は人間に換算しても人間で使用されている服用量の範囲なので、実際にこれらの生薬が臨床例でソニック・ヘッジホッグ経路を阻害する可能性はあるかもしれません。
半枝蓮や白花蛇舌草にはフラボノイドやアルカロイドやトリテルペノイド類などの抗がん成分が多く含まれています。
トリテルペノイドのベツリン酸(Betulinic acide)がヘッジホッグ伝達系を阻害するという論文があります。
Betulinic acid induces apoptosis and inhibits hedgehog signalling in rhabdomyosarcoma.(ベツリン酸は横紋筋肉腫のアポトーシスを誘導しヘッジホッグシグナル伝達系を阻害する)Br J Cancer. 103(1):43-51. 2010年
この論文では、ベツリン酸が横紋筋肉腫にアポトーシスを誘導する作用を確認し、その作用機序としてヘッジホッグ経路の阻害作用を報告しています。
ベツリン酸が肝臓がんの一種のヘパトブラストーマにアポトーシスを誘導し、その作用機序もヘッジホッグ経路の阻害の可能性を報告する論文もあります。
Betulinic acid treatment promotes apoptosis in hepatoblastoma cells.(ベツリン酸はヘパトブラストーマ細胞のアポトーシスを促進する)Int J Oncol. 35(4):873-9. 2009年
この論文では、ベツリン酸投与によってヘッジホッグ経路のターゲット遺伝子であるGLI1、 PTCH1 、IGF2 の発現を顕著に低下させるという実験結果を報告しています。
ベツリン酸の抗腫瘍効果については
125話で解説しています。
ベツリン酸以外のトリテルペノイドの抗がん作用に関しては
219話で解説しています。
抗がん剤治療に抗がん生薬を多く使った漢方薬を併用すると確かに抗腫瘍効果が高まります。そのメカニズムとして、トリテルペノイドなどによるヘッジホッグ経路やmTORの阻害作用が関与しているかもしれません。
抗がん剤治療と漢方治療を併用すると副作用の軽減だけでなく、奏功率や生存率を高める効果が多数報告されていますが(例えば
345話参照)、抗がん剤治療の奏功率を高める理由としてトリテルペノイドなどによるヘッジホッグ経路やmTOR経路の阻害作用は重要かもしれません。
以上のことから、難治性がんの代表である膵臓がんを含め、多くのがんでがん幹細胞の抗がん剤感受性を高める方法としてmTORC1を阻害するラパマイシン(あるいはラパマイシン誘導体)と半枝蓮と白花蛇舌草、ベツリン酸を多く含む薬草(チャーガなど)を多く使った漢方薬の組合せは、効果が期待できるかもしれません。
がん幹細胞やmTORやヘッジホッグ経路などの話は難しいのですが、がんを克服するためには、がん細胞がなぜ抗がん剤で根治できないのかの理由を知ってそれに対処することが必要です。ただ闇雲に抗がん剤を投与しても、効果は限定的です。抗がん剤治療の効果(奏功率や生存率)を高めるためには、がん細胞の弱点や企みを十分に理解することが重要です。


画像をクリックするとサイトに移行します。