がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
386)認知症を改善するケトン食

図:ケトン体のβヒドロキシ酪酸はアセト酢酸に変換されてグルコースの代替エネルギー源となる。ケトン体は神経細胞のミトコンドリアを増やし、ミトコンドリア機能を正常化してミトコンドリアにおける活性酸素の産生を減らし、酸化ストレスを軽減する。ケトン体はアポトーシスの過程を阻害することによって神経細胞死を抑制し、神経細胞を保護する。βヒドロキシ酪酸はクラス1ヒストン脱アセチル化酵素阻害作用があり神経細胞の核のヒストンアセチル化を亢進して、学習機能や認知機能を高める。非ヒストンタンパクのアセチル化も神経機能の働きを高め、細胞死を抑制する方向で働く。このような様々な機序が総合的に作用して、ケトン体の産生を高めるケトン食はアルツハイマー病やハンチントン病などの神経変性性疾患に対して治療効果を発揮し、さらに学習機能や認知機能を高める効果がある。
386)認知症を改善するケトン食
【認知症は様々な原因で発症する】
老化に伴って物覚えが悪くなるということは多くの高齢者が経験しています。これは脳の神経細胞が加齢とともに減少し、脳の萎縮が少しづつ進行するからです。老眼や難聴(聴力低下)と同じような老化に伴う生理的な機能低下です。
病的な原因によって記憶力や知能の低下する病気を「認知症」と言います。いったん正常に発達した知能が、脳の後天的な障害によって脳の働きが低下し、記憶や知能に障害をきたす病気です。この認知症を引き起こす原因として最も多いのがアルツハイマー病(アルツハイマー型認知症)です。その他、脳梗塞などの脳血管障害、パーキンソン病、ハンチントン病など様々な原因によって認知症は発症します。
認知症は進行すると仕事や日常生活に支障をきたすだけでなく、人格が崩壊し、人間としての尊厳が失われる点で非常に悲惨な病気です。認知症と診断されることは、本人だけでなく家族にとっても大きな精神的かつ経済的な負担になります。人口の高齢化とともに認知症の患者は年々増え続けており、社会的な問題にもなっています。日本の最近の調査では、65歳以上の15%、約460万人が認知症と推計されています。
生理的な物忘れも、アルツハイマー病などの病的な認知症も一般的には加齢とともに増加します。米国のデータでは、アルツハイマー病の年間発症率は人口1000人当たり、0.58 (60–64 歳)、 1.86 (65–69 歳)、5.06 (70–74 歳)、11.74 (75–79歳)、 23.1 (80–84 歳)、38.58 (85–89 歳)、 54.88 (90–94 歳)、 66.85 (95歳以上)となっています。(Neurodegener Dis Manag. 2(2): 183–195.2012年)
このような病気でも治療法が確立しておれば何の心配も無いのですが、アルツハイマー病やハンチントン病など認知症を引き起こす原因の多くで、まだ有効な治療法は確立していません。いくつかの薬は使用されていますが、症状の緩和や進行を遅らせる程度で、その効果には限界があります。開発中の薬は多くありますが、特効薬ができるのはかなり先のようです。
認知症が比較的若年で発症する場合もあります。アルツハイマー型認知症は遺伝的素因の関与も知られています。すなわち、親族にアルツハイマー型認知症の患者がいる場合、発症リスクが上昇することが指摘されています。
【認知症は食事や生活習慣で予防や治療できる】
身内に認知症がいる場合は認知症を予防することを実践することが大切です。例えば、魚の油に含まれるドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)、野菜や果物などビタミン・ミネラルやポリフェノールの多い食品の摂取は認知症の発症率を低下させることが知られています。逆に白米など糖質の多い食事は認知症のリスクを高めます。
肥満や糖尿病やメタボリック症候群は動脈硬化を促進して脳血管障害の発症リスクを高めます。糖尿病やメタボリック症候群がアルツハイマー型認知症の発症率を高めることも報告されています。肥満や糖尿病やメタボリック症候群はカロリー制限や糖質制限など適切な食事で改善できます。ケトン食はこれらの疾患を短期間に改善することが多くの臨床試験で確認されています。
福岡県久山町の住民を対象に行われている疫学調査の「久山町研究」でも、糖尿病が脳血管性とアルツハイマー型の両方の認知症の危険因子であることが示され、最近の認知症の急増は糖尿病患者が増えていることが要因になっていると指摘されています。
久山町の追跡調査では、牛乳・乳製品や大豆製品・豆腐、野菜などを多く食べ、ご飯や酒類が少ない食事パターンが脳血管性とアルツハイマー型の両方の認知症の発症リスクを半分程度に低下させることが明らかになっています。また、運動も認知症の発症リスクを低下させます。
【ケトン食はアルツハイマー病の治療に有効】
ケトン体は脳神経のエネルギー代謝を改善し、活性酸素や炎症から神経細胞を保護する作用があるので、アルツハイマー病やパーキンソン病や脳卒中等を原因とする脳神経細胞障害の進行抑制にケトン食が利用されています。ケトン食が認知障害の改善に有効であることが臨床試験で示されています。
例えば、軽度の認知障害のある23人(男性10人、女性13人:平均年齢70.1±6.2)を対象に、高糖質食と低糖質食の2群に分けて6週間の食事療法を行った研究があります。(Neurobiol Aging 33(2):425.e19 – 425.e27, 2012年)
実験の結果、低糖質食のグループでは、言語記憶能力の統計的有意な改善を認め、さらに、体重、腹囲、空腹時血糖、空腹時インスリン値の統計的有意な減少が認められました。
記憶力の変化は、摂取カロリーやインスリン値や体重とは相関を認めませんでしたが、血中ケトン値は記憶力の改善と正の相関が認められました。つまり、ケトン体の濃度が高いほど記憶力が良くなったということで、食事性のケトーシス(ケトン血症)が認知障害を改善するという結果です。
この研究の結果は、アルツハイマー病の発症リスクの高い軽度認知障害をもつ高齢者に対して、6週間という短期間の食事(低糖質食)の介入だけで記憶力の改善ができることを示しています。認知障害の改善の作用機序として、ケトン体による抗炎症作用や神経細胞のエネルギー代謝の改善作用などが示唆されています。神経細胞の主なエネルギー源はブドウ糖ですが、アルツハイマー病などの認知症では神経細胞のブドウ糖の取込みや代謝に異常が起こっているためにエネルギー産生の低下が認められます。ケトン体はブドウ糖に代わってエネルギー源となるため、神経細胞の働きを良くすると考えられています。認知機能の改善のメカニズムに関しては、最近の研究ではケトン体によるヒストンアセチル化の亢進による遺伝子発現の関与が注目されています(後述)。
高齢ラットを使った実験でもケトン体が認知機能を高めることが報告されています。(Adv Exp Med Biol 662: 71-75, 2010年)
この報告では、高齢ラットを2群に分けて、標準的な餌とケトン食の餌で3週間飼育し、ラットの認知機能をT-迷路法や物体認識テストなどで認知機能を測定しています。ケトン食で飼育した群の方が認知機能が良かったという結果が得られています。この実験結果は食事によるケトン血症(血中のケトン体の濃度が高い状態)が神経変性疾患の改善に効果があることを示しています。
米国では中鎖脂肪酸トリグリセリド(中鎖脂肪酸中性脂肪)のカプリル酸トリグリセリドがアルツハイマー病の治療に有効な医療食として認可されています。カプリル酸(caprylic acid)は炭素数8個の中鎖脂肪酸(分子式はC8H16O2)です。
神経細胞はグルコースとケトン体しかエネルギー源として利用できないのですが、アルツハイマー病ではグルコースの取り込みや利用に障害があり、そのため中鎖脂肪酸を摂取してケトン体の産生を増やすと神経組織のエネルギー産生が改善して症状が良くなると考えられています。エネルギー産生の改善だけでなく、ケトン体には神経細胞死の抑制や抗炎症作用や抗酸化作用なども報告されています(後述)。
以上のように、ケトン体は神経細胞のエネルギー源となり、ケトン体自体に抗炎症作用などの作用によって神経をダメージから守る作用があり、その結果、神経変性性疾患の治療に効果を発揮するということです。脳卒中(脳出血や脳梗塞)、パーキンソン病、筋萎縮性側索硬化症などにも効果があることが報告されています。
【ケトン食は難治性てんかんや自閉症にも有効】
ケトン食はてんかんの治療法として開発されました。てんかん発作が絶食によって減少することは古くから知られており、「脂肪を多く炭水化物の少ない食事をと摂れば、絶食と同等の効果が得られる」という考えのもとに、1920年代にメイヨークリニックのRussel Wilder博士がケトン食療法(ketogenic diet)を発案しました。このケトン食が難治性てんかんに有効であることは数多くの臨床試験で証明され、その有効性と安全性は確立されています。
その他、自閉症にも効果があることを示唆する臨床試験の結果も報告されています。自閉症は、先天性の脳機能障害などによって、社会性や他者とのコミュニケーション能力に困難が生じる病気です。
30人の自閉症の子供(4歳~10歳)を4週間のケトン食+2週間普通食の6週間のサイクルで6ヶ月間治療を行っています。自閉症の症状の程度は小児自閉症評定尺度という方法で評価しています。6ヶ月間の30人中18人(60%)で自閉症の症状が改善したと報告されています。小児自閉症評定尺度で12ユニット以上の著明な改善を2例、8~12ユニットの平均的改善が8例、2~8ユニットの軽度の改善が8例に見られたと報告されています。この臨床試験は予備的な段階ですが、自閉症の治療にケトン食が効果がある可能性が示唆されています。(J Child Neurol 18(2)/113-8, 2003年)
以上のように、ケトン食は高齢者や子供にも安全に行われる食事療法です。中鎖脂肪酸トリグルセリド(中鎖脂肪酸中性脂肪 )を使うとケトン体の産生量を増やすことができます。この中鎖脂肪酸は未熟児や手術後の栄養補給にも利用されており、アルツハイマー病に治療にも利用されています。つまり、中鎖脂肪酸トリグリセリドを多く摂取するケトン食(中鎖脂肪ケトン食)は安全で簡単に実施できるケトン食と言えます。
最近物忘れがひどくなったと思っている方や、家族歴などでアルツハイマー病などの認知症のリスクの高い人や、既に認知症にかかっている人は、ケトン食を実践する価値はあると言えます。
【ケトン体の神経変性疾患改善作用】
前述のように、ケトン体を増やすケトン食が、アルツハイマー病や脳血管障害やパーキンソン病やハンチントン病など神経変性疾患の改善に有効であることが明らかになっています。
ケトン食は、糖質を極端に制限した状態で脂肪酸の燃焼を促進させることによってケトン体を産生する食事で、糖尿病やメタボリック症候群を顕著に改善する効果がありますが、ケトン体自体に神経細胞の働きを高めることが報告されています。
ケトン体はグルコースが枯渇したときに肝臓で脂肪酸が燃焼して産生されます。ケトン体は血液脳関門を通過し、拡散あるいはモノカルボン酸トランスポーターによって神経細胞内に入り、神経細胞のエネルギー源となります。
グルコースの代替エネルギー源となる以外に、以下のような様々なメカニズムで神経細胞を傷害から守る作用があります。
①ケトン体は神経細胞のミトコンドリアを増やし、ケトン体自体がエネルギー源となって神経細胞におけるエネルギー産生を増やす。
②ケトン体は抗炎症作用があり、さらにミトコンドリアにおける活性酸素の産生を減らし酸化障害を軽減する。
③ケトン体はアポトーシスの過程を阻害することによって神経細胞死を抑制する。
④ケトン体はヒストンアセチル化を亢進して認知機能を高める。
以上のように様々な機序が報告されており、恐らく、これら全ての機序が総合的に作用して効果を発揮していると考えられます。
ケトン体のミトコンドリアに対する作用とヒストンアセチル化亢進の作用についてさらに解説します。
【ケトン体はミトコンドリアを保護する】
神経細胞傷害からの細胞保護や認知機能の増強にミトコンドリアでの呼吸(酸化的リン酸化)の改善が重要であることが知られています。つまり、神経細胞のエネルギー代謝において、ミトコンドリアの機能を良くすることはアルツハイマー病などの認知症やその他の神経変性疾患の治療に有効であることが指摘されています。そしてケトン体にはそのような作用があることが報告されています。以下のような報告があります。
3-Hydroxybutyrate methyl ester as a potential drug against Alzheimer's disease via mitochondria protection mechanism.(ミトコンドリアを保護するメカニズムによってアルツハイマー病の治療薬となる可能性がある3−ヒドロキシ酪酸メチルエステル)Biomaterials. 34(30): 7552-7562, 2013年
アルツハイマー病の発症機序としては、神経細胞のグルコース利用の低下やミトコンドリアの機能障害など様々なメカニズムが想定されています。ケトン体のβヒドロキシ酪酸(3−ヒドロキシ酪酸とも呼ばれる)やアセト酢酸はグルコースの代わりに神経細胞のエネルギー源となるので、アルツハイマー病の治療効果があることが報告されています。(βヒドロキシ酪酸はアセト酢酸に変換され、アセト酢酸からアセチルCoAができてエネルギー産生に使われる)
この研究では、3−ヒドロキシ酪酸(=βヒドロキシ酪酸)の誘導体である3−ヒドロキシ酪酸メチルエステルを使って、アルツハイマー病に対する効果を検討しています。3−ヒドロキシ酪酸メチルエステルは体内で3−ヒドロキシ酪酸に変化するので、3−ヒドロキシ酪酸を投与したのと同じことになります。
グルコースを枯渇して誘導される神経細胞のアポトーシスを3−ヒドロキシ酪酸メチルエステルは阻害し、アルツハイマー病の神経細胞で起こっているミトコンドリアの異常を改善して活性酸素の発生量を減らすことが実験で示されています。
動物を使った実験では、3−ヒドロキシ酪酸メチルエステルは3−ヒドロキシ酪酸より容易に血液脳関門を通過し、3−ヒドロキシ酪酸より生体利用率が高いことが確認されています。
アルツハイマー病のマウスを使った実験では、モリス水迷路(Morris water maze)の実験で 3−ヒドロキシ酪酸メチルエステルを投与したマウスはコントロール群(3−ヒドロキシ酪酸メチルエステルを投与しなかったアルツハイマー病マウス)よりも顕著に学習能力が良くなる結果が得られています。また、アルツハイマー病マウスの脳に沈着したアミロイド-βの量が減少していることが確認されています。
以上の結果から、3−ヒドロキシ酪酸メチルエステルがアルツハイマー病の治療薬としての候補となると考察しています。また、そのメカニズムとして神経細胞のミトコンドリアのダメージを保護する様々なメカニズムが関与すると考察しています。
この論文の結果は、ケトン食でβヒドロキシ酪酸(3ヒドロキシ酪酸と同じ)の血中濃度を高めることがアルツハイマー病の治療に有効であることも意味しています。
3−ヒドロキシ酪酸メチルエステルは工業原料として入手はでき、既に人間での臨床研究も行われているようですが、これを1日何十グラムも服用するより、MCTオイルやオリーブオイルやω3系不飽和脂肪酸を多く摂取するケトン食の方が現実的ではあると思います。工業原料として販売されている3−ヒドロキシ酪酸メチルエステルを血中ケトン体濃度を上げる目的で1日数十グラム摂取すると1ヶ月で数十万円になる試算です。したがって、1ヶ月数千円ですむMCTオイルの方が現時点では現実的です。
【ケトン体はヒストンアセチル化を亢進する】
ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害することによってヒストンアセチル化を亢進することは322話で解説しています。
飢餓や直接βヒドロキシ酪酸を投与する方法でマウスの血中のβヒドロキシ酪酸の濃度(0.6~1.5mM)を上昇させると、腎臓など複数の臓器においてヒストンのアセチル化が増えていることが確認されています。(Science 339(6116): 211-4, 2013年)
長期間の絶食では血中のケトン体のレベルが6~8mM程度まで上昇することが報告されています。(385話参照)
中鎖脂肪酸を多く使ったケトン食ではβヒドロキシ酪酸を1~2mM程度に維持することは比較的簡単です。つまり、ケトン食で達成できるレベルのケトン体が内因性のヒストン脱アセチル化酵素阻害剤として作用することが証明されています。
ヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によるヒストンのアセチル化については322話で解説しています。
高等生物のDNAは、ヒストンと呼ぶ球状のタンパク質複合体に1.65回転巻きつき、この複合体を基本単位として存在しています。ヒストンにはアセチル(CH3CO)基が結合し、ヒストンアセチル化と呼ぶ化学修飾が起こります。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素」と「ヒストン脱アセチル化酵素」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています(下図)。

ヒストン脱アセチル化酵素の阻害は、p21cip1のような細胞周期の進展を阻害する遺伝子の発現を高めることによってがん細胞の増殖を抑える作用が報告されており、ヒストン脱アセチル化酵素阻害剤はがんの治療薬として注目されています。
これらの非ヒストンタンパク質のアセチル化は、タンパク質の安定性や局在や他のタンパク質やDNAとの相互作用などに影響して、がん細胞の発生や増殖や転移などに関与しています。
通常、ヒストンや非ヒストンタンパク質のアセチル化はがん細胞の増殖を抑制する方向で働くため、このような作用をもった物質はがんの治療に役立つと考えられています。
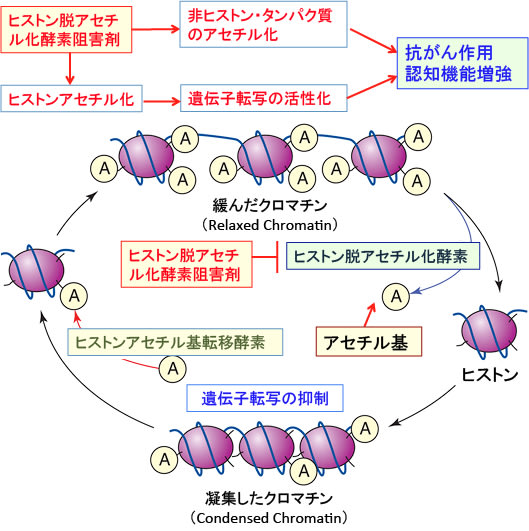
ヒストン脱アセチル化酵素(HDAC)ファミリーの分子は現在HDAC1~11まで同定されていますが、記憶や学習に関連しているのはHDAC2であることが報告されています。
ただし、HDAC1やNAD+依存性脱アセチル化酵素のSIRT1は神経細胞保護的に作用するので、単純にヒストンのアセチル化(つまり、ヒストン脱アセチル化酵素の阻害)が全てに良いわけではないので、問題は複雑です。 ただし、アルツハイマー病などの認知障害や長期維持記憶の回復にHDAC2の阻害剤は効果が期待されています。
Tsai博士らの研究結果によるとヒストン脱アセチル化酵素2(HDAC2)の阻害は認知機能の増強につながるが、HDAC1の阻害はHDAC1の神経細胞保護作用を阻害してしまう可能性があります。
しかし、ケトン食ではヒストンアセチル化というエピジェネティックな作用機序の他に、抗炎症、抗酸化、抗アポトーシスなどの機序による神経細胞保護作用が報告されています。したがって、ケトン体によるヒストン脱アセチル化酵素2(HDAC2)の阻害作用は、アルツハイマー病の治療に対する有効性(認知機能の回復と増強)を強く期待させると思います。 アルツハイマー病でなくても、高齢になってくると記憶力が低下します。老化に伴う短期記憶力の低下に対しても、ヒストンアセチル化酵素の阻害剤によって改善することがマウスを使った実験で示されています。
例えば、100歳以上の人の15~25%は認知機能は正常で、100歳で何らかの認知障害がある人でも、その発症年齢の平均が92歳で、認知症の発症が明らかに遅くなっているという報告があります。つまり、100歳を超えるような人は、認知症に対する抵抗力が高い可能性が示唆されています。 (参考:Centenarians who avoid dementia.(認知症のない百寿者)Trends Neurosci 27(10): 633-6, 2004年)
糖尿病やメタボリック症候群の改善効果がある地中海食はがんとアルツハイマー病の両方を予防する効果が報告されています。地中海食は新鮮な野菜や果物や魚介類が豊富で、オリーブオイルを多く使う料理でがんやアルツハイマー病だけでなく心臓病の発生率を減らす効果も報告されています。
特に血中のケトン体を高めるケトン食ががんと認知症や神経変性疾患の治療に有効であることは上記のように多くのエビデンスによって支持されています。
| « 385)ケトン体... | 387)D-グルコ... » |





