米国腫瘍放射線治療グループによる臨床試験によると、放射線の分割照射を行う前に、経管栄養などによって栄養状態を良くするような治療を行うと、高度(グレード3、4)の口内炎などの副作用の発生率は減少するが、局所再発率や死亡率はかえって高くなるというデータが報告されています。(Head Neck. 228(4):287-96.2006年)
その理由は不明ですが、経管栄養に使われる栄養サポートは高糖質であることを指摘する意見があります。つまり、高糖質の食事はがん細胞の増殖や転移や治療抵抗性を高めるからです。
「経腸および非経口栄養のための欧州学会」の2006年のガイドラインでは、がん患者の代謝異常を是正するために食事中の脂肪/炭水化物の比を増やすことを推奨しています。
「高糖質の食事は治療抵抗性を高める」という事実はあまり重視されていません。
しかし、がん細胞のエネルギー産生や物質合成はグルコースへの依存度が高いので、グルコースの利用を低下させれば、抗がん剤や放射線治療の効果を高めることができることは容易に理解できます(下図)。
(上図)がん細胞はグルコースの取込みと代謝が亢進して、ATP産生と細胞を構成する物質(細胞膜や核酸など)の合成が亢進している。抗がん剤や放射線照射によって細胞がダメージを受けても、ATP産生と物質合成が十分であれば、ダメージを修復して増殖活性を維持できる。
(下図)グルコースの取込みや代謝が阻害されると、ダメージの修復に必要なATPも物質合成も行えなくなる。そうなると抗がん剤や放射線で受けたダメージを修復できないので、細胞死をきたすことになる。
頭頚部がんの治療における糖質制限やケトン食の有効性に関する総説があります。
著者はドイツのシュヴァインフルト (Schweinfurt) のLeopoldina病院の放射線科のDr.Klementです。Dr. Klementはがん治療における糖質制限やケトン食に関する総説を数多く発表しています。
興味深い論文なので、この論文の要旨と本文中の重要な部分を日本語に訳して紹介します。(全文の日本語訳は
こちらへ)
Restricting carbohydrates to fight head and neck cancer—is this realistic?(頭頚部がんの治療における糖質制限は現実的か?)Cancer Biol Med. Sep 2014; 11(3): 145–161.
Rainer J. Klement
【要旨】
多くの頭頸部がんは、グルコースの取込みと解糖系での代謝が亢進し、増殖が早い。その結果、抗がん剤や放射線による治療に抵抗し、予後は悪い。
頭頸部がん患者は食事摂取が困難になりやすく、適切な栄養サポートによって体重減少を防ぐことも重要である。食事の糖質を制限し脂肪の摂取を増やすケトン食は、がん細胞の代謝を是正して増殖を抑制でき、さらに腫瘍関連の体重減少を防げることが報告されている。
この総説では、頭頚部がん患者の支持療法として糖質制限と食事によるケトン症が有効であることを示す3つの具体的根拠を提示する。すなわち、このような食事は、(1)がん細胞で亢進している解糖系をターゲットにしており、(2)抗がん剤や放射線による傷害から正常細胞を守り、抗がん剤や放射線に対するがん細胞の感受性を高め、(3)体重と筋肉量の維持をサポートする。
がん治療における糖質制限のこれらの利点はほとんどのがんに当てはまるが、特に頭頚部がん患者に焦点を絞って考察する。糖質制限は頭頚部がん患者が実践可能であり、最近の研究結果は、糖質制限ががん患者の栄養不良を改善するだけでなく、頭頚部がんそのものに対しても有効であることを示している。
イントロダクション:
頭頚部がんというのは、口唇・口腔・鼻腔・副鼻腔・咽頭・喉頭・気管から発生するがんの集合的名称で、その約90%は、これらの組織を覆う扁平上皮から発生する頭頚部扁平上皮がんです。
腫瘍が発生する部位から予想できるように、頭頚部がん患者はしばしば食事摂取が困難になり、栄養状態が悪くなります。頭頚部がんが発生する主な原因としてタバコやアルコールの摂取が多いというライフスタイルも基礎にあるので、これらの因子が患者の栄養状態を悪くしている場合もあります。
頭頚部がん患者の60%近くが診断時にすでに栄養不良のあるため、頭頚部がん患者の治療においては栄養学的なサポートが重要になっています。
栄養状態が問題ないように思える患者でも、高カロリーで高タンパク質の食事を指導するのが一般的です。
多くの臨床医は、このような栄養学的サポートの達成において、摂取カロリー以外に、食事の栄養素の組成が重要であることに気づいていません。
高脂肪の栄養補助食品(高カロリー、高脂肪、高タンパク、低糖質で、EPAや中鎖脂肪酸を加えている栄養補助食品で経口やチューブ栄養に使用されている)が頭頚部がん患者の栄養学的指標と症状を改善することが報告されていますが、このような栄養補助を受けている頭頚部がん患者は極めて少数です。
他の増殖の早い腫瘍と同様に、多くの頭頚部がんは解糖系でのグルコース代謝が亢進し、頭頚部がんのがん細胞はグルコースに依存度が高いという特徴があります。
このような解糖系が亢進したがん細胞に対して、食事の糖質を減らすということは理にかなっています。
実際に、高脂肪-低糖質のケトン食によって血中のケトン体をmMのレベルに高めると、がん細胞の増殖を抑制できるだけでなく、がん性悪液質や治療に伴う副作用を軽減できることが示されています。
【頭頚部がんは甘いものが好き】
頭頚部がんの特徴は、他の多くのがんと同様に、グルコースの取込みが亢進していることです。
ベルリンの当時のカイザー・ ヴィルヘルム生物学研究所(現在のマックスプランク研究所)にいたオットー・ワールブルグ(Otto Warburg)とその共同研究者たちが初めて、動物や人間の多くの腫瘍のグルコースの取込みとエネルギー産生量を測定しました。
生体内(in vivo)および試験管内(in vitro)での測定において、正常細胞に比べてがん細胞ではグルコースの取込み量が数倍に増えており、そのグルコースからの乳酸の産生量が増加していることをワールブルグ博士は明らかにしました。
正常細胞でも酸素が無い条件では乳酸の産生が増えます(嫌気性解糖系)が、酸素が十分に存在すれば乳酸への変換は抑制されます。しかし、がん細胞では酸素が十分に利用できる条件でも乳酸の産生が増えていることをワールブルグ博士は明らかにしたのです。
このように酸素が十分にある状況でもがん細胞がグルコースの取込みを増やし乳酸の産生を増やす現象をワールブルグ効果(Warburg effect)あるいは好気性解糖(aerobic glycolysis)と呼んでいます。酸素が十分に存在しても酸素を利用しない解糖系でのエネルギー産生が増えているからです。
がんの画像検査法として利用されているPET検査の原理はワールブルグ効果を利用しています。
すなわち、アイソトープ(フッ素の同位体)で標識したグルコース誘導体のフルオロ-2-デオキシ-D-グルコース(FDG)を注射で投与するとがん組織にFDGが集積します。
FDGはグルコースの2位の水酸基(OH基)を陽電子放出同位体のフッ素18(18F)で置換した物質です。このFDGはグルコースと同様にグルコーストランスポーターを通ってがん細胞に多く取込まれます。取込まれたFDGはヘキソキナーゼで6位がリン酸化されると細胞外に出ることはできません。
グルコース-6-リン酸はそれ以降の解糖系酵素で代謝されますが、解糖系酵素はFDG-6リン酸を代謝できないため、細胞内に蓄積することになります。
治療前の腫瘍組織のFDGの集積量が多いほど、がん細胞の解糖系亢進の程度が高いことを意味しており、がん細胞の悪性度が高く、再発率が高いことを示唆しています。また、リンパ節転移の部位の集積が強いほど、遠隔転移の存在の可能性が高くなることが報告されています。
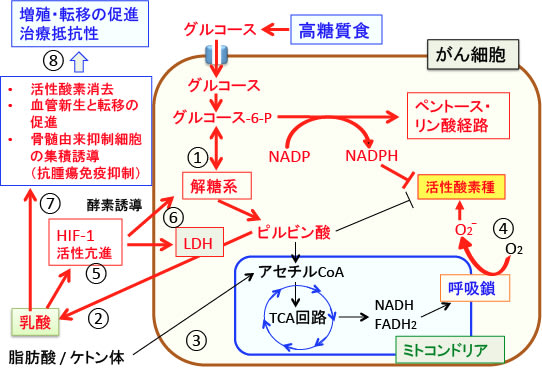
がん細胞における解糖系の亢進は、グルコースの取込みやヘキソキナーゼの活性の亢進だけでなく、ピルビン酸から乳酸への変換(乳酸発酵)の増加も伴います。
頭頚部がんの多くにおいて乳酸脱水素酵素の過剰発現が認められており、この酵素の発現量が多いほどがん細胞の増殖能や悪性度が高く、予後不良の指標になっています。
乳酸の産生量ががん細胞の悪性度に相関する理由として幾つか挙げることができます。
まず第一に、乳酸は抗酸化物質として作用し、がん細胞を内因性の活性酸素や、抗がん剤や放射線によって産生される活性酸素から守る作用があります。実際に、治療前の頭頚部がん組織における乳酸の産生量が多いほど、放射線治療の効果が弱く、治療後の転移や再発が多いことが報告されています。
また、頭頚部がん患者でミトコンドリアでの酸素呼吸より解糖系での代謝が亢進しているほど、放射線治療に抵抗性を示すという報告もあります。
第2に、乳酸とピルビン酸は低酸素誘導因子-1α(HIF-1α)の活性を安定化させる作用があります。HIF-1αは低酸素や増殖シグナルで活性化される転写因子で、多くの解糖系酵素の遺伝子発現を促進し、さらにがん細胞における解糖系亢進状態が維持されることになります。
第3の理由として、乳酸は血管新生と転移を促進する作用があります。
第4に、乳酸は骨髄由来抑制細胞のがん組織への集積を促進し、NK細胞の活性を低下させることによって抗腫瘍免疫を抑制する作用があります。
【遺伝子変異およびエピジェネティクスの機序による好気的解糖の促進】
解糖系が亢進しているという特徴はがん細胞に共通しており、予後と高い相関を示しています。
興味深いことに、頭頚部扁平上皮がん細胞において変異が多く見つかっている遺伝子には、好気性解糖を促進する遺伝子が多く含まれています。
この好気性解糖主体の代謝へのシフトは、ヒストンアセチル化に必要なアセチルCoAやサーチュインのクラスIIIヒストン脱アセチル化酵素(HDAC)ファミリーに必要なNAD+のようなエピジェネティクスに作用する酵素に必要な補助因子の利用可能性を変化させることによってエピゲノムに影響します。(注:DNAの塩基配列を変えることなく、遺伝子のはたらきを決めるしくみをエピジェネティクスと呼び、DNAの塩基配列情報以外の情報をエピゲノムという。)
頭頚部扁平上皮がんでは遺伝子発現のエピジェネティックな変化が高頻度に認められています。
P53タンパク質の不活性化は様々なシグナル伝達を介して、好気性解糖を促進し、ペントース・リン酸経路を亢進し、ミトコンドリアでの酸化的リン酸化を抑制します。
さらに、p53の欠損は活性酸素種の産生を増やし、その結果、DNA変異はさらに促進し、低酸素に依存しない低酸素誘導因子-1α(HIF-1α)の安定化によって解糖系での代謝はさらに亢進することになります。
このようにして、HIF-1αは解糖系の亢進して乳酸とピルビン酸の産生を増やし、ペントース・リン酸経路によって産生されるNADPHは還元型グルタチオンの再生を促進し、これらはがん細胞の恒常的な酸化ストレスからがん細胞を守ることになります。
がん細胞を酸化的ストレスから保護する作用は、抗がん剤治療や放射線治療に対する抵抗性の獲得とも関連しています。
このような作用は糖質摂取を減らすことによって阻止することができます。グルコースの取込みを阻害すると酸化ストレスによる細胞死が起こりやすくなります。
p53はミトコンドリアDNAの修復や安定性にも重要な役割を担っており、p53変異とミトコンドリアDNAの変異の間に相関を示した報告もあります。
ミトコンドリアにおける酸化的リン酸化に関与する遺伝子の20%はミトコンドリアDNAに存在するため、ミトコンドリアDNAの変異はミトコンドリアでの代謝に異常を引き起こす可能性があります。
頭頚部扁平上皮がんの24~47%は、ミトコンドリアDNAの遺伝子の転写や翻訳や複製における異常によってミトコンドリア機能に異常を引き起こすような病原的なミトコンドリアDNAの変異を持っていると推定されています。
ミトコンドリアの機能異常によって引き起こされる活性酸素種産生の恒常的な増加に対して、解糖系を亢進させることによって活性酸素を消去しなければなりません。さもなければ活性酸素はがん細胞を死に追いやることになるのです。
【糖質制限に対する頭頸部がん細胞の脆弱性】
頭頚部がん細胞の代謝が好気性解糖にシフトすると、エネルギー産生量が増えると同時に、細胞毒に対する抵抗性が高まり、細胞分裂するための細胞構成成分の合成を増やすことができ、浸潤や転移も促進されます。
グルコース(とグルタミン)の利用を制限するとがん細胞は簡単に死滅することは、培養がん細胞を使った多数の実験で示されています。
グルタミンもがん細胞のエネルギー源や物質合成の材料として重要ですが、頭頚部扁平上皮がん細胞に関しては、グルコースに比べてグルタミンの重要度は低いといえます。
代謝的に柔軟性のある正常細胞に対して解糖系代謝に依存度が高いがん細胞が優位になるのは、エネルギー源としてグルコースが大量に利用できる場合だけです。
食事からの糖質摂取を減らすことは、がん細胞へのグルコースの供給量を減らし、正常細胞へは脂肪酸とケトン体を増やすことによって、毒性の少ない治療法となります。
特にケトン食は、がん患者に対する食事療法として利用すると、様々な有用な効果を発揮します。
ケトン食はエネルギー源を糖質から脂肪に置き換えることによって、食事からの摂取カロリー量を減らすことなく、絶食と同じ代謝状態を作ることができます。
カロリー制限は様々な有用な効果を発揮しますが、その有用な作用の多くは糖質制限に起因するものです。
【糖質制限は解糖系の活性を抑制する】
食事中の糖質を減らし脂肪を増やすと、血中には脂肪酸の濃度が増え、グルコース濃度は減少します。
脂肪酸(特に飽和脂肪酸)は、主要な解糖系酵素であるヘキソキナーゼ(hexokinase)、ホスフォフルクトキナーゼ(phosphofructokinase)、ピルビン酸キナーゼ(pyruvate kinase)、乳酸脱水素酵素(lactate dehydrogenase)の活性を阻害することが知られています。
がん細胞はグルコースに親和性が高い輸送体(グルコース・トランスポーター)を細胞膜に多く発現しているので、血液中のグルコース(血糖)が低くてもグルコースの取込みは簡単には減少しません。しかし、血管の乏しいがん組織では、糖質摂取を減らすとがん組織へのグルコース濃度は低下します。
がん患者においてケトン食ががん細胞の解糖系を阻害することが、フルオロデオキシグルコース(FDG)を使ったPET検査の研究で確かめられています。
最近の2つのマウスを用いた実験では、ケトン食ががん組織の乳酸産生を減らし、がん組織の増大速度を抑制することが報告されています。
微小透析カテーテルを用いた測定法によって、頭頚部扁平上皮がん患者の腫瘍組織内の乳酸濃度がケトン食を実行することによって低下することが報告されています。
患者らは4日間、肉・魚・卵・サラダ・チーズ・ソーセージのみからなる食事を与えられました。この短期間のケトン食は、血中グルコースレベルを低下させ、腫瘍内乳酸レベルの低下を引き起こしました。乳酸レベルの低下の度合いは正常粘膜に比べてはるかに大きなものでした。
糖質制限に加えてカロリーも制限すれば血中グルコース濃度の低下はもっと促進されますが、体重減少のリスクの高い頭頸部がん患者にそのような食事(糖質制限+カロリー制限)は適しているとは言えません。
【糖質制限は低酸素細胞にとって特に問題である】
細胞が低酸素になると解糖系酵素の活性と細胞内へのグルコースの取込みが増加することは良く知られています。
ワールブルグは腫瘍組織の血管網の発達が不十分であることにすでに気づいていました。そして、このような血管網の未発達によってグルコースと酸素が同時に枯渇することにがん細胞は正常細胞に比べてより脆弱であるという仮説をたてました。
理論的には、血管から離れていて慢性的に低酸素の状態である細胞は、血中のグルコースレベルを下げることによって酸素とグルコースの同時枯渇によって死滅することになります。
糖質制限を厳しく行うと、肝臓はケトン体を多く産生するようになります。このケトン体は脳や筋肉など正常組織のエネルギー源となります。
頭頚部扁平上皮がん患者の腫瘍の測定では、腫瘍組織もケトン体を取り込みますが、その量は少ないものでした。
多くのがん細胞ではケトン体を利用する酵素を欠損しています。たとえ、頭頚部扁平上皮がんがケトン体を利用する酵素活性を持っていても、ケトン体をミトコンドリアで代謝してエネルギー源とするには酸素が必要であるため、がん細胞の多くはケトン体を十分に利用できません。
したがって、血中のグルコースのレベルを低下させることは、正常な血管網による栄養と酸素の供給と柔軟な代謝システムを持つ正常細胞には影響は少ないのですが、低酸素のがん細胞にとっては極めて厳しい生存条件となるのです。
【糖質制限はがん性増殖シグナルを阻害する】
糖質制限はフォスファチジルイノシトール-3キナーゼ/Akt/哺乳類ラパマイシン標的タンパク質(PI3K-Akt-mTOR)シグナル伝達系を抑制します。このシグナル伝達系はインスリンやインスリン様成長因子-1(IGF-1)のような増殖因子によって活性化され、解糖系を亢進する作用があります。
このようなシグナル伝達系は他の増殖因子や受容体などと複雑なネットワークを形成しているので、ある因子に特異的な阻害剤を使ってもがん細胞は抵抗性を示し、かつ正常細胞に対する副作用が問題になります。
それに対して糖質制限は、様々なシグナル伝達系のネットワークを同時にターゲットにし、しかも全く毒性のない治療戦略なのです。
糖質制限は、細胞内のエネルギー量のセンサーであるAMP依存性プロテインキナーゼ(AMPK)の活性を高めます。
AMPKの活性化はある細胞では解糖系を亢進することが知られていますが、長期の作用では、AMPKはmTORシグナル伝達系を阻害することによって、ワールブルグ効果を抑制し、がん細胞の増殖を抑える作用を示します。(注:AMPKはATP量の低下に伴って活性化され、異化を亢進し、同化を抑制するので、解糖系を亢進する方向で作用しますが、mTORを阻害するので、がん細胞の増殖を抑制することになります。)
したがって、AMPKは抗腫瘍効果を示す作用が注目されており、AMPKを活性化する抗糖尿病薬のメトホルミンのがん治療における利用が試みられています。
進行したがんではインスリンの阻害だけでは効果が弱いと言わざるを得ません。その理由はがんが進行すると遺伝子変異やエピジェネティックな遺伝子発現異常が多く蓄積し、PI3K−Akt−mTOR シグナル伝達系は慢性的に活性化しているからです。
しかしながら、ケトン食は、がん細胞の解糖系と増殖を阻止する方向でがん細胞の遺伝子発現を大きく変化させることによって、単なるインスリン阻害だけの効果を超える抗腫瘍効果を発揮することが示されています。
興味深いことに、ケトン体のβヒドロキシ酪酸とアセト酢酸(βヒドロキシ酪酸に比べると活性は弱いが)はクラスIとクラスIIのヒストン脱アセチル化酵素の活性を阻害する作用があります。
このような作用によって、ケトン体はエピジェネティックおよび非エピジェネティックな作用機序によって頭頸部がん細胞のシグナル伝達系に作用することによって、新しいがん治療となりうるのです。
例えば、ヒストン脱アセチル化酵素阻害剤のトリコスタチンAによってクロマチンのアセチル化を誘導すると、頭頚部扁平上皮がん細胞の増殖が阻害され、がん幹細胞が減少することが報告されています。
さらに、HIF-1αを活性化した口腔扁平上皮がん細胞にクラスIIヒストン脱アセチル化酵素を過剰発現させる実験結果から、ヒストン脱アセチル化酵素阻害剤はがん細胞のワールブルグ効果を是正する効果を持つことが示唆されているのです。
【糖質制限は炎症を抑制する】
健康な人に比べて糖尿病の人は、口腔内の炎症所見や前がん病変やがん性腫瘍の率が高いということ結果が報告されており、炎症と頭頚部扁平上皮がん細胞の密接な関連は明らかと言えます。
この研究では、腫瘍のないグループの糖尿病患者(および血糖値が6.1mmol/L以上の高血糖を示す人)が9.7%であったのに対して、口腔がんの患者610人の中には糖尿病患者(および血糖値が6.1mmol/L以上の高血糖を示す人)が14.6%いたことを報告しています。
高血糖は単球やマクロファージから炎症性サイトカインと活性酸素の産生を用量依存的に高めます。炎症性サイトカインと活性酸素は低酸素誘導因子-1(HIF-1)を活性化しその結果、解糖系を活性化することになります。
高血糖と炎症の関連は、がん性悪液質でも認められます。
実際に、Ernst Freundは1885年にすでに、70人のがん患者中全ての70人に高血糖状態にあることを記述しています。その観察から、彼は「異常に高い血糖はがんの存在に必要である」と結論しています。
このような観察と関連して、多くのがんにおいて高血糖は予後不良の指標として認められています。
したがって、がん患者が栄養サポートの目的で単純糖(蔗糖やグルコースなど)を摂取して引き起こされる一過性の高血糖状態を避けることが大切です。
1073例の頭頚部扁平上皮がん患者を対象にした臨床試験(RTOG 90-03)のデータの解析から、「放射線治療の前に栄養学的サポートを行うと、治療に関連した体重減少は減らすことができるが、局所再発の抑制率や5年生存率は、それぞれ28%と33%減少する」ということが報告されています。
頭頚部がんの放射線治療において栄養サポートは、局所再発と死亡を増やす高度に有意な(P<0.0001)危険因子として認められたのです。
この栄養サポートで使用された詳細な栄養構成の情報は得られていませんが、その当時の栄養補助の食品はグリセミック指数の高い糖質を多く含むのが特徴で、そのため、このような栄養サポートの結果、血糖とインスリンが上昇し、炎症を悪化させたと予想されます。
【放射線治療中の糖質制限】
放射線治療は頭頚部がんの治療において手術と同様に主要な治療法となっています。
頭頚部がんはしばしば放射線治療に対して抵抗性を示しますが、この放射線抵抗性の原因として解糖系亢進が関与しています。したがって、食事の内容を変えることによって放射線抵抗性を変えることが可能です。
すなわち、放射線治療や抗がん剤治療中にカロリー制限や糖質制限を行うと、放射線や抗がん剤に対するがん細胞の感受性は高まり、逆に正常細胞はこれらの治療法による傷害から保護されることが動物実験で明らかになっています。
このがん細胞と正常細胞の応答の違いには、AMPKやNAD依存性クラスIIIヒストン脱アセチル化酵素阻害剤のサーチュイン-1(SIRT1), ペルオキシソーム増殖因子活性化受容体α(PPARα)、転写因子のPGC-1αなどから構成されるエネルギー・センサーのネットワークが関与しています。
正常な組織では、このネットワークは通常、血糖を低下させ脂肪代謝を促進するようなストレス(カロリー制限や絶食や運動や糖質制限)によって活性化されます。
AMPK/SIRT1/PPARα/PGC-1αシグナル伝達系はミトコンドリアの増生と呼吸を亢進するだけでなく、オートファジーの機序によって細胞内の不良タンパク質を除去し、細胞を炎症やDNAダメージから保護する作用があります。このネットワークは正常細胞を放射線や抗がん剤によるダメージから保護する作用があります。
正常細胞はケトン体を容易に酸化することができ、その結果ミトコンドリアのNADP+/NADPH比を低下させ、活性酸素を消去する還元型グルタチオン(GSH)の量を増やします。
ケトン体のこの抗酸化作用はがん細胞には適用されません。その理由は、がん細胞はケトン体を代謝する酵素を欠損しているか低酸素によってケトン体を代謝できないからです。
一方、ケトン体のヒストン脱アセチル化酵素阻害作用は、高度に放射線抵抗性の性質をもつ頭頚部扁平上皮がんのがん幹細胞を弱らせる作用があります。
糖質制限は脂肪酸の酸化を亢進し、その結果、細胞内のNAD+/NADH比を高め、NAD+依存性のSIRT1活性を亢進します。
SIRT1は放射線治療で生じるDNAのダメージの修復を促進し、がん抑制因子として働きます。
SIRT1はp53やFOXO(forkhead box O)転写因子と相互作用して、細胞周期を停止させる作用があります。細胞分裂している細胞は放射線や抗がん剤による細胞傷害を受けやすいので、細胞周期を停止させる作用は放射線や抗がん剤からのダメージを防ぐ作用になります。
つまり、放射線治療の前に糖質制限を行うと、正常細胞は細胞周期を停止して放射線にダメージを受けにくい状態になるのです。
このようなSIRT1を介して細胞を放射線傷害から保護するメカニズムは頭頚部がん細胞では十分に働かないかほとんど欠損していると考えられています。
例えば、正常粘膜の細胞に比べて、頭頚部扁平上皮がん細胞では、細胞核内のSIRT1量が低下していることが報告されています。
さらに、FOXO転写因子はAktによってリン酸化されると核から出て細胞質内で分解されて不活性化されます。頭頚部扁平上皮がん細胞ではAktが恒常的に活性化されておりさらにp53が不活性化しているので、FOXO転写因子を介するDNA修復遺伝子の転写や、糖質制限による細胞周期停止のメカニズムは働かなくなっています。
頭頚部扁平上皮がんに放射線治療を行っている間に一部のがん細胞が再増殖することがありますが、糖質制限はこのようながん細胞の再増殖を抑制する作用があります。
糖質制限が腫瘍の増殖を抑制することは、移植腫瘍や発がん実験など様々な動物実験で示されています。
このような研究の多くはケトン食の有効性を確認しています。また、培養がん細胞を使った実験では、ケトン体自身ががん細胞の増殖を抑制する作用はある種のがん細胞で示されています。
以上をまとめると、糖質制限はがん細胞に対しては抗がん剤や放射線照射の効果を高める作用があり、一方正常細胞に対してはこれらの傷害から細胞を守る作用があるので、頭頚部がんの治療に糖質制限を併用することは有用であると言えます。
【糖質制限は身体組成に良い影響を与える】
頭頚部がん患者では体重減少が起こりやすいという問題があります。がんと診断された時点ですでに体重減少を認めることがあり、これは栄養不良や悪液質の初期の状態と示唆しています。
頭頚部がん患者は、がん自体あるいはがん治療に関連して、嚥下障害や口内乾燥症(唾液分泌の低下)や口内炎や食欲不振などの問題によって食事摂取が不十分になりやすい傾向にあります。
悪液質は、脂肪組織だけでなく筋肉組織も進行性に減少するのが特徴で、通常の栄養不良や低カロリー摂取による生理的状態とは異なる病態です。
がん組織と宿主との複雑な関係において、様々な因子が悪液質の発症に関与していますが、最も重要なのは全身的な慢性的炎症状態です。
がん関連の体重減少において筋肉組織の減少が、体力や抵抗力の低下の原因として重要です。
筋肉組織の減少によって、体力が低下し、生活の質が悪くなり、治療に対する抵抗力が低下します。
がん患者ではその初期の段階において「潜在的な栄養不良」が起こっており、その原因としてがん患者では早期の段階から全身的なインスリン抵抗性の状態にあることと関連していると思われます。
それは、肥満に置けるアディポカイン(adipokines)のように、がん患者における炎症性サイトカインがこのインスリン抵抗性の原因となっていると考えられます。
インスリン抵抗性は全身的な代謝に重要な影響を及ぼします。まず肝臓に対しては、がん細胞からの乳酸と筋肉組織からのアラニンと脂肪組織からのグリセリンを用いて糖新生が亢進します。
この糖新生は、エネルギーを消費する生化学的反応であるため、体重減少の原因になります。
肝臓と筋肉組織ではグルコースの取込みと貯蔵が阻害され、グルコースの代謝が低下します。
一方、脂肪酸の酸化(分解)は次第に亢進し、グルコースを十分に補ってもこの脂肪分解を阻止することはできません。
最終的には、病気が進行して炎症状態が長く続くと、肝臓において急性期タンパク質(炎症に対応するタンパク質など)の産生に必要なアミノ酸を得るために筋肉組織の分解が進行していきます。
このような体の代謝の変化は、エネルギー源としてグルコースの利用が低下し、脂肪の利用率が高くなることを意味しています。
この現象は、グルコースの取込みと代謝が亢進しているがん組織の代謝とは逆です。
このようながん患者におけるがん組織と生体(宿主)側の代謝の違いが、高脂肪低糖質食あるいはケトン食ががん患者の食事として推奨される根拠となります。
残念なことに、このような食事に関する臨床試験は少なく、進行したがん患者に対して行われたものしかありません。
抗がん剤治療を受けている進行した消化器系がんの患者を対象にしたランダム化比較試験において、11例は通常の食事で、12例は通常の食事に脂肪の多い飲料(カロリーの66%が脂肪から)を与えて比較されました。
両グループの摂取カロリーは同じでしたが、通常の食事のグループでは持続的な体重減少が見られたのに対して、脂肪の多い飲料を補充したグループでは4週と8週後の測定で体重の増加を認め、筋肉量も維持されていました。
Fearonらは、がん性悪液質の度合いが極度に強い5例(平均体重38.6kg)に、カロリーの70%を中鎖脂肪酸中性脂肪から摂取しケトン体のβヒドロキシ酪酸を補充したケトン食を与えて検討しました。
1週間後には、この患者たちは約2kgの体重増加を認め、身体機能も改善しました。
長期の飢餓状態のとき、ケトン体が筋肉の分解を抑制するという生理作用がありますが、悪液質の状態でもこのケトン体の筋肉維持作用が働いていることが示唆されます。
ラットを使って実験では、ケトン体は分岐アミノ酸の分解を阻止し、糖新生に使われるアラニンの放出を減らすことによって、筋肉組織の異化(分解)を減少させる作用があることが示されています。
一般人およびトップレベルのスポーツ選手を対象にした研究でタンパク質の豊富なケトン食を数週間実施すると、体重が少し減少し、筋肉量は増加することが示されています。
【考察:頭頚部がん患者において糖質制限は現実的か?】
今まで述べた様々な証拠が、糖質制限ががん細胞の解糖系を阻害し、がん患者の代謝を正常化し、放射線治療の副作用を軽減し抗腫瘍効果を高めることを示していますが、それでもケトン食の科学的根拠や有用性に疑問をもつ研究者もいます。
これは恐らく、一般的に推奨されている標準的な食事内容に比べて糖質制限やケトン食があまりに極端に異なる内容であるため、懐疑的ななっているのかもしれません。
ケトン食に対する議論には、ケトアシドーシスへの不安、過剰な体重減少、コレステロール値の上昇、腎臓障害、脳の働きは糖質に依存するという考えなどがあります。しかし、このような不安や推測のどれも科学的根拠のないものです。
全く逆に、がん患者に関する論文の多くは、非常に進行した段階のがん患者でも糖質を減らしタンパク質を増やした食事は何の副作用も起こさずに体の異化を阻止し、血液検査の指標や生活の質を改善することを証明しています。
一旦、悪液質状態になると、どのような栄養的サポートも体重減少を止めることはできません。
さらに悪液質の患者の多くはケトン体を産生することができにくくなっています。
したがって、頭頚部がん患者の栄養不良の状態になってきた場合は、体重減少が不可逆的になる前に、低糖質の食事を行うべきです。
放射線治療中の頭頚部がん患者の糖質制限食が、通常の食事や何ら食事指導しない場合に比べて、生存率を改善するかどうかの結論はまだ出ていませんが、長期におよぶ体重減少を阻止し生活の質を改善する目的では十分に有効であることが示されています。
通常の高糖質食による栄養サポートが治療中の体重維持には有効ではあるが、死亡率を高めるという結果が出ているので、糖質制限の食事は非常に重要です。
頭頚部がん患者において、高血糖とがん細胞の増殖を誘発するリスクを最小限にする目的で低糖質食を実施する場合の個々の指導に関する要点を示します。
まず第一に、個々の患者における食事摂取や栄養状態における問題点を評価します。
頭頚部がん患者によくみられる嚥下障害や口腔乾燥症や嚥下痛などの問題は、多くの場合、食品を混和したり、液体サプリメントを使用することによって対処することができます。
低糖質食は脂肪の多い料理になりますが、脂肪が多い料理はクリーミーな性状になり飲み込みが容易になります。
患者がまだ栄養不良の状態でなく、高脂肪食に耐えられない場合は、単純な糖質制限か、高グリセミック指数の糖質を避けるか、あるいは間欠的な絶食というのが代替の食事として試してみる価値があります。
しかしながら、もし患者が栄養不良の状態であるか、あるいは経口摂取によって十分なカロリーを得ることができない場合は、チューブ栄養を検討する必要があります。そのとき、低糖質高脂肪食を適用するチャンスになります。そして、ケトン食を実践すれば、この論文で解説したような様々なメリットを得ることができます。
ケトン症(ケトーシス)の状態を高めるためには、タンパク質摂取のための食品の違いも考慮する必要があります。食事から摂取したアミノ酸が体内でタンパク質に合成される割合を「net nitrogen utilization」と言いますが、これが低いと肝臓で糖新生に使用され血糖を高めることになります。
卵や肉のように、net nitrogen utilizationの高い(体内でタンパク質に合成される率が高い)食品を多く摂取すると、ケトン症を高めることができます。
最後に、頭頚部がん患者における糖質制限の有用性をさらに高めるためには、抗炎症作用やがん細胞の代謝異常を是正する治療法などと組み合わせるような多面的な治療が大切です。
これには、オメガ3系不飽和脂肪酸のような栄養成分であったり、治療後の筋肉の量や強さの回復を役立つレジスタンス運動のようなものも含まれます。
結論として、頭頚部がん患者における糖質制限は実行可能であり、現実的な治療法と言えます。
以上です。


画像をクリックするとサイトに移行します。
新 刊 紹 介

詳しくはこちらへ
◯ 漢方漢方煎じ薬についてはこちらへ